低声压级次声对大鼠脑缺血再灌注后胶质纤维酸性蛋白表达的影响①
2013-03-08李德洁范建中吴红瑛何任红陈琦刘夏
李德洁,范建中,吴红瑛,何任红,陈琦,刘夏
低声压级次声对大鼠脑缺血再灌注后胶质纤维酸性蛋白表达的影响①
李德洁,范建中,吴红瑛,何任红,陈琦,刘夏
目的 探讨低声压级次声对大鼠脑缺血再灌注后周围胶质纤维酸性蛋白(GFAP)表达的影响。方法线栓法制作大脑中动脉脑缺血(MCAO)2 h再灌注模型。将36只雄性Sprague-Dawley大鼠随机分成假手术组(n=12)、次声组(n=12)和模型组(n=12),每组再分为3 d、7 d两个亚组,每组6只。次声组在缺血再灌注12 h后连续予次声干预2 h/d,模型组干预过程中除不开机外,其余过程同次声组,假手术组不做任何干预。在治疗3 d、7 d后(处死前)对大鼠进行神经功能缺损评分(mNSS),脑组织切片采用免疫组织化学方法观察脑缺血周围GFAP表达变化。结果次声7 d组大鼠mNSS评分较模型组降低(P<0.05);次声组脑缺血周围GFAP表达的积分光密度(IOD)均较模型组显著增高(P<0.001)。结论低声压级次声能增强大鼠脑缺血再灌注后GFAP的表达。
次声;缺血/再灌注;胶质纤维酸性蛋白
[本文著录格式]李德洁,范建中,吴红瑛,等.低声压级次声对大鼠脑缺血再灌注后胶质纤维酸性蛋白表达的影响[J].中国康复理论与实践,2013,19(2):124-128.
脑卒中具有高发病率、高致残率的特点。中国每年新发脑卒中患者约200万人,其中70%~80%的脑卒中患者因为残疾不能独立生活[1]。循证医学证实,脑卒中康复是降低致残率最有效的方法,也是脑卒中组织化管理模式中不可或缺的关键环节[2]。物理因子治疗作为康复治疗的一种手段,正日益得到康复医师的重视,目前使用的康复物理因子主要包括声、光、电、磁等。而次声作为物理因子的一种,是频率在0.0001~20 Hz之间的声波,由物体机械振动产生。有报道称,低声压级次声可通过轻柔的共振作用,改善局部循环,增加细胞活力,从而对生物体产生有利作用[3]。本实验将通过研究低声压级次声对缺血再灌注大鼠脑保护作用机制,为将来脑缺血神经康复治疗提供相关理论基础和新的治疗手段。
1 材料与方法
1.1 实验材料
1.1.1 动物分组 健康Sprague-Dawley雄性大鼠36只,体重230~270 g,南方医科大学实验动物中心提供,室温、安静环境、常湿饲养,普通饲料,自由饮水。质量合格证号:SCXK(粤)-2011-0015。将大鼠36只随机分为假手术组、模型组和次声组,每组各12只。
1.1.2 试剂和仪器 次声治疗仪Infrasound 8TM(美国CHI公司);光学显微镜(日本Olympus);数码相机(日本Olympus);GFAP一抗(Abcam,兔抗大鼠),二抗(山羊抗兔,EnVision,DAKO);Olympus DP controller拍照系统(日本Olympus);Image-Pro Plus 6.0图像处理系统(USAMedia Cybernetics)。
1.2 方法
1.2.1 造模 参照Longa[4]报道的线栓法并加以改进,线栓采用直径为0.24~0.26 mm、长度为4.0 cm的尼龙鱼线。以10%水合氯醛(0.45 ml/100 g)腹腔注射麻醉后,仰卧位固定,无菌消毒,分离并暴露右侧颈总动脉及颈内外动脉,线栓由颈外动脉插入颈内动脉,插入大脑中动脉时稍遇阻力,即可停止,进线长度约18 mm,2 h后拔出线栓实现缺血再灌注,缝合手术切口,手术过程中维持肛温37℃左右,安静环境下饲养。假手术组不插入尼龙线,余过程同前。
在规定缺血时限内(术后2~3 h)按Longa[4]5分制评分标准评分:0分,无神经损伤症状;1分,不能伸展对侧前爪;2分,向外侧划圈;3分,向对侧倾倒;4分,不能自发行走,意识丧失。1分以上视为造模成功。
对造模成功大鼠进行随机分组,每组分3 d、7 d两个亚组,每个亚组6只,如未出肢体瘫痪(0分)或已死亡的动物被剔除,采用差额补充的方法以保证每个亚组各6只大鼠。次声组的各亚组分别在缺血再灌注12 h后连续给予次声干预2 h/d,模型组干预过程中除不开机外,其余过程同次声组。
1.2.2 次声信号参数和处理方法 次声治疗仪Infrasound 8TM由次声声头和主机两部分组成,主机面板上输出档位分为3种次声频率和强度组合档,本实验用3档进行处理。经第四军医大学等单位研制的“便携式野外低频信号实时测试智能分析系统”对实验中的次声信号测试,结果显示该仪器在3档时输出次声频谱主要集中4~20 Hz,次声主频信号的频谱是随机变化的,声强79.75~86.11 dB。
1.2.3 疗效评价 各组大鼠神经行为学评分于处死前参照改良神经功能缺损评分(modified Neurological Severity Score,mNSS)[5]进行,最后经心脏灌注取脑切片进行HE染色及免疫组织化学显色,观察各组大鼠行为学评分及脑缺血周围胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)表达的变化。
1.2.4 标本制作 各组动物到达预定时间后,用10%水合氯醛(0.45 ml/100 g)麻醉,用经处理后头端较钝的16号针针头穿刺入左心室至主动脉起始部,眼科剪剪开右心耳,先用200 ml生理盐水快速冲洗体内血液,续用4%多聚甲醛250 ml进行灌注固定,断头取脑,在视交叉前后1~3 mm之间取脑片,用同一固定液后固定6~8 h。常规脱水、透明、石蜡包埋,冠状切片,片厚5 μm,备用。
1.2.5 HE染色 石蜡切片常规用二甲苯脱蜡,经各级乙醇至水洗,入苏木素染色5 min,自来水冲洗,70%的盐酸乙醇分色30 s,水洗后酸化伊红复染2 min,水洗,脱水、透明、中性树胶封片。
1.2.6 GFAP免疫组化 切片进行常规透明,梯度酒精脱蜡,采用高压热修复,将切片置于柠檬酸缓冲液(pH=6.0)高压锅煮沸3~5 min,3%过氧化氢封闭后加入GFAP(1∶800)一抗,4℃孵育过夜,复温后加入二抗,孵育30 min,加入DAB显色(具体操作见DAKO说明书),常规脱水透明封片。阴性对照用PBS缓冲液代替一抗,其余步骤相同。
1.2.7 图像采集与分析 一个标本取一张切片,在同等亮度、像素、曝光、对比度等条件下采用光学显微镜及Olympus DP controller拍照系统用10×40放大倍数,在脑缺血周围随机取6个视野,对GFAP指标进行统一图像拍照,保证每个亚组有36个视野,最后用Image-Pro Plus 6.0图像处理系统计算出每一个视野的积分光密度值(integrated optical density,IOD)。
1.3 统计学分析
采用SPSS 13.0统计学软件进行分析。数据符合正态分布,各组数据以(±s)表示,数据符合正态分布,各组之间比较采用独立样本t检验,显著性水平α=0.05。
2 结果
2.1 mNSS
假手术组术后基本正常,各时间点mNSS总分均为0分。次声组、模型组与假手术组比较均有神经功能损伤。次声3 d组与模型3 d组评分无显著性差异(P>0.05);模型7 d组得分低于模型3 d组(P<0.05);次声7 d组得分明显低于次声3 d组(P<0.01);次声7 d组得分低于模型7 d组(P<0.05)。见表1。

表1 模型组和次声组mNSS评分
2.2 HE染色
假手术组形态结构清楚,神经元细胞数目多,细胞排列规整,核深染,核膜清晰,核仁明显。模型3 d组脑缺血周围可见组织结构紊乱、疏松,胶质细胞稍增生,数量增多,神经元细胞正常形态消失、部分神经元细胞核固缩,胞体缩小变形,残留的神经元细胞周围间隙增宽。次声3 d组缺血区组织结构紊乱,胶质细胞增生,神经元细胞正常形态消失,可见残留萎缩的红色神经元细胞。泡沫细胞增多,可见噬神经现象。模型7 d组缺血中心区域组织结构紊乱,神经元细胞核固缩,脑缺血周围胶质细胞增生,数量较模型3 d组增加,炎性浸润。次声7 d组缺血区周围胶质细胞增生更加明显,可见泡沫细胞和噬神经现象。见图1。
2.3 GFAP免疫组化
在20×10光学显微镜下观察,假手术组侧脑室室管膜下区有少量GFAP表达,而模型组、次声组侧脑室室管膜下区的GFAP表达增多,以次声组最为明显(以7 d组为例)。见图2。
在40×10光学显微镜镜下观察结果,假手术3、7 d组偶见少量阳性表达,颜色较浅,突起纤细,IOD值较小,不纳入统计比较。次声各组与模型各组GFAP阳性表达明显增多,着色深染,突起增多,尤其次声各组阳性表达更为明显。见图3。
2.4 IOD
在40×10光学显微镜下观察,模型7 d组IOD明显高于模型3 d组(P<0.01);次声各组IOD均显著高于相应模型各组(P<0.001);次声7 d组IOD明显高于次声3 d组(P<0.01)。见表2。

图2 各7 d组GFAP免疫组化染色(光学显微镜,200×)
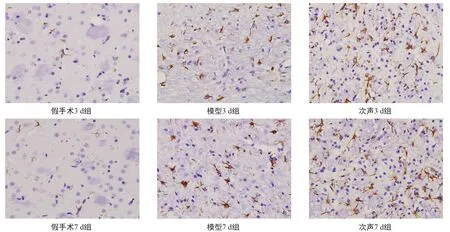
图3 各组GFAP免疫组化染色(光学显微镜,400×)

表2 在40×10光学显微镜下各组GFAP表达的IOD
3 讨论
脑缺血后病灶中心区神经元死亡引起的神经功能缺损至今无确切有效的药物治疗方法,但是能否在早期康复介入以减少继发性功能障碍已成为成为康复医学的一个热点话题。目前许多研究显示,卒中后早期进行的经颅磁刺激和神经肌肉电刺激等康复治疗能更有效促进脑卒中患者偏瘫肢体功能的恢复[6-7],但是有关次声对脑缺血后神经修复研究鲜见报道。
我们曾应用次声治疗仪Infrasound 8TM产生的低声压级次声作用于脑缺血再灌注大鼠,结果证实低声压级次声在每天作用120 min,连续7 d,可明显改善神经症状,缩小梗死面积,并通过刺激胰岛素样生长因子-1分泌从而起到脑保护作用[8]。袁华等利用8 Hz、90 dB和130 dB次声作用于大鼠,每天2 h,分别作用1、7、14、21、28 d后发现次声使大鼠海马中GFAP阳性胶质细胞的数量增加,得出8 Hz、90 dB和130 dB次声可以激活大量星形胶质细胞,对神经元具有保护作用的结论。研究仅局限于正常大鼠,未对脑缺血大鼠进行研究探讨[9]。张国锋等对脑缺血再灌注损伤大鼠应用16 Hz、130 dB次声预处理可明显减轻大鼠脑梗死的容积,改善神经功能学评分[10],未对星形胶质细胞是否参与脑保护做进一步研究。唐晨等在低声压级次声对大鼠海马多唾液酸神经细胞黏附分子(PSA-NCAM)表达的影响研究中发现,16 Hz、90 dB次声作用可引起大鼠海马(PSA-NCAM)表达增强,提示低强度次声在导致中枢神经损伤同时,还能促使机体启动修复机制,增强神经干细胞迁移能力,从而参与次声性脑损伤的修复[11]。
在上述研究基础之上,我们希望通过研究次声处理后脑缺血周围GFAP表达变化及神经行为学变化进一步证明次声能够通过影响脑缺血后星形胶质细胞而起到脑保护作用。因为GFAP是脑内成熟星形胶质细胞主要的中间纤维蛋白,是细胞骨架蛋白,GFAP在星形细胞中有丰富而特异性的表达,是星形细胞活化的客观标志蛋白。星形胶质细胞是中枢神经系统中最多的细胞类型,约占正常成年人脑细胞总数的40%。既往研究观点认为,星形胶质细胞可以形成胶质瘢痕,阻止轴突再生穿越[12],但是近10年随着对星形胶质细胞研究日益增多,越来越多的研究发现在中枢神经损伤后星形胶质细胞可以分泌多种神经营养因子,如血管内皮生长因子、脑源性神经营养因子、神经生长因子、碱性成纤维细胞生长因子等,保护受损神经元,增加突触联系,促进神经修复及神经功能恢复[13-16]。
本研究中HE染色发现,脑缺血后脑缺血周围胶质细胞增多,胶质细胞包括星形胶质细胞、少突胶质细胞及小胶质细胞。我们通过免疫组织化学方法观察脑缺血周围GFAP表达变化来反映星形胶质细胞变化。根据实验结果我们发现,20×10光学显微镜下脑缺血7 d的模型组及次声组患侧脑室室管膜下区GFAP表达明显增多,尤其次声组更为显著。在40×10光学显微镜下发现,次声组脑缺血周围GFAP的IOD较模型组显著增加(P<0.001)。但是次声3 d组与模型3 d组mNSS评分无显著性差异(P>0.05);次声7 d组较模型7 d组评分下降(P<0.05);模型7 d评分低于模型3 d组(P<0.05);次声7 d组评分低于次声3 d组(P<0.05)。次声干预3 d能够促进GFAP的表达,但是行为功能症状改善情况与对照组相比不够明显,而次声干预3 d相比次声干预7 d能够显著增加GFAP的表达,并改善缺血后大鼠的神经行为功能症状。
根据实验结果初步推断,次声干预7 d后大鼠脑缺血周围星形胶质细胞表达增多以及神经症状的明显改善可能是由于人体及动物组织器官的固有振荡频率通常在20 Hz以下,处于次声场内的人及动物的组织器官与次声产生共振效应[3]。在共振效应作用下,脑缺血周围的星形胶质细胞除了由静止的星形胶质细胞活化而来[17]以外,还可能和次声激活大量侧脑室室管膜下区星形胶质细胞增殖有关。增殖的侧脑室室管膜下区星形胶质细胞在次声和脑产生共振效应引导下向脑缺血周围迁移,分泌多种神经营养因子参与神经修复,从而促进脑缺血后大鼠神经症状恢复。
由于本次实验主要集中研究低声压级次声对脑缺血再灌注损伤后急性期星形胶质细胞表达情况的影响,未能对于后期星形胶质细胞及轴突情况进行研究。结合本次实验结果初步推断,脑缺血再灌注次声治疗后胶质细胞的大量增生,可能因为早期暂未形成胶质瘢痕阻碍轴突再生、穿越,而主要起到促进神经生长因子分泌、神经重塑、增加突触联系,进而改善神经功能作用。具体机制有待后续实验进一步证实。
[1]吴兆苏,姚崇华,赵冬.我国人群脑卒中发病率、死亡率的流行病学研究[J].中华流行病学杂志,2003,24(3):236-239.
[2]Thorsén AM,Holmqvist LW,de Pedro-Cuesta J,et al.A randomized controlled trial of early supported discharge and continued rehabilitation at home after stroke:five-year follow-up of patient outcome[J].Stroke,2005,36(2):297-303.
[3]Pei Z,Sang H,Li R,et al.Infrasound-induced hemodynamics, ultrastructure,and molecular changes in the rat myocardium[J].Environ Toxicol,2007,22(2):169-175.
[4]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989,20(1):84-91.
[5]Chen JL.The modified neurological severity score,mNSS[J]. Stroke,2001,32(11):2682-2688.
[6]Quinn TJ,Paolucci S,Sunnerhagen KS,et al.Evidence-based stroke rehabilitation:an expanded guidance document from the European sStroke Organisation(ESO)guidelines for management of ischaemic stroke and transient ischaemic attack 2008[J].J Rehabil Med,2009,41(2):99-111.
[7]Popović DB,Popović MB.Hybrid assistive systems for rehabilitation:lessons learned from functional electrical therapy in hemiplegics[J].Conf Proc IEEE Eng Med Biol Soc,2006,1: 2146-2149.
[8]李川,范建中,吴红瑛,等.低声压级次声对大鼠脑缺血再灌注损伤的影响[J].中国康复医学杂志,2009,24(5):419-422.
[9]袁华,龙华,李玲,等.次声作用后大鼠海马星形胶质细胞的变化[J].中国临床康复,2002,6(23):3500-3501.
[10]张国锋,赵纲,杜芳.16Hz 130 dB次声预处理对大鼠局灶性脑缺血的保护作用[J].中华神经外科疾病杂志,2009,8(6): 488-491.
[11]唐晨,李玲,袁华,等.低声压级次声对大鼠海马多聚唾液酸神经细胞粘附因子表达的影响[J].中华物理医学与康复杂志, 2012,34(8):561-564.
[12]赵敏,刘少君.中枢神经损伤后影响轴突再生的因素[J].生理科学进展,2004,35(2):107-112.
[13]Himeda T,Tounai H,Hayakawa N,et al.Postischemic alterations of BDNF,NGF,HSP 70 and ubiquitin immunoreactivity in the gerbil hippocampus:pharmacological approach[J].Cell Mol Neurobiol,2007,27(2):229-250.
[14]Wei OY,Huang YL,Da CD,et al.Alteration of basic fibroblast growth factor expression in rat during cerebral ischemia[J].Acta Pharmacol Sin,2000,21(4):296-300.
[15]Middeldorp J,Hol EM.GFAP in health and disease[J].Prog Neurobiol,2011,93(3):421-443.
[16]Colangelo AM,Cirillo G,Lavitrano ML,et al.Targeting reactive astrogliosis by novel biotechnological strategies[J].BiotechnolAdv,2012,30(1):261-271.
[17]Buffo A,Rite I,Tripathi P,et al.Origin and progeny of reactive gliosis:A source of multipotent cells in the injured brain[J].Proc NatlAcad Sci U SA,2008,105(9):3581-3586.
Effect of Infrasound on Expression of Glial Fibrillary Acidic Protein after Cerebral Ischemia/Reperfusion in Rats
LI De-jie,FAN Jian-zhong,WU Hong-ying,et al.Department of Rehabilitation,Nanfang Hospital of Southern Medical University,Guangzhou 510515, Guangdong,China
ObjectiveTo explore the effect of infrasound on the expression of glial fibrillary acidic protein(GFAP)after cerebral ischemia/reperfusion in rats.MethodsThe model of cerebral ischemia/reperfusion in rats was induced with intraluminal middle cerebral artery occlusion(MCAO)with nylon monofilament suture.36 male adult Sprague-Dawley rats were randomly divided into sham group(n=12), model group(n=12)and infrasound group(n=12),then each group was randomly divided into 3 d and 7 d subgroups,with 6 rats in each subgroup.The infrasound group was treated with infrasound for 2 h every day 12 h after operation,the model group was treated in the same way turning off the power,the sham group received no treatment.They were evaluated with the modified Neurological Severity Score (mNSS)3 and 7 d after treatment(before being executed),and brain tissue slices were immunohistochemically stained to observe the expression of GFAP around the ischemic sites.ResultsCompared to the model group,the mNSS score in 7 d infrasound group decreased significantly(P<0.05),the integral optical density(IOD)of GFAP around the focus was significantly higher in the infrasound group than in the model group(P<0.001).ConclusionInfrasound can increase the expression of GFAP after cerebral ischemia/reperfusion in rats.
infrasound;ischemia/reperfusion;glial fibrillary acidic protein
R743
A
1006-9771(2013)02-0124-05
2012-08-13
2012-09-17)
南方医科大学南方医院院长基金(No.2010Z005)。
南方医科大学南方医院康复医学科,广东广州市510515。作者简介:李德洁(1984-),男,江苏徐州市人,硕士研究生,主要研究方向:神经系统疾病康复。通讯作者:范建中。
10.3969/j.issn.1006-9771.2013.02.007
