藤甲酰苷缓释片的处方优化及释药机制研究
2013-03-06李文军陈烨李彤旻王洋刘忠忱邓晶晶辽宁大学药学院沈阳110036
李文军,陈烨,李彤旻,王洋,刘忠忱,邓晶晶(辽宁大学药学院,沈阳 110036)
藤甲酰苷缓释片的处方优化及释药机制研究
李文军,陈烨,李彤旻,王洋,刘忠忱,邓晶晶(辽宁大学药学院,沈阳 110036)
目的 制备藤甲酰苷缓释片并探讨其药物释放机制。方法 以羟丙基甲基纤维素(HPMC)为缓释材料、乙基纤维素(EC)为凝胶骨架材料,以及乳糖等为填充剂制备藤甲酰苷缓释片,采用正交设计法进行处方优化。使用DDslover软件拟合释放曲线。结果 采用湿颗粒压片法制得的骨架型藤甲酰苷缓释片具有良好的缓释效果。藤甲酰苷缓释片的体外释药行为符合Higuchi 模型,是扩散和溶蚀协同作用的结果,其释药过程用 Higuchi平面扩散模式方程,相关系数r=0.999 3(1~12 h)。结论 本方法制备的藤甲酰苷缓释片符合体外释放度要求。
藤甲酰苷;羟丙基甲基纤维素;缓释片;释药机制
藤甲酰苷(garcinia glycosides)为新实体化合物,体外药理学研究表明,藤甲酰苷对白血病细胞株HL-60(TB)和黑色素瘤细胞株LOX IMVI具有明显的抑制作用[1]。动物实验研究显示,其口服半衰期为2.2 h,代谢速度较快。多次连续给药不利于临床对患者的治疗,同时产生很大的毒性,为研制出适合临床治疗的更为安全、有效、方便的抗肿瘤新药,笔者采用亲水性高分子材料羟丙基甲基纤维素(HPMC)为主要缓释材料、乙基纤维素(EC)为骨架材料、乳糖为致孔剂、微晶纤维素为添加剂,制备藤甲酰苷亲水凝胶骨架型缓释片,并以不同时间点的累积释放度为评价指标,确定具有较理想缓释行为的优化处方,制备了12 h服1次的藤甲酰苷缓释片(60 mg·片-1),并对其药物释放机制进行初步探讨。
1 仪器与试药
DP30型单冲压片机(上海天凡药机制造厂);RZC-6C2型药物溶出仪(上海黄海药物仪器有限公司);Waters 1525 Brnary 高效液相色谱仪/泵(美国Waters公司);Waters 2487 Dual λ高效液相色谱仪/检测器(美国Waters公司);Lambda 25 型可见-紫外分光光度计(美国Perkin Elmer公司);数字显示式恒温干燥箱(余姚市远东数控仪器厂);电子天平(Mettler-Toledo Group)。
藤甲酰苷对照品(辽宁大学药学院研制,纯度:99.5%,批号:20100306);藤甲酰苷原料(辽宁大学药学院研制,批号:20100507);羟丙基甲基纤维素K4M(上海卡乐康包衣技术有限公司,批号:PD234600);乙基纤维素RT-N-10(山东瑞泰化工集团有限公司,批号:SH220590);硬脂酸镁(广州市升迅化工有限公司,批号:20090822);微晶纤维素(上海为昌医药辅料技术有限公司,批号:20090603);乳糖(哈尔滨制药厂,批号:20100320),其余试剂均为分析纯。
2 方法与结果
2.1 缓释片分析方法的建立
2.1.1 紫外吸收波长的选择 称取藤甲酰苷对照品2.3 mg,用甲醇溶解并定容至浓度为46 μg·mL-1的溶液,以溶剂为空白,于200~600 nm内进行紫外扫描。结果表明,藤甲酰苷在254,331 nm处均有最大吸收。确定331 nm为检测波长。
2.1.2 标准曲线的绘制
2.1.2.1 色谱条件 流动相:0.5%磷酸水溶液-甲醇(13∶87);色谱柱:Waters ODS2 C18(4.6 mm× 250 mm,5 μm);柱温:室温;进样量:20 μL;检测波长:331 nm;流速:1.0 mL·min-1。
2.1.2.2 标准曲线 精密称取藤甲酰苷对照品25.3 mg置于50 mL量瓶中,用甲醇溶解并稀释至刻度,摇匀,备用。精密吸取储备液2.0,2.3,2.5,2.7,3.0 mL,分别置于25 mL量瓶中,稀释至刻度,摇匀,进样。在331 nm处测定峰面积A,并以浓度c对吸收度A进行线性回归,得标准曲线方程:A=13 806.6c+7 887.6(r=0.999 8,n=5),结果表明,藤甲酰苷在40.48~60.72 μg·mL-1内线性关系良好。
2.1.2.3 释放度测定标准曲线 精密吸取50.6 μg·mL-1的对照品溶液10 mL于100 mL量瓶中,定容。精密吸取1,3,6,9,12 mL,分别置于25 mL量瓶中,用流动相稀释至刻度,摇匀,进样。在331 nm处测定峰面积A,并以浓度c对吸收度A进行线性回归,得标准曲线方程:A=19.98c+7 863.6(r=0.999 7,n=5),结果表明,藤甲酰苷在0.5~6.0 μg·mL-1内线性关系良好。
2.1.3 溶液稳定性试验 精密称取藤甲酰苷原料药,并按处方量称取相应比例的辅料,制备含藤甲酰苷约96 μg·mL-1的甲醇溶液,经0.8 μm微孔滤膜滤过,于0,2,4,6,12,24 h,按“2.1.2.1”项下色谱条件进行测定,结果表明,藤甲酰苷溶液在24 h内稳定,RSD为1.26%。
2.1.4 回收率及精密度试验 分别按处方量精密称取相当于含30 mg的藤甲酰苷量的辅料及80%,100%,120%的对照品各3份于量瓶中,用甲醇稀释后经0.45 μm微孔滤膜滤过,按“2.1.2.1”项下色谱条件,计算回收率,结果表明,藤甲酰苷的平均回收率为100.22%,RSD为0.54%,本法在线性范围内高、中、低浓度的日内精密度RSD分别为0.52%,0.40 %,0.51 %(n=3);高、中、低浓度的日间精密度 RSD分别为0.75%,0.50%,0.39% (n=3)。高、中、低浓度的回收率分别为(100.49± 0.98)%,(99.67±1.05)%,(100.59±0.65)%(n=3)。
2.1.5 释放度试验 取缓释片,采用溶出度测定法(中国药典2010年版二部附录ⅩC)[2]中的第一法,以900 mL 0.5%十二烷基硫酸钠为释放介质,温度为(37.0±0.5)℃,转速为100 r·min-1,依法操作,在规定的时间分别取样,经0.45 μm微孔滤膜滤过,按“2.1.2.1”项下色谱条件进行测定,并按下式计算累积释放度百分率Q,以时间为横坐标,药物的累积释放度为纵坐标,绘制释药曲线图。

式中:C为释放液的浓度(mg·mL-1);V为释放介质的体积(mL);D为稀释倍数;W为片剂的重量(g);F为药物在制剂中的百分含量(%)。
2.2 缓释片的制备
分别按处方量称取原料药及辅料倍量稀释法混合,连续3次过100目筛混合均匀,加适量无水乙醇制软材,20目筛制粒,55 ℃干燥,30目筛整粒,用ψ 11 mm浅凹冲模单冲压片机压片,控制片子硬度在4.0~6.0 kg·cm-2之间。片重约为300 mg,含药量约为60 mg·片-1。
2.3 含量测定
取“2.2”项下制备的藤甲酰苷缓释片20片,研成粉末,精密称取约含藤甲酰苷30 mg的粉末,置于50 mL量瓶中,加入适量甲醇,超声10 min,加入甲醇稀释至刻度,所得溶液经0.45 μm微孔滤膜滤过,弃去初滤液,取续滤液2 mL置于25 mL量瓶中,用流动相稀释至刻度,作为样品溶液;精密称取藤甲酰苷约30 mg置于50 mL量瓶中,用甲醇溶解并稀释至刻度,吸取配制的藤甲酰苷溶液2 mL于25 mL量瓶中,用流动相稀释至刻度,作为对照品溶液。分别取样品溶液和对照品溶液,按“2.1.2.1”项下色谱条件进行测定,计算样品的含量。测定结果表明,含量测定符合要求。
2.4 缓释片的处方筛选及质量评价
2.4.1 正交设计试验及最佳处方的确定 通过处方单因素和工艺单因素的考察,确定了主要辅料的种类、规格、用量等,在此基础上采用正交设计试验筛选出最优处方。以HPMC K4M作为亲水性骨架缓释材料,EC、乳糖为填充剂,控制片剂硬度在4.0~6.0 kg·cm-2内。按“2.2”项下方法制备缓释片,选择主要因素HPMC K4M的用量(A)、EC的用量(B)、乳糖的用量(C)作为主要考察因素,每个因素又选取3个水平,采用正交设计法L9(34)进行试验,正交试验表见表1。以转篮法转速为100 r·min-1分别测定12 h内药物的累计释放百分率。

表1 正交实验设计的因素及水平Tab 1 Facts and levels of excipient for orthogonal test
缓释制剂的评价方法有多种[3]。根据药物的理化性质和剂型的作用特点,本实验采用药物在2,6,12 h的累计释放百分率作为评价指标,进行处方筛选。本缓释片规定缓释片2 h释放量为20%~40%、6 h释放量为40%~65%、12 h释放量80%以上,确定理想释放量2 h为20%,6 h为55%,12 h为85%,根据不同时间点的累积释放量,可以在一定程度上判断出缓释片的缓释效果的好坏。因此为了准确的反映各种辅料对药物释放的影响,采用了综合评分法对正交设计实验的结果进行分析,即把累积释放量Q2h、Q6h、Q12h用参数S来表示。

S值越小,表明处方中药物在2,6,12 h的累积释放百分率越接近理想值,即缓释效果越好,S的具体数值见表2。通过直观分析,由极值R可知[4],各因素对释药速率的影响大小依次为:A>B>C。综合以上结果,可以确定最佳处方工艺组合为A2B2C2,即最优处方为:每100片含主药藤甲酰苷6.0 g、HPMC 8.0 g、EC 4.0 g、乳糖 12.0 g、硬脂酸镁 1.5 g。

表2 正交设计实验计算结果Tab 2 The calculation of the orthogonal experimental results
2.4.2 优化处方的批间重复性和均一性 按“2.4.1”项下方法,按优化处方制备3批藤甲酰苷缓释片样品,照“2.3”项下方法进行释放度测定,考察缓释片的批间重复性,结果表明,缓释片批间具有良好的重复性,结果见图1。按“2.4.1”项下方法,按优化处方制备藤甲酰苷缓释片,取同批样品6片,按“2.1.5”项下方法进行释放度测定,考察缓释片的批内均一性,结果表明,缓释片批间具有良好的均一性。结果见图2。
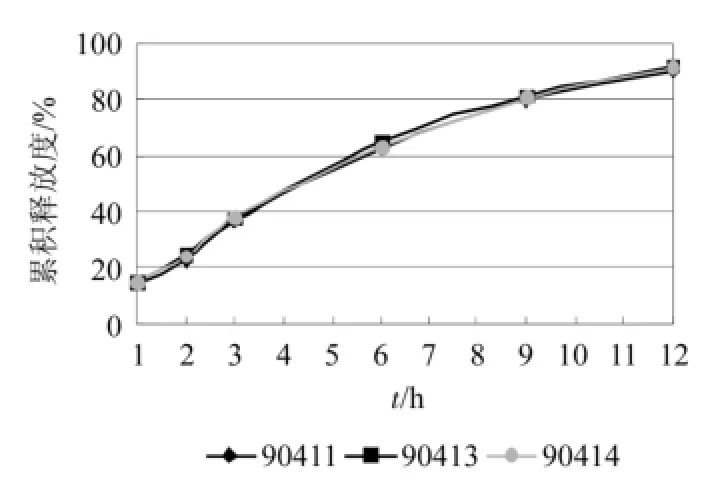
图1 藤甲酰苷缓释片不同批次的释药曲线Fig 1 Release profile of garcinia glycosides sustainedrelease tablets of diferent batches

图2 藤甲酰苷缓释片同一批次的释药曲线Fig 2 Release profile of garcinia glycosides sustainedrelease tablets from one batches
2.5 释放机制的初步探讨
药物从制剂中释放一般包括外扩散和溶蚀两个过程。HPMC亲水凝胶骨架片遇水后首先在片剂表面湿润,形成水凝胶层,使表面药物溶出;凝胶层继续水化,骨架膨胀,凝胶层厚度增加,延缓药物的释放,对于水溶性药物可以通过水凝胶层扩散进行释放,而水难溶性成分,则可能多数以固体颗粒形式分散于凝胶层中,进一步通过凝胶层的溶解才能释放出来;片剂骨架逐渐水化并溶蚀,水份向片芯渗透至骨架,使骨架完全溶蚀,最后药物完全释放[5]。
关于药物的释放机制科研人员已经做了大量的探讨和研究,建立了诸多的模型方程,主要有零级释药方程:Mt/M∞=kt;一级释药方程:Mt/M∞=1-ekt;Higuchi平面扩散模式方程:Mt/M∞=kt1/2;Ritger-Peppas方程:Mt/M∞=ktn。其中,t为时间,Mt为t时刻的药物释放量,M∞为最大药物释放量,k为药物释放速度常数[6-9]。
将按照优化处方制备的藤甲酰苷缓释片的释放度数据分别用零级释药方程、Higuchi方程、一级释药方程和Ritger-Peppas方程对最优处方的释放曲线进行拟合,采用DDsolver 软件计算结果见表 3。AIC值越小,MSC值越大,R2adj越大,拟合效果越好[10],MSC最大原则较为常用[11]。

表3 释药数据的拟合方程Tab 3 Fitting equation of releasing curves
由表 3数据可知,藤甲酰苷缓释片的释药曲线较符合Higuchi方程,同时Ritger-Peppas方程[12]中,n为扩散指数,与药物释放机制有关。当 n≤0.43 时,药物释放机制为 Fickian 扩散;当0.43<n<0.85 时,药物释放机制为non-Fickian扩散(anomalous transport),即药物扩散和骨架溶蚀协同作用;当n≥0.85时,药物释放机制为骨架溶蚀。根据该模型拟合式求得0.43<n=0.548<0.85,可进一步说明该骨架型缓释片的释放为扩散和骨架溶蚀协同作用。
3 结论
本实验建立了藤甲酰苷缓释片的分析方法,采用HPLC对藤甲酰苷缓释片进行含量测定,采用一亲水性高分子材HPMC为主要缓释材料、EC为骨架材料、乳糖为致孔剂、微晶纤维素为添加剂,湿法制粒压片法制备藤甲酰苷亲水凝胶骨架型缓释片。通过正交设计试验筛选出最优处方。分别用零级释药方程、Higuchi方程、一级释药方程和Ritger-Peppas方程对最优处方的释放曲线进行拟合,DDsolver 软件计算结果得出,藤甲酰苷缓释片的释药曲线较符合Higuchi方程,Ritger-Peppas方程拟合式得出,n值为0.548可进一步说明该骨架型缓释片的释放为扩散和骨架溶蚀协同作用。
REFERENCES
[1] XU L F. Gambogic acid glucoside derivatives and analogues and their preparation method and USES: China, 101289482A [P]. 2008-10-22.
[2] Ch.P(2010)Vol Ⅱ(中国药典2010年版. 二部) [S]. 2010: Appendix 87.
[3] XIA J H, LIU C X. Statistical evaluation and analysis of the in vitro dissolution of solid pharmaceutical preparations [J]. Chin Pharm J(中国药学杂志), 2000, 35(2):130-131.
[4] DONG Z C. Hydroxypropyl methyl cellulose in gel skeleton application [J]. World Pharm(国外医药), 1993 ,14(1): 41-44.
[5] YAN Y D. The Design and Development of Controlled Release Formulations of Sustained-release(缓释控释制剂的设计与开发) [M]. Beijing: China Medical Science and Technology Press, 2006: 68-90.
[6] WANG X, ZHANG W G, LI X Q, et al. Preparation and in vitro dissolution behaviors of Yiganqing-HPMC K4M/PVP K30 matrix tablet [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2012, 29(1): 50-55.
[7] SHI L, QIAN J Q. Preparation and study on release rate in vitro for sustained-release tablets of simvastatin [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2011, 28(11): 1013-1017.
[8] HIGUCHI T. Mechanism of sustained-action medication. Theoretical analysis of rate of release of solid drugs dispersed in solid matrices [J]. J Pharm Sci, 1963, 52(12): 1145-1149.
[9] PEPPAS N. Analysis of Fickian and non-Fickian drugs drug release from polymers [J]. Pharm Acta Helv, 1985, 60(4): 110-111.
[10] ZHANG Y, HUO M, ZHOU J, et al. DDSolver: an add-in program for modeling and comparison of drug dissolution profiles [J]. AAPS J, 2010, 12(3): 263-271.
[11] YUKSEL N, KANIK A E, BAYKARA T. Comparison of in vitro dissolution profiles by ANOVA-based, model dependent and independent methods [J]. Int J Pharm, 2000, 209(1/2): 57-67.
[12] RITGER P L, PEPPAS N A. A simple equation for description of solute release. Ⅱ. Fickian and anomalous release from swellable device [J]. J Control Release, 1987, 5(1): 37-42.
Formulation Optimization and the Release Mechanism of Garcinia Glycosides Sustained-release Tablets
LI Wenjun, CHEN Ye, LI Tongmin, WANG Yang, LIU Zhongchen, DENG Jingjing
(School of Pharmacy, Liaoning University, Shenyang 110036, China)
OBJECTIVE To prepare the garcinia glycosides sustained-release tablets and study drug release mechanism in vitro. METHODS Garcinia glycosides sustained-release tablets were prepared using hydroxypropylmethyl cellulose(HPMC) as gel matrix material, ethyl cellulose (EC) as skeleton material, lactose as filler and so on. The formulation was optimized using orthogonal experimental design. DDslover software was used to fitting drug release curve. RESULTS Garcinia glycosides sustained-release tablets had good sustained-release profile. The release behavior of the tablets in vitro followed Higuchi equation. It was the synergies of diffusion and dissolution and the main mechanism of drug release was diffusion for fitting well with Higuchi equation, r=0.999 3(1-12 h). CONCLUSION The garcinia glycosides sustained-release tablets prepared meet the release requirement in vitro.
garcinia glycosides; HPMC; sustained-release tablets; release mechanism
R944. 4
B
1007-7693(2013)10-1081-05
2013-01-05
国家“十一五”规划“重大新药创制”重大科技专项资助项目(2009ZX09103-030);辽宁大学“211工程”三期建设重点资助项目
李文军,女,硕士生 Tel: (024)62202323 E-mail: wenjun_0224@126.com
