LEF1在脱甲基化药物DAC和紫杉醇联合治疗肾癌中的作用分析
2013-03-06孙式伟赵春利尚东浩
孙式伟,李 远,赵春利,尚东浩
(1.河北大学附属石油物探中心医院泌尿外科,河北徐水072555;2.河北省石家庄市第四医院内科,河北石家庄050011;3.河北大学附属医院泌尿外科,河北保定071000;4.北京友谊医院泌尿外科,北京100050)
LEF1在脱甲基化药物DAC和紫杉醇联合治疗肾癌中的作用分析
孙式伟1,李 远2*,赵春利3,尚东浩4
(1.河北大学附属石油物探中心医院泌尿外科,河北徐水072555;2.河北省石家庄市第四医院内科,河北石家庄050011;3.河北大学附属医院泌尿外科,河北保定071000;4.北京友谊医院泌尿外科,北京100050)
目的研究淋巴增强因子1(lymphoid enhancer-binding factor 1,LEF1)基因在脱甲基化药物5-氮-2-脱氧胞苷(5-aza-2′-deoxycytine,DAC)联合紫杉醇(paclitaxel,PTX)治疗(renal cell carcinoma,RCC)中发挥协同作用的机制。方法应用定量PCR测定二者联合应用时LEF1 mRNA表达量变化。2种肾癌细胞株ACHN、NC65分别用DAC:0.5、1、2、4、8μmol/L;PTX:1、2、4、8、16nmol/L;DAC(1、2μmol/L)+PTX(1、2、4、8、16nmol/L)处理3d。Rneasy mini kit(Qiagen)抽提tRNA,First strand cDNA synthesis kit(Amasham Pharmacia)逆转录合成cDNA第1条链,Realtime PCR采用SYBR®Green PCR Master Mix(Applied Biosystems)进行扩增,IQ5进行荧光定量分析。结果通过Real-time PCR测定出DAC与PTX 2种药物联合应用时LEF1下降,且显著低于PTX或DAC单剂作用效果。结论应用Real-time PCR进行了验证,LEF1是DAC和PTX治疗肾癌相乘作用中的重要靶基因。
肾肿瘤;脱氧胞苷;紫杉醇
肾癌又称肾细胞癌(renal cell carcinoma,RCC),约占肾脏肿瘤的85%,是泌尿系统中最常见的恶性肿瘤之一。许多研究表明RCC是最对药物抵抗(therapy-resisstant)的恶性肿瘤之一,其对化学治疗、激素治疗及放射治疗都反应较低或不反应。近年来研究[1]发现脱甲基化药物5-氮-2-脱氧胞苷(5-aza-2′-Deoxycytidine,DAC)与联合紫杉醇(paclitaxel,PTX)作用于肾癌细胞株时,对其生长具有抑制作用,且呈现剂量依赖性。而当DAC与PTX 2种药物联合应用时,生长抑制率显著高于PTX单剂作用效果,呈现相乘作用。我们在DAC联合PTX处理肾癌细胞株后的基因芯片实验中已经初步发现,淋巴增强因子1(lymphoid enhancer-binding factor 1,LEF1)基因表达发生了明显变化。本实验进一步以定量PCR方法确认DAC与PTX联合处理肾癌细胞株后LEF1表达水平的变化,验证基因芯片的结果,从而为DAC联合PTX的个性化治疗进行必要的探索。
1 材料与方法
1.1 药物及试剂:受试物,DAC和PTX 2种主要化疗药物均购自于Sigma,滤过灭菌。RPMI-1640培养基,美国GIBCO。四甲基偶氮唑盐(MTT),美国Sigma。二甲基亚砜DMSO,美国Keh。胎牛血清,美国GIBCO。胰蛋白酶,美国GIBCO。PBS,中国惠泽奥。细胞冻存液,中国惠泽奥。TRIzol,美国Invitrogen。LEF1及GAPDH引物,购置上海生工生物工程公司,LEF1(5′-3′)Fw,AAATAAAGTGCCCGTGGTGC;Rv,CATGCCTTGTTTGGAGTTGACA。GAPDH(5′-3′)Fw,ATCAAGAAGGTGGTGAAGCAGG;Rv,GTGGAGGAGTGGGTGTCGC。
1.2 试剂配制:①双抗储存液,80万U/瓶青霉素注射液用无菌生理盐水稀释成40mL,100万U/瓶链霉素注射液用无菌生理盐水稀释成50mL,再分别取40mL青霉素稀释液与40mL链霉素稀释液混合而成,冻存保藏。②胎牛血清,56℃水浴30 min灭活,混匀后分装,-20℃保存。③MTT液(5g/mL),取250 mg MTT,溶于50mL 0.01mol/L PBS(pH7.2)溶液中,用磁力搅拌器搅拌30min,0.22μm微孔滤膜过滤除菌,-20℃避光保存。④0.25%胰蛋白酶溶液,称取胰蛋白酶干粉0.5g,溶解于200mL PBS液中,完全溶解后,0.22μm微孔滤膜过滤除菌,4℃保存。⑤磷酸盐缓冲液,PBS粉溶解于800mL三蒸水中,磁力搅拌器上搅拌15min,待完全溶解后,定容到1000mL,高压蒸气灭菌,4℃保存。⑥RPMI-1640培养液,RPMI-1640干粉加800mL三蒸水搅拌、充分溶解后定容至1000mL,用0.22μm微孔滤膜过滤除菌,分装,4℃保存。
1.3 主要实验仪器:超净工作台,日本Isocide。CO2培养箱,美国Thermo Forma。生物光学显微镜,德国Olympus。自动平衡离心机,日本Kubota。550型酶标仪,美国Thermo Forma。-80℃超低温冰箱,美国Revco。Real-time PCR仪,美国Bio-Rad。高压蒸汽灭菌器,上海三申医疗器械有限公司。磁力加热搅拌器,金坛市杰瑞电器有限公司。台式低速离心机,上海医疗器械集团有限公司手术器械厂。液氮罐,美国Thermo。小型高速台式离心机,德国Sigma。紫外分光光度计,英国Picodrop。pH计,德国Sartorius。0.22μm微孔滤膜,Nippon Millipore Ltd。96孔细胞培养板,美国corning公司。Levo Plus大容量电动移液器,0.1~100mL,大龙医疗设备有限公司。单道数字可调移液器(Research)10~100μL。单道数字可调移液器(Research)20~200μL。单道数字可调移液器(Research)100~1000μL。德国艾本德股份公司(Eppendorf AG)。微量振荡器,上海创发仪器有限公司。手动连续移液器(连续加样器),德国BRAND。普通冰箱,海尔公司。垂直电泳槽,美国Bio-Rad(20)电子天平,梅特勒-托利多仪器(上海)有限公司。
1.4 细胞株:本研究中的2种肾癌细胞株ACHN、NC65,均为肾透明细胞癌,均由日本京都大学附属医院泌尿外科提供。
1.5 方法
1.5.1 样品的配制:将PTX溶于DMSO中,浓度为10g/L,再用无血清RPMI-1640将样品配制成1g/L的储备液,放至-80℃冰箱储藏待用。使用前用RPMI-1640完全培养液将其稀释成浓度分别为1000、100、10、1、0.1mg/L的样品液,混匀后备用;受试物配置:DAC,500μmol/L终浓度液体,PBS稀释,0.22μm滤膜过滤除菌,-80℃保存。PTX,500nmol/L终浓度液体,PBS稀释,0.22μm滤膜过滤除菌,-80℃保存。
1.5.2 细胞复苏,培养及药物处理:①细胞复苏,ACHN、NC65 2种肾透明细胞癌细胞株均保存于-80℃液氮中。复苏时迅速取出冻存管,置于37℃水箱中水浴,使其快速解冻。然后在超净台上小心打开冻存管,用吸管从管内吸出细胞悬液,注入含有RPMI-1640培养液的移液管中,1 500 r/min,离心5min,去掉上清后,加入Rpmi-1640培养基液,轻微混匀,移至直径10cm的培养皿中。置于5%CO2,37℃培养箱中培养,次日更换一次培养液,继续培养。②细胞培养:细胞培养基为完全培养基(含10%胎牛血清,RPMI-1640,100U/mL青霉素,100μg/mL链霉素),5%CO2的37℃培养箱中孵育,肾癌细胞株ACHN和NC65均为单层黏壁生长类型,融合度保持不超过80%。将细胞培养为浓度为1×107个/mL,光镜直接玻片法计数。③肾癌细胞株处理,2种肾癌细胞株ACHN、NC65分别用DAC:0.5、1、2、4、8μmol/L;PTX:1、2、4、8、16nmol/L;DAC(1、2μmol/L)+PTX(1、2、4、8、16nmol/L)处理3d。
1.5.3 定量PCR:①样品RNA抽提,分别对肾癌细胞株ACHN、NC65约取1×106~1×107细胞,加1mL RNA抽提试剂TRIzol(样品为贴壁细胞,每10cm2培养皿TRIzol使用量为1mL),摇匀,充分裂解后吸到经DEPC处理过的EP管中,经过氯仿的处理后12000 r/min,4℃,离心15min。然后取上清无色水相到EP管(DEPC处理过),加0.5mL新开的异丙醇,室温下静置10min后,12000 r/min,4℃,离心10min。观察总RNA在管底的白色沉淀,弃去上清,75%乙醇1.0mL洗涤(用DEPC水新配制)后,7 500r/min,4℃,离心5min。去上清,用小Tip吸干液体。气干沉淀5~10min,DEPC处理水20~30μL加入,用枪打匀,55~60℃水浴10min溶解总RNA,保存。②RNA质量检测,使用Nanodrop测定RNA在分光光度计260 nm、280 nm和230 nm的吸收值,以计算浓度并评估纯度。用于检测的RNA样品,必须是高质量的,完整的,没有RNase污染。用甲醛电泳试剂进行变性琼脂糖凝胶电泳,检测RNA纯度及完整性。提供RNA QC报告。③应用real-time PCR测定LEF1的表达水平,First strand cDNA synthesis kit(Amasham Pharmacia)逆转录合成cDNA第一条链,Real-time PCR采用SYBR®Green PCR Master Mix(Bio-Rad)进行扩增,IQ5进行荧光定量分析。实验用引物使用专门软件Permer Primier 5.0设计,遵循以下原则,引物与模板的序列紧密互补;物与引物之间避免稳定的二聚体或发夹结构形成;引物不在模板的非目的位点引发DNA聚合反应。LEF1(5′-3′)Fw,AAATAAAGTGCCCGTGGTGC;Rv,CATGCCTTGTTTGGAGTTGACA。对照组用GAPDH(5′-3′)Fw,ATCAAGAAGGTGGTGAAGCAGG;Rv,GTGGAGGAGTGGGTGTCGC。按照实验手册说明进行液体配置,反应条件设置为,95℃,2min,1循环;95℃,30s,60s,30s,72℃,1min,共40个循环;最后72℃,10min延伸。
1.6 统计学方法:应用SPSS16.0统计软件包进行数据分析,计量资料以±s表示,采用方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 RNA质量检测报告表及琼脂糖凝胶电泳图:见表1,图1。
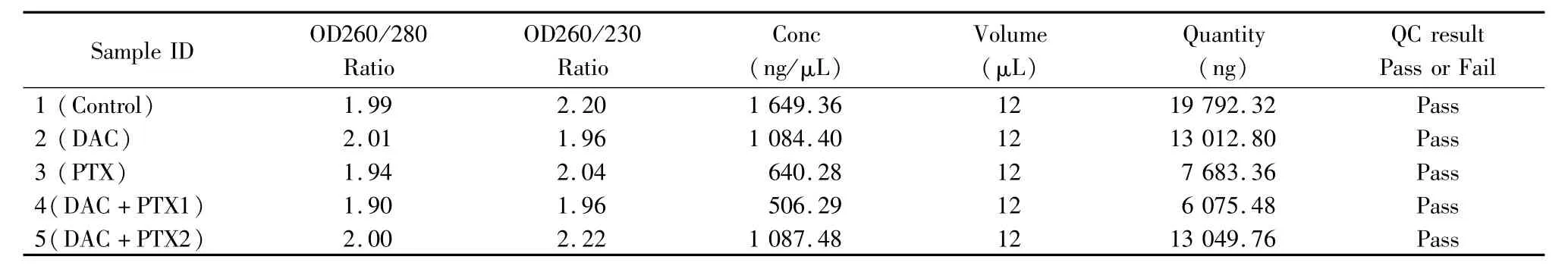
表1 RNA质量及品质的检测报告Table 1 RNA Quantification and Quality Assurance by NanoDrop ND-1000
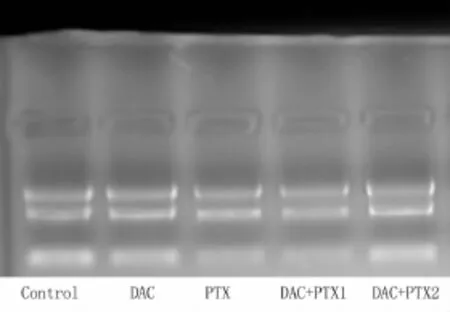
图1 RNA琼脂糖凝胶电泳图Figure 1 RNA Integrity and gDNA contamination Test by Denaturing Agarose Gel Electrophoresis
2.2 DAC与PTX单独作用于2种肾癌细胞株后LEF1表达水平的变化:脱甲基化药物DAC与PTX单独作用时,2种肾癌细胞株中LEF1的表达均降低,并且LEF1的表达水平随药物浓度的增加而下降,且呈现剂量依赖性。见图2~5。
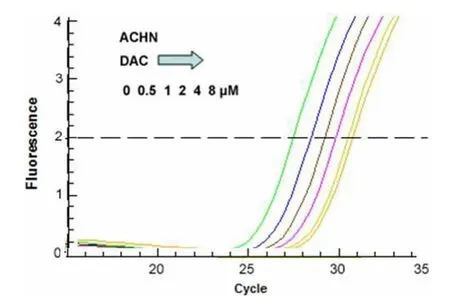
图2 不同剂量DAC对ACHN肾癌细胞株中LEF1 mRNA表达量的影响Figure 2 The role of DAC on LEF1 mRNA in ACHN RCC cell lines(Real-time PCR)

图3 不同剂量DAC对NC65肾癌细胞株中LEF1 mRNA表达量的影响Figure 3 The role of DAC on LEF1 mRNA in NC65 RCC cell lines(Real-time PCR)
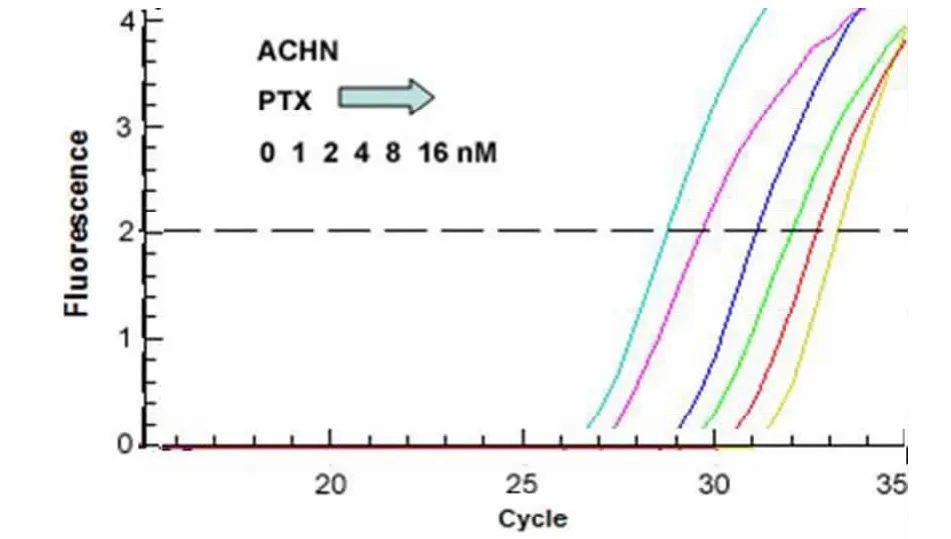
图4不同剂量PTX对ACHN肾癌细胞株中LEF1 mRNA表达量的影响Figure 4 The role of PTX on LEF1 mRNA in ACHN RCC cell lines(Real-time PCR)
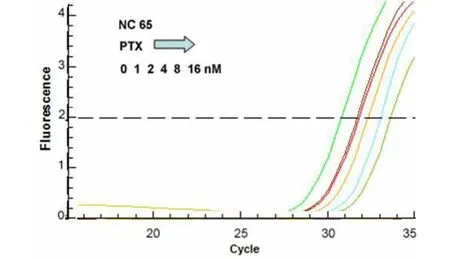
图5 不同剂量PTX对NC65肾癌细胞株中LEF1 mRNA表达量的影响Figure 5 The role of PTX on LEF1 mRNA in NC65 RCC cell lines(Real-time PCR)
2.3 DAC联合PTX处理肾癌细胞株后LEF1表达水平的变化:当DAC和PTX 2种药物联合应用于肾癌细胞株时,LEF1的表达水平显著低于DAC或PTX单剂作用效果(P<0.01)。见图6~10,表2~4。
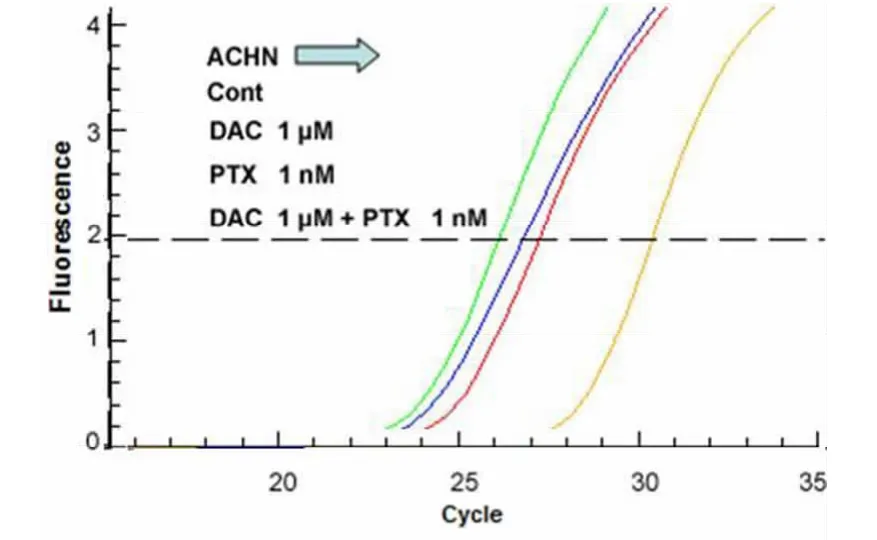
图6 DAC联合PTX作用于ACHN肾癌细胞株对LEF1 mRNA表达量的影响Figure6 The role of DAC and PTX on LEF1 mRNA in ACHN RCC cell lines
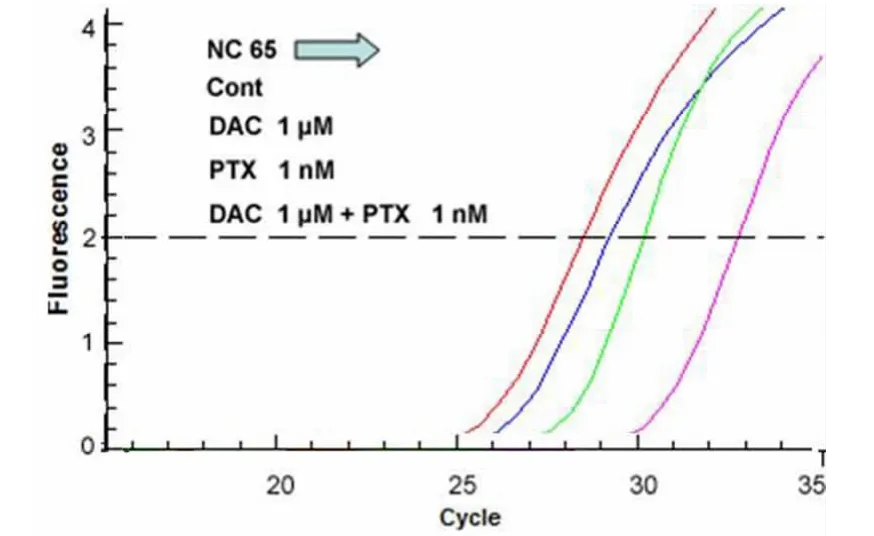
图7 DAC与PTX联合作用于NC65肾癌细胞株对LEF1 mRNA表达量的影响Figure 7 The role of DAC and PTX on LEF1 mRNA in NC65 RCC cell lines
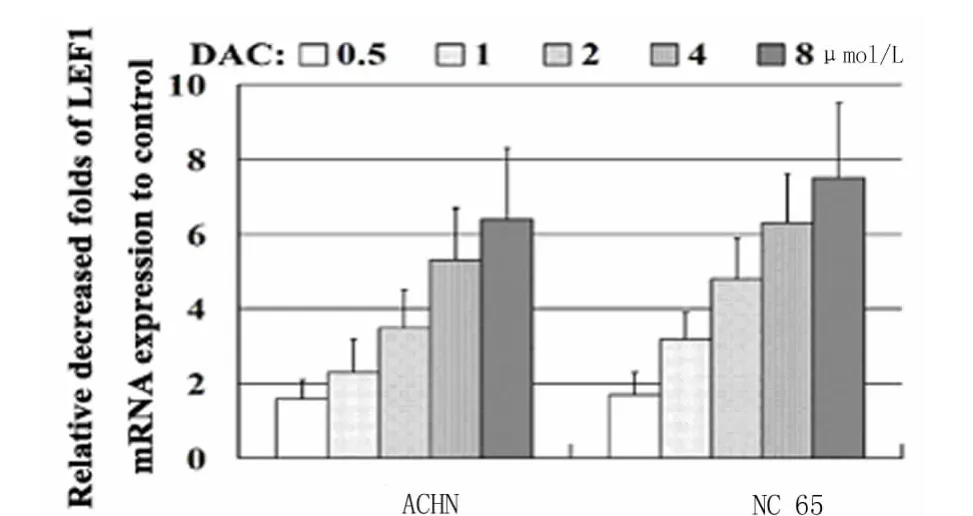
图8 DAC对ACHN、NC65 2种肾癌细胞株LEF1 mRNA表达量的分析Figure 8 Effect of DAC on LEF1 mRNA in two kinds of RCC cell lines
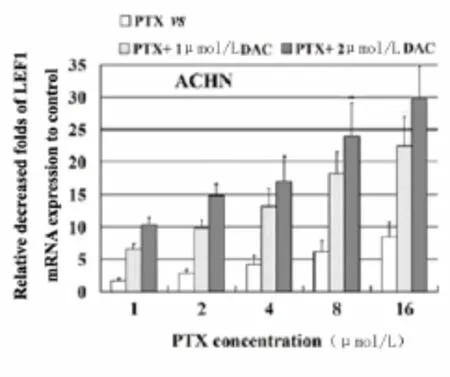
图9 PTX单独作用于ACHN肾癌细胞株与DAC联合PTX作用对LEF1 mRNA表达量的分析Figure 9 Effect of PTX alone or combined DAC and PTX on LEF1 mRNA in ACHN cell line
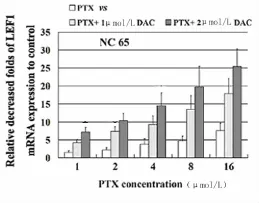
图10 PTX单独作用于NC65肾癌细胞株与DAC联合PTX作用对LEF1 mRNA表达量的分析Figure 10 Effect of PTX alone or combined DAC and PTX on LEF1 mRNA in NC65 cell line
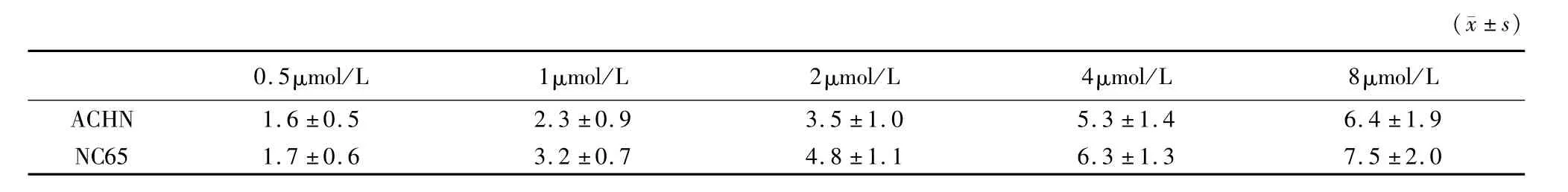
表2 DAC作用于ACHN与NC65 2种肾癌细胞株后LEF1 m RNA表达量比较Table 2 Effect of DAC on LEF1 m RNA in two kinds of RCC cell lines

表3 PTX单独作用于ACHN肾癌细胞株与DAC联合PTX作用后LEF1 m RNA表达量比较Table 3 Effect of PTX alone or combined DAC and PTX on LEF1 m RNA in ACHN cell line

表4 PTX单独作用于NC65肾癌细胞株与DAC联合PTX作用后LEF1 m RNA表达量比较Table 4 Effect of PTX alone or com bined DAC and PTX on LEF1 m RNA in NC65 cell line
3 讨 论
化疗药物单独治疗RCC的临床效果不佳,总缓解率只能达到5%左右,其原因可能与位于肾癌细胞膜上的P-糖蛋白和MRP蛋白等介导跨膜转运基因的表达增高和活性增强有关,导致毒性药物分子被加速排除到细胞外,细胞内药物蓄积浓度降低不能达到治疗浓度。
DAC与DNA结合,抑制DNMTS(DNA甲基化转移酶)活性,在细胞分裂时使甲基化的胞嘧啶转化为胞嘧啶,使新合成的DNA低甲基化,并且随着细胞分裂次数的增加,DNA甲基化程度逐渐减低,能够上调因高度甲基化而失活基因的表达[2]。已经有一些研究开始探讨体外实验中DAC与化学疗法在对抗实体瘤过程中的功效,结果显示DAC可以增加化疗药物的作用,同时增强肿瘤细胞对化疗的敏感性[3-4]。
PTX属于有丝分裂抑制剂,紫杉醇的抗癌机制主要是通过结合到微管蛋白上,促进微管蛋白的聚合,并阻滞其解聚成亚单位,从而冻结有丝分裂的纺锤体,使细胞停滞于G2/M期,诱导细胞凋亡[5]。另外,Merchan等[6]研究表明紫杉醇除了细胞毒作用外,有较强的抗血管生成作用。
有研究[1]发现DAC通过细胞周期捕获抑制肾癌细胞株生长,使肿瘤细胞阻滞于G2/M期。PTX通过细胞周期捕获和促进细胞凋亡两方面杀伤肾癌细胞株。当DAC与PTX同时作用于癌细胞株时,DAC明显增加了PTX杀伤肾癌细胞株的作用。
Wnt信号转导通路在生物发育、细胞转运、肿瘤形成及细胞凋亡等生命过程中发挥重要作用,其异常活化与肿瘤的发生发展关系密切。LEF1是Wnt信号通路中的关键因子,Roose等[7]研究发现剔除LEF1基因小鼠会发生胚胎性致死,因此,LEF1被认为在胚胎发育过程中发挥重要作用。目前的研究表明LEF1至少存在2种以上的亚型[8],在某些肿瘤和癌细胞株中检测到的LEF1全部是β-catenin依赖性LEF1亚型,即全长型LEF1[9]。它通过和β-catenin结合持续激活Wnt信号途径,继而激活一系列靶基因来影响细胞增殖和凋亡的调控,从而参与肿瘤的发生发展过程。最近几年Wnt信号传导通路与肾癌发生发展关系也逐渐得到关注。
本实验中我们通过定量PCR方法设定DAC和PTX在多个浓度梯度下进一步验证基因芯片数据,结果表明体外脱甲基化药物DAC或紫杉醇处理肾癌细胞后LEF1的表达降低,并且2种药物联合应用时LEF1表达水平显著低于任一药物单独作用。也就说明LEF1在DAC联合PTX应用抑制肾癌细胞生长的过程中,是一个重要的靶基因。
综上所述,LEF1作为一个关键基因参与了脱甲基化药物DAC与紫杉醇在抑制肾癌细胞生长的相乘作用,是否能说明LEF1是一个新的肾癌靶点,尚需进一步研究。
[1]SHANGD,ITON,KAMOTO T,etal.Demethylatingagent5-Aza-2-deoxycytidine enhances susceptibility of renal cell carcinoma to paclitaxel[J].Urology,2007,69(5):1007-1012.
[2]DASKALAKISM,NGUYEN TT,NGUYEN C,et al.Demethylation of a hypermethylated P 15IN K 4Bgene in patientswithmyelodysp lastic syndrome by 5-Aza-2′-deoxycytidine(decitabine)treatment[J].Blood,2002,100(8):2957-2964.
[3]GOMYO Y,SASAKI J,BRANCH C,et al.5-Aza-2′-deoxycytidine upregulates caspase-9 expression cooperating with p53-induced apoptosis in human lung cancer cells[J].Oncogene,2004,23(40):6779-6787.
[4]KAMINSKIR,KOZAR K,NIDERLA J,et al.Demethylating agent 5-aza-2′-deoxycytidine enhances expression of TNFRI and promotes TNF-mediated apoptosis in vitro and in vivo[J].Oncol Rep,2004,12(3):509-516.
[5]ELCMA L,JOENSU H,KULMALA J,et al.Squamous cell carcinoma is highly sensitive to taxel,a possible new radiation sensitizer J[J].Acta Oldaryngal(Stockh),1995,115(2):340-344.
[6]MERCHAN JR,JAYARAM DR,SUPKO JG,et al.Increased endothelial uptake of paclitaxel as a potential mechanism for its antiangiogenic effects:potentiation by Cox-2 inhibition[J].Int J Cancer,2005,113(3):490-498.
[7]ROOSE J,CLEVERS H.TCF transcription factors:molecula switches in carcinogenesis[J].Biochim Biophys Acta,1999,424(2/3):M23-37.
[8]JESSE S,KOENIG A,ELLENRIEDER V,et al.Lef-l isoforms regulate different target genes and reduce cellular adhesion[J].Int JCancer,2010,126(5):1109-1120.
[9]王淑红,南克俊,田涛,等.β-catenin依赖性LEF1亚型对宫颈癌HeLa细胞生物行为学的影响[J].西安交通大学学报:医学版,2010,31(3):313-317.
(本文编辑:赵丽洁)
EFFECTS ANALYSISOF LEF1 IN THE DEMETHYLATION DRUG DAC AND PACLITAXEL IN THE TREATM ENT OF RENAL CELL CARCINOMA
SUN Shiwei1,LIYuan2*,ZHAO Chunli3,SHANG Donghao4
(1.Department of Urology,Petroleum Geophysical Exploration Center Hospital of Hebei University,Hebei Province,Xushui072555,China;2.Department of Cardiology,the Fourth Hospital of Shijiazhuang City,Hebei Province,Shijiazhuang 050011,China;3.Department of Urology,the Affiliated Hospital of Hebei University,Hebei Province,Baoding 071000,China;4.Department of Urology,Beijing Friendship Hospital,Beijing 100050,China)
kidney neoplasms;deoxycytidine;paclitaxel
R737.11
A
1007-3205(2013)04-0391-06
2012-07-24;
2012-10-10
国家自然科学基金项目(30801139)
孙式伟(1975-),男,河北海兴人,河北大学附属石油物探中心医院主治医师,医学硕士,从事泌尿外科疾病诊治研究。
*通讯作者。E-mail:liyuandoctor9898@sina.com
10.3969/j.issn.1007-3205.2013.04.007
【关键词】ABSTRACT:ObjectiveTo investigate the synergistic mechanism of 5-Aza-2′-Deoxycytidine(DAC)and paclitaxel(PTX)on Renal cell carcinoma cell lines and to discuss the function of lymphoid enhancer-binding factor 1(LEF1)in this process.M ethodsThe mRNA expression of LEF1 was detected to discuss the function of LEF1 on the synergy effect of DAC and PTX by real time Polymerase Chain Reaction.ACHN and NC65 cell lineswere continuous treated for 72 hourswith DAC:0.5,1,2,4,8μmol/L;PTX:1,2,4,8,16nmol/L.Total RNA was isolated using Rneasy mini kit(Qiagen),the First strand cDNA synthesis kit(Amasham Pharmacia)was used for reverse transcription,quantitative realtime PCR was performed using SYBR®Green PCR Master Mix(Applied Biosystems)and fluorescence quantitative analysis by IQ5.ResultsThemRNA expression of LEF1 was decreased in the processing of combined use of DAC and PTX compared with DAC or PTX alone.Conclusion LEF1 will be animportant target gene in the synergy of DAC and PTX against RCC.
