嫩江下游春、秋两季浮游动物数量特征与群落结构分析1)
2013-03-05于洪贤马成学霍堂斌
张 昊 于洪贤 马成学 霍堂斌
(东北林业大学,哈尔滨,150040) (中国水产科学研究院黑龙江水产研究所)
嫩江是松花江干流的北源,发源于大兴安岭伊勒呼里山,在吉林松原市三岔河汇入松花江。嫩江流域是我国主要的商品粮生产基地之一,在东北地区国民经济中占有非常重要的地位。近年来,随着嫩江流域经济的快速发展和城市化进程的加快,以及嫩江干流的调水工程、尼尔基水库的修建、高强度的农业开发等人为因素极大地改变了嫩江径流特征和形成规律,水资源短缺、水质污染、水土流失等水环境问题日益突出[1]。有报道指出,“十五”期间嫩江干流高锰酸盐指数和氨氮在各年度均有超标样本,高锰酸盐指数超标率为18% ~45%,氨氮超标率在4% ~10%之间;溶解氧、五日生化需氧量和挥发酚在个别年度有超标样本,超标率多在10%以下。嫩江干流2001—2004年属Ⅲ类水体,2005年属Ⅳ类水体[2],有机污染较重。水质恶化和水量减少不仅造成水生态系统退化和生物多样性减少,而且降低了水体的环境容量,加大了水污染事故发生的可能性,致使嫩江水环境安全受到极大威胁,嫩江越来越引起世人的关注。2004年,姜淑坤等[3]研究发现,嫩江下游段水质总体上有好转趋势,但个别月份水质仍为Ⅳ类。
浮游动物种类组成与物种多样性的变化直接影响到水域生态系统的结构与功能,对维持整个水域生态系统的平衡有至关重要的作用。国内外学者对各种水体的浮游动物的种群特点、食性特点等方面展开了大量的研究,如郭沛涌等[4]、陈小庆[5]和李惠玉[6]分别对浮游动物的形态和数量以及分布特征进行了研究;吴利[7]、方良[8]和李强[9]研究了浮游动物群落结构特征及其物种多样性;徐晓群[10]研究了兴化湾浮游动物群落季节变化和水平分布特征;孙军[11]和Alejandro 等[12]研究了浮游动物对浮游植物的摄食关系。浮游动物也是水体中重要的生物群落,研究其生态及其与环境之间的关系,分析生物个体、种群或群落对水环境污染和生态破坏所产生的反应,对于监测水环境中污染物的种类及数量,进行生物治理等均有积极的指导意义。在我国东北地区近几年内仅有于洪贤[13]、韩蕾[14]和姜作发[15]等人对浮游动物进行了研究,但是对嫩江下游浮游动物多样性和群落结构研究较少。本文则是对嫩江下游春季、秋季浮游动物多样性及其群落结构进行研究,旨为嫩江下游水域生态系统及生态环境的监测、水资源的合理利用提供依据。
1 研究地区概况
嫩江全长1 370 km,流域面积28. 3 km ×104 km。依其地形、地貌和河谷特征,分为上游、中游、下游3 段。从尼尔基到三岔河口为下游段,江道长587 km。此江段进入广阔的松嫩平原地带,江道蜿蜒曲折,沙滩、沙洲、江汊多,江道多呈网状,两岸滩地延展很宽,最宽处可达10 km,最大水深7.4 m,滩地上广泛分布着泡沼、湿地和牛轭湖。
嫩江的年内和年际及地区上的降水变化差异较大,最大年降水量为937. 4 mm,最小年降水量为152.5 mm。年降水量主要集中在6—9月份,约占全年降水量的82%,其中7、8 两个月份所占比重最大。嫩江河口处多年平均径流量为225 亿m3。年内及年际的径流分配不均。6—9月份最大,但这几个月的最大与最小平均流量相差50 ~80 倍;年平均径流量最大与最小一般相差4 ~10 倍,大者相差30 ~60 倍。
2 研究方法
2.1 采样点设定
本研究在嫩江下游选取10 个采样点(表1),并根据各采样点水深的不同进行分层采样。同时,采样点用Garmin 公司生产的GPS12 型全球卫星定位系统定位。采样点具体位置见表1和图1。
2.2 采样时间
根据嫩江冬季漫长、寒冷干燥,夏季温和多雨、降水集中,春秋两季天气多变的特点,采样时间确定为春季(2011年5月)、秋季(2011年9月)。
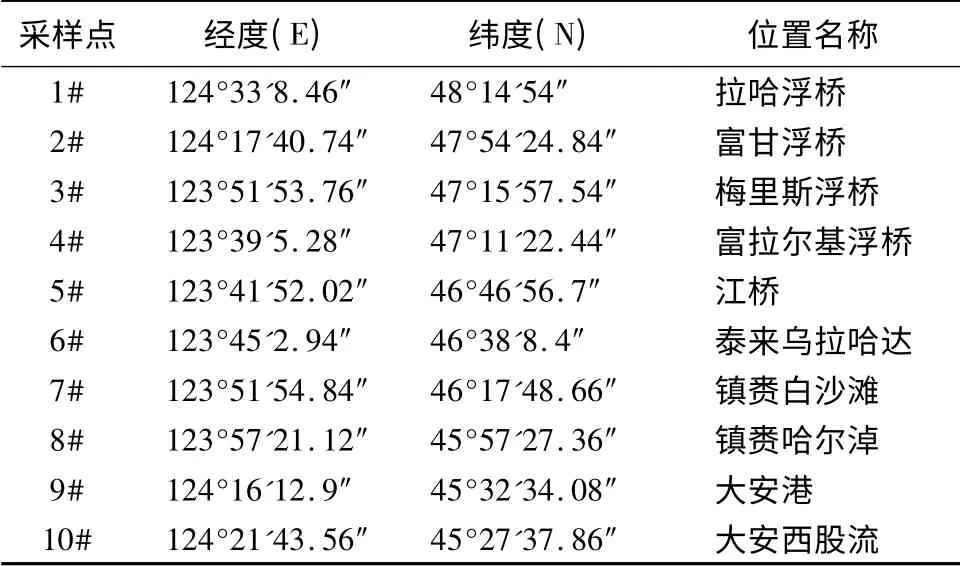
表1 嫩江下游采样点
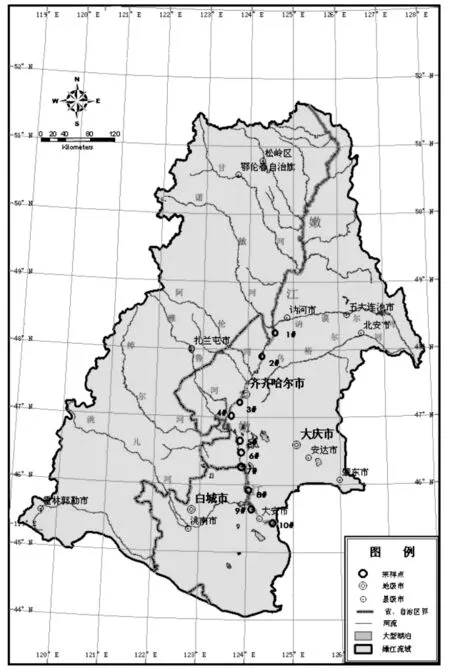
图1 嫩江下游浮游动物采样站点示意图
2.3 样品的采集及鉴定
采样工具主要是用25#浮游生物网和采水器(5 L)采集。
采样方法:用甲醛固定。每个采样点采1 个定性样品、1 个定量样品。浮游动物定性、定量根据《淡水浮游生物研究方法》[16]进行,浮游动物定性样品用25#浮游生物网在水面下0.5 m 处进行横“∞”字形捞取,用5%甲醛固定。定量样品采用5 L 采水器,共取20 L 水样,用25#浮游生物网过滤,用5%甲醛进行固定。
将样品带回实验室内,用Motic BA400 显微镜进行鉴定。原生动物根据《微型生物监测新技术》[17]鉴定;轮虫根据《中国淡水轮虫志》[18]鉴定;桡足类根据《中国动物志》(淡水桡足类)[19]鉴定。桡足类生物量按体长—体重回归方程式[20]计算。
2.4 试验数据处理
2.4.1 浮游动物生物量计算
枝角类、桡足类的定量:①将水样摇匀(30 mL浓缩水样);②用口较大的吸管取出1 mL 摇匀的水样置相应的计算框中;③全片计数;④计数后将各个种类的个数分别乘以系数K(K =3),所得数据是该种类的数量(ind. /L);⑤每瓶样品计数两张片,两张片误差应在15%以内。
原生动物、轮虫的定量:①将浮游动物定量水样摇匀;②用吸管取出0.1 mL 摇匀的水样置相应的计算框中;③全片计数;④计数后将各个种类的个数分别乘以系数K(K=300),所得数据是该种类的数量(ind. /L);⑤每瓶样品计数两张片,两张片误差应在15%以内。
生物量的定量:用浮游动物细胞的平均湿质量(细胞湿质量取值应取最小值)与该种浮游动物的数量进行计算,从而得出浮游动物生物量的数值。
2.4.2 优势度指数计算和多维尺度分析
1)浮游动物优势种是根据物种的出现频率及个体数量来确定,用优势度来表示[21]。
y=fi×Pi。
式中:y 为优势度;fi为第i 种的出现频率;Pi为第i种个体数量占总个体数量的比例。
当y≥0.02 时,定为优势种[22]。
2)由于物种—样本矩阵中的数据很多为0,不适宜采用以协方差矩阵为基础的主成分分析、对应分析等方法[23]。原理上,多维尺度分析比聚类分析法具有较为严格的数学基础,多维尺度分析每次只对样本或物种进行排序,不存在对物种分布的假设,同时适用于线性和高斯分布的数据系列,减轻了物种与环境之间的突变影响,可以适用不同的距离度量方法。在样本分类结果上,多维尺度分析图不仅像聚类分析树形图一样,使全部实体之间的划分关系得以反映,而且两两样本间的关系可以通过多维尺度分析排序图上彼此间的距离的比较而得以较好反映[24]。因此,应用多维尺度分析方法划分海浪河浮游动物群落。
多维尺度分析以Bray-Cartis 相似性系数SB为基础进行计算:

式中:xij是第i 物种在第j 样方的数量经变换后的数值;xik是第i 物种在第k 个样方中数量经变换后的数值。
多维尺度分析结果的检验采用胁强系数(St)来检验,通常认为St<0.2 时,可用多维尺度分析的二维散点图来表示,其图形有一定的意义;St<0.1 时,可以认为是一个好的排序;St<0.05,具有很好的代表性[25]。
2.4.3 数据处理与作图
试验数据使用Microsoft Office Excel 2010 进行基础计算、作图,多维尺度统计分析采用SPSS 18.0软件,采样点图等用Photoshop CS5 软件制作。
3 结果与分析
3.1 浮游动物的种类组成和季节更替
经过对嫩江下游春、秋两个季节10 个采样点的定性样品的镜检,共鉴定出浮游动物3 门21 属36种。其中:轮虫种类最多,11 属21 种,占61.8%;原生动物7 属9 种,占26.5%;桡足类2 属4 种,占11.7%;未发现枝角类。
浮游动物种类在春、秋有一定变化,其季节内各月种数依次为23 种和34 种,分别占总数的63.9%和94. 4%。在这两个季节中,均以轮虫种类数最多,春、秋两季分别为14 种和20 种,占各自季节总种数的60.9%和58.9%;种类数居第二的是原生动物,分别是春季2 种、秋季9 种,占各自该季节总数的比例分别是8.7%和26.5%。
3.2 嫩江下游浮游动物丰度、生物量组成及分布
嫩江下游浮游动物的丰度和生物量在各采样点存在一定的差异。由表2可以看出,10 个样点浮游动物的丰度波动于900 ~3 900 ind. /L 之间,6#采样点最高,为3 900 ind. /L,次高为8#采样点,为3 600 ind. /L,最低为2#和7#采样点,均为900 ind. /L;两季浮游动物的生物量在0.09 ~4.67 mg/L 之间,以6#点最高,为4.67 mg/L,其次是3#点,为2.45 mg/L,最低为1#点,为0.09 mg/L。
嫩江下游浮游动物的丰度和生物量在两个季节存在一定的差异。由表2可以看出,春季,浮游动物的丰度以10#采样点最高,为2 400 ind. /L;2#和7#最低,均为900 ind. /L。浮游动物的生物量以10#采样点最高,为1. 55 mg/L;5#采样点最低,为0. 67 mg/L。秋季,浮游动物的丰度最高为6#采样点(3 900 ind. /L),最低为3#采样点(为1 500 ind. /L);浮游动物的生物量在6#点最高,为4.67 mg/L;最低1#点,为0.09 mg/L。
由表3可见,嫩江浮游动物各门在春、秋两个季节的平均丰度为1 050 ~14 000 ind. /L。其中:轮虫的平均丰度最大,为14 000 ind. /L,占总平均丰度的75.1%。秋季的轮虫丰度达到最高,为19 500 ind. /L,而春季只有8 500 ind. /L;总体的平均丰度由大到小排序为:轮虫>原生动物>桡足类。
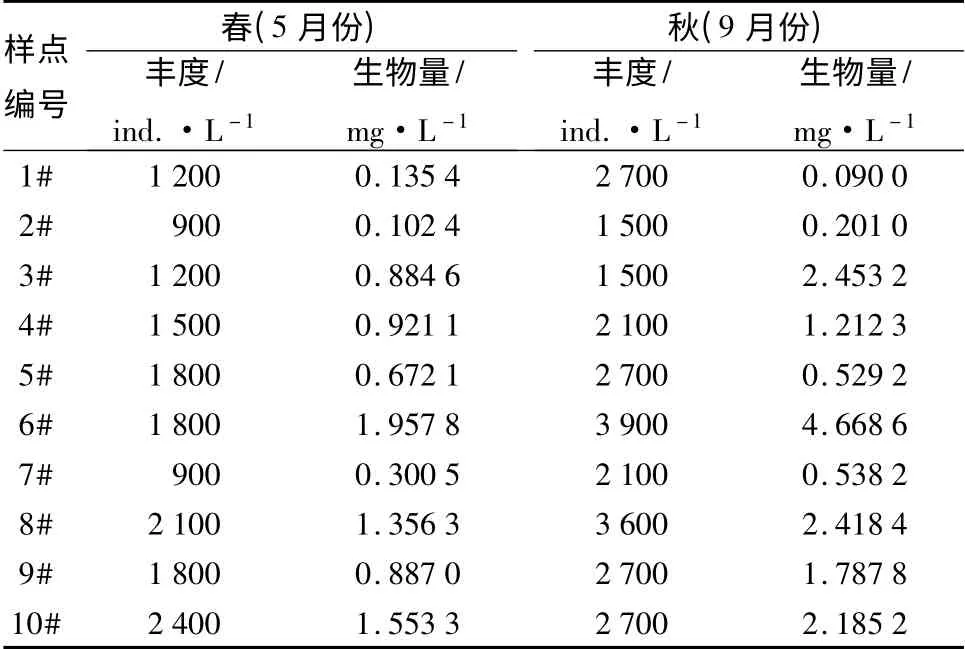
表2 嫩江下游浮游动物丰度和生物量水平分布
浮游动物各门的平均生物量在0.09 ~8.01 mg/L 之间。其中:轮虫在两个季节的平均生物量最高,为8.01 mg/L,占总平均生物量的67%。轮虫在秋季的生物量高于春季。总体的平均生物量由大到小排序为:轮虫>桡足类>原生动物。

表3 嫩江下游浮游动物丰度和生物量的季节变化
3.3 嫩江下游浮游动物优势种组成及季节差异
在优势种种类组成上,原生动物有2 种:小口钟虫(Vorticella microstoma)、绿急游虫(Strombidium viride);轮虫有5 种:浦达臂尾轮虫(Brachionus budapestiensis)、萼花臂尾轮虫(Brachionus quadridentatus)、螺形龟甲轮虫(Keratella cochlearis)、长刺盖氏轮虫(Kellicottica longispina)、长三肢轮虫(Filinia longiseta);桡足类有一种,为无节幼体。根据两个季节浮游动物出现的频率和丰度,以优势度y >0.02为界来确定优势种。由表4可见,两季共发现优势种8 种,优势种的种类受一定季节变化的影响。秋季(9月)共8 种,多于春季(5月)的4 种。两季优势种均以轮虫为主,在春、秋两季都形成以轮虫为优势的浮游动物群落。
两个季节,优势种在整个流域各个采样点的平均丰度也有差异。春季(5月),嫩江下游优势种的平均丰度为1 575 ind. /L,秋季(9月)为2 212 ind. /L;轮虫的长三肢轮虫在所有优势种中数量最高,其平均丰度为2 250 ind. /L。从优势度来看,两个季节介于0.02 ~0.09 之间,也以长三肢轮虫优势度最高,最大值出现在秋季,为0.09;春季优势度较低,为0.03。
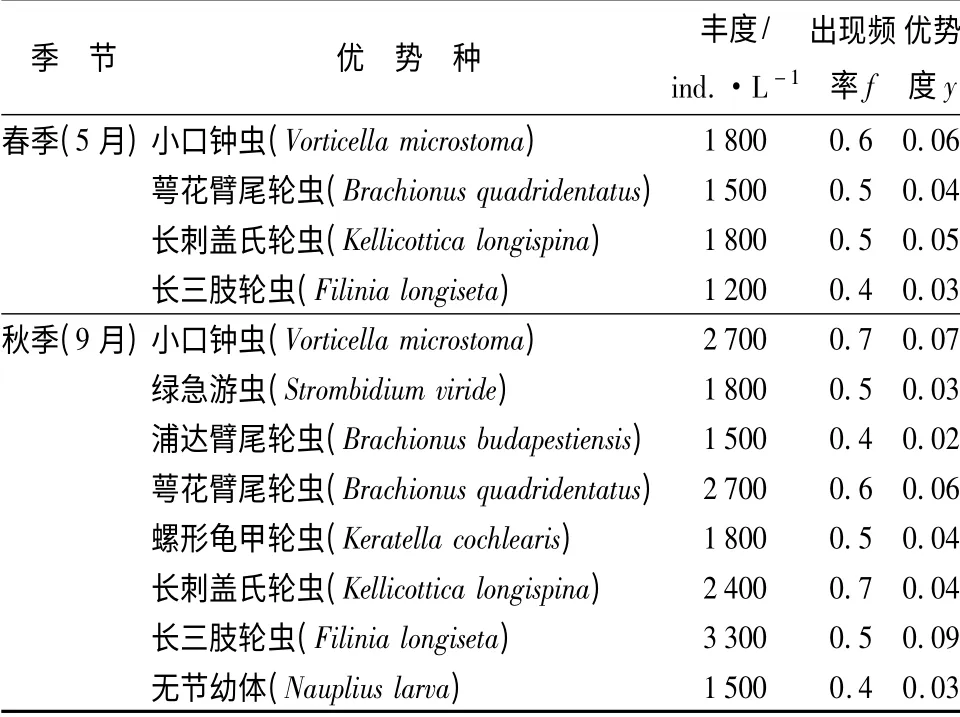
表4 嫩江下游浮游动物优势种及其丰度
3.4 浮游动物群落结构多维尺度模型
以Bray-Curtis 相似性矩阵计算为基础,对嫩江浮游动物群落结构变化进行多维尺度分析,得到两个季节的二维尺度分析图(图2、图3),其协强系数St值分别为0.033 47、0.031 36,小于0.05,说明得到的多维尺度分析图是一个好的排序,可以正确解释各采样点间的相似关系。

图2 春季10 个采样点浮游动物群落的多维尺度

图3 秋季10 个采样点浮游动物群落的多维尺度
在春季(5月),嫩江下游10 个采样点协强系数St为0.033 47,用多维尺度分析表达结果为好,可以分为4 个不同的群落:1#、2#和3#为一组,4#点为一组,5#、8#和10#为一组,6#、7#和9#为一组。
在秋季(9月),嫩江下游10 个采样点协强系数St为0.031 36,用多维尺度分析表达结果为好,可以分为3 个不同的群落:4#点为一组,1#、3#、5#、7#、8#、9#和10#为一组,2#和6#7#为一组。
综合以上分析,可见多维尺度图可以清楚地显示各采样点之间浮游动物群落的距离(即相似性),同时也表明各站位浮游动物群落的组成存在明显的差异。
4 结论
经过对嫩江下游春、秋两个季节10 个采样点浮游动物的定性定量分析,共鉴定出浮游动物3门21 属36 种。其中:轮虫种类最多,11 属21 种,占61.8%;原生动物7 属9 种,占26.5%;桡足类2属4 种,占11.7%;未发现枝角类。
嫩江下游浮游动物的丰度和生物量在各采样点和两个季节存在一定的差异。两季浮游动物的丰度波动于900 ~3 900 ind. /L 之间,6#采样点最高,为3 900 ind. /L,次高是8#采样点,为3 600 ind. /L,2#和7#采样点最低,均为900 ind. /L;两季浮游动物的生物量在0.09 ~4.67 mg/L 之间,以6#点最高,为4.67 mg/L,其次是3#点,为2.45 mg/L,1#点最低,为0.09 mg/L。春季浮游动物的丰度以10#采样点最高,为2 400 ind. /L,2#和7#最低,均为900 ind. /L;浮游动物的生物量以10#采样点最高,为1.55 mg/L,5#采样点最低,为0.67 mg/L。秋季浮游动物的丰度6#采样点最高,为3 900 ind. /L,3#采样点最低,为1 500 ind. /L;浮游动物的生物量在6#点最高,为4.67 mg/L,1#点最低,为0.09 mg/L。
在优势种种类组成上,原生动物有两种:小口钟虫(Vorticella microstoma)、绿急游虫(Strombidium viride);轮虫有5 种:浦达臂尾轮虫(Brachionus budapestiensis)、萼花臂尾轮虫(Brachionus quadridentatus)、螺形龟甲轮虫(Keratella cochlearis)、长刺盖氏轮虫(Kellicottica longispina)、长三肢轮虫(Filinia longiseta);桡足类有一种,为无节幼体(Nauplius larva)。
根据各季节浮游动物群落的相似性,结合多维尺度分析图中各样点之间的相似距离可以看出,在春季(5月),嫩江下游10 个采样点协强系数St为0.031 36,用多维尺度分析表达结果为好,可以分为4 个不同的群落:1#、2#和3#为一组,4#点为一组,5#、8#和10#为一组,6#、7#和9#为一组。在秋季(9月),嫩江下游10 个采样点协强系数St为0.033 47,用多维尺度分析表达结果为好,可以分为3 个不同的群落:4#点为一组,1#、3#、5#、7#、8#、9#和10#为一组,2#和6#7#为一组。可见多维尺度图可以清楚地显示各采样点之间浮游动物群落的距离(即相似性),同时也表明各站位浮游动物群落的组成存在明显的差异。
[1] 吴东芳,嫩江干流点污染源入河排污口现状分布研究[D].长春:吉林大学,2010.
[2] 卢映东,刘哲人,郑凤,等.嫩江齐齐哈尔江段污染现状分析及管理对策[J].黑龙江环境通报,2007,37(2):52 -58.
[3] 姜淑坤,刘宏.嫩江下游段水质现状及变化趋势分析[J].吉林水利,2004(9):1 -2.
[4] 郭沛涌,沈焕庭,刘阿成,等.长江河口中小型浮游动物数量分布、变动及主要影响因素[J].生态学报,2008,28(8):3517 -3526.
[5] 陈小庆,俞存根,胡颢琰,等.舟山渔场及邻近海域浮游动物数量分布特征[J].生态学报,2010,30(7):1834 -1844.
[6] 李惠玉,李建生,丁峰元,等.东海区沙海蜇和浮游动物的分布特征[J].生态学杂志,2007,26(12):1974 -1980.
[7] 吴利,冯伟松,陈小娟,等.新疆伊犁地区夏季浮游动物群落结构特征[J].应用生态学报,2008,19(1):163 -172.
[8] 方良,李纯厚,杜飞雁,等.大亚湾海域浮游动物生态特征[J].生态学报,2010,30(11):2981 -2991.
[9] 李强,安传光,马强,等.崇明东滩潮间带潮沟浮游动物的种类组成及多样性[J].生物多样性,2010,18(1):67 -75.
[10] 徐晓群,曾江宁,寿鹿,等. 兴化湾浮游动物群落季节变化和水平分布[J].生态学报,2010,30(3):734 -744.
[11] 孙军,宋书群.东海春季水华期浮游植物生长与微型浮游动物摄食[J].生态学报,2009,29(12):6429 -6438.
[12] Alva-Martínez A F,Sarma S S S,Nandini S. Comparative population dynamics of three species of cladocera in relation to different levels of Chlorella vulgaris and Microcystis aeruginosa[J].Crustaceana,2001,74(8):749 -764.
[13] 于洪贤,王杨,马成学,等. 镜泊湖浮游甲壳动物的群落结构[J].东北林业大学学报,2008,36(1):66 -68.
[14] 韩蕾,施心路,刘桂杰,等. 哈尔滨太阳岛水域原生动物群落变化的初步研究[J].水生生物学报,2007,31(2):272 -277.
[15] 姜作发,唐富江,董崇智,等. 黑龙江水系主要江河浮游动物种群结构特征[J].东北林业大学学报,2006,34(4):64 -66.
[16] 章宗涉,黄祥飞.淡水浮游生物研究方法[M]. 北京:科学出版社,1991.
[17] 沈韫芬,章宗涉,龚循矩,等. 微型生物监测新技术[M]. 北京:中国建筑工业出版社,1990.
[18] 王家辑.中国淡水轮虫志[M].北京:科学出版社,1961.
[19] 中国科学院动物研究所甲壳动物研究组. 中国动物志:淡水挠足类[M].北京:科学出版社,1979.
[20] 黄祥飞,胡春英. 淡水常见枝角类体长—体重回归方程式[G]//甲壳动物学论文集编辑委员会. 甲壳动物学论文集.北京:科学出版社,1986.
[21] Shannon C E. A mathematical theory of communication[J]. The Bell System Technical Journal,1948,27:379 -423,623 -656.
[22] Asknes D L,Wassmann P. Modeling the significance of zooplankton grazing for export production[J]. Limnology and Oceanography,1993,38(5):978 -985.
[23] Lampitt R S,Wishner K F,Turley C M,etal. Marine snow studies in the Northeast Atlantic Ocean:distribution,composition and roles as a food source for migrating plankton[J]. Marine Biology,1993,116(4):680 -702.
[24] Su Hueimeei,Lin Hsingjuh,Hung Jiajang. Effects of tidal flushing on phytoplankton in a eutrophic tropical lagoon in Taiwan[J]. Estuarine,Coastal and Shelf Science,2004,61(4):739-50.
[25] Bray J R,Curtis J T. An ordination of the upland forest communities of southern Wisconsin[J]. Ecological Monographs,1957,27(4):25 -49.
