乳头状汗腺瘤临床病理分析
2013-03-04许丽娟郑玲玲史雪鸿马小兵
许丽娟,郑玲玲,刘 彤,史雪鸿,马小兵
(1.首都医科大学潞河教学医院皮肤科,北京101100;2.首都医科大学潞河教学医院病理科,北京101100;3.北京市通州区妇幼保健院病理科,北京101100;4.河北省唐山市人民医院病理科,河北唐山063001)
·论 著·
乳头状汗腺瘤临床病理分析
许丽娟1,郑玲玲1,刘 彤2*,史雪鸿3,马小兵4
(1.首都医科大学潞河教学医院皮肤科,北京101100;2.首都医科大学潞河教学医院病理科,北京101100;3.北京市通州区妇幼保健院病理科,北京101100;4.河北省唐山市人民医院病理科,河北唐山063001)
目的 分析乳头状汗腺瘤的临床病理特征,探讨发病机制。方法对乳头状汗腺瘤的临床及病理资料进行分析,进行免疫组织化学检测并随访。结果乳头状汗腺瘤20例,男性1例,女性19例。免疫组织化学方法检测男性患者囊泡病液体蛋白15(gross cystic disease fluid protein-15,GCDFP-15)阳性,雌激素受体(estrogen receptor,ER)和孕激素受体(progesterone receptor,PR)阴性;女性患者GCDFP-15阳性率10%,ER阳性率70%,PR阳性率80%,PR表达强于ER。另外p63蛋白(protein 63,p63)、角蛋白5/6(keratin 5/6,CK5/6)、角蛋白19(keratin 19,CK19)、肌动蛋白(smooth muscle actin,SMA)、S-100蛋白(protein S-100,S-100)在肿瘤中亦阳性表达,CD10和角蛋白(keratin 10/13,CK10/13)阴性。结论乳头状汗腺瘤女性好发,发病部位主要为外阴和肛周部位,男性患者肛周发病罕见。外阴肛周之外的乳头状汗腺瘤可能来源于大汗腺或异位乳腺。“乳腺样腺体”可能是女性外阴肛周病例发病的来源。
乳头状瘤;汗腺肿瘤;病理学
1 资料与方法
1.1 一般资料:回顾性分析1990—2011年确诊的乳头状汗腺瘤患者20例。其中首都医科大学潞河医院13例,河北省唐山市人民医院3例,北京市通州区妇幼保健院4例;男性1例,女性19例,年龄26~72岁,平均49岁,病程1~4年。皮损部位为外阴部15例,肛周4例,耳后1例。肿瘤表现为单发结节19例,双侧外阴结节1例;多数肿物直径0.5~1.5cm大小,肤色、棕红色或紫红色结节,偶有糜烂、出血。
1.2 方法:所有标本经4%甲醛溶液固定,常规脱水、石蜡包埋、连续切片、常规HE染色并光镜观察。其中11例获得保存蜡块,利用免疫组织化学方法检测了雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、囊泡病液体蛋白15(gross cystic disease fluid protein-15,GCDFP-15)、p63蛋白(protein 63,p63)、角蛋白5/6(keratin 5/6,CK5/6)、角蛋白19(keratin 19,CK19)、肌动蛋白(smooth muscle actin,SMA)、S-100蛋白(protein S-100,S-100)、CD10、角蛋白(keratin 10/13,CK10/
13)的表达情况,试剂均购自北京中杉抗体公司,免疫组织化学采用三步法。结果判断,免疫标记物表达的判断应遵循细胞定位原则,以细胞相应部位出现黄棕色反应为阳性,根据显色强度及阳性细胞数指标来判断阳性等级。着色强度从无到有、由浅(黄色)至深(黄棕色)分为4个等级,即-、+、++、+++;阳性细胞数由无到有,由少至多亦分为4个等级,即0、<10%、10%~75%、>75%;综合2个指标将结果分为阴性、阳性、强阳性。GCDFP-15以阳性细胞需数大于50%判断为阳性。显色强度判断同上。
1.3 随访:对所有患者进行随访,随访时间0.5~5年。
2 结 果
2.1 临床特征:本组肿瘤发病部位绝大多数在女性外阴和肛周(18/19,94.74%),外阴和肛周之外的病例少见(1/20),男性肛周发病罕见(1/20)。发病平均年龄49岁。肿物绝大多数单发(18/19),偶可双侧外阴对称发病(1/20),表现为肤色、棕红色、紫红色结节,可以出现糜烂、出血,容易误诊。本组的临床诊断为肿物待查18例,血管瘤1例,鳞癌待排1例。术前均未明确诊断。
2.2 病理结果:均诊断为乳头状汗腺瘤。有完整包膜,肿瘤细胞形成管腔或囊腔样结构,形成乳头或呈绒毛样,突入腔内并交织在一起,形成腺瘤结构。由2种细胞构成,内层为单层或复层柱状细胞,可见顶浆分泌现象。外层为肌上皮细胞或扁平上皮。
2.3 免疫组织化学检查:乳头状汗腺瘤男性患者ER、PR均为阴性,GCDFP-15阳性。女性患者绝大多数ER、PR阳性,较少比例GCDFP-15阳性;ER表达率为70%,PR阳性表达率为80%,GCDFP-15阳性表达率为10%;PR强阳性表达比例高于ER强阳性表达。见表1。此外,该肿瘤还具有如下特点,即p63(+)、CK5/6(+)、CK19(+)、SMA(+)、S-100(++)、CD10(-)、CK10/13(-)。
2.4 随访情况:对患者进行0.5~5年随访,患者均健在,术后均未复发。
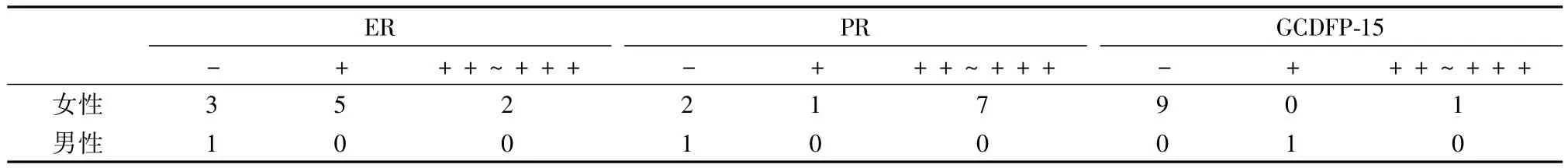
表1 11例乳头状汗腺瘤ER、PR、GCDFP-15免疫组织化学的表达情况 (例数)
3 讨 论
3.1 临床特征:乳头状汗腺瘤绝大多数发生于中年女性外阴和肛周,本组94.74%女性患者符合这一特点。肿瘤绝大多数单发,偶可双侧外阴对称发病,表现为肤色、棕红色、紫红色结节,可以出现糜烂、出血,容易误诊。发生在男性肛周部位病例罕见,国内外文献仅检索到2例[1-3]。本文男性患者肿瘤位于肛周,肿块较大(直径约6cm),病程较长,临床误认为鳞状细胞癌。通常将发生在外阴肛周部之外部位的乳头状汗腺瘤称之为异位乳头状汗腺瘤,亦少见。文献[4]报道肿瘤可发生于腋下、眼睑、胸部、鼻部皮肤、大腿、上臂等部位,且60%位于头面部。本组1例女性患者发生于耳后。肿瘤一般单发,偶可多发。国内见一篇发生在左上肢多发的异位乳头状汗腺瘤[5]。本文的随访结果,该肿瘤为良性,单纯切除一般无复发。但有文献报道,少数病例可出现异型增生甚至形成原位癌[1],也有恶变为浸润性癌报道[6]。
3.2 病理特征与鉴别诊断:肿瘤位于皮下,边界清晰,像一个大囊,外层为纤维囊壁,内衬柱状或立方上皮,腔内充填由2种上皮(柱状上皮和肌上皮)和少量间质构成的复杂迂回曲折的乳头结构,可见顶浆分泌现象,间质有少量浆细胞浸润。病理上可与乳头状汗管囊腺瘤鉴别,后者与表皮相连,乳头粗大,有大量淋巴细胞及浆细胞浸润。此外,尚需与乳头状小汗腺瘤鉴别,后者表现为管状结构,部分区域有乳头状突入管腔,腔内有无定形嗜酸性物质。导管偶尔扩张成囊腔[7]。
3.3 免疫组织化学特征:本组肿瘤的肌上皮p63、SMA均阳性表达,CD10阴性;腺上皮CK5/6、CK19和S-100阳性表达,CK10/13阴性。结果显示p63和SMA为较理想的肌上皮标记物,不与腺上皮出现混合性表达。S-100也是肌上皮标记物,在大汗腺和乳腺可以很好表达于肌上皮,腺上皮不表达。但本组S-100清晰表达于柱状腺上皮,与Nishie等[8]报道一致,这一点不同于乳腺和大汗腺的特点,其意义如何尚待研究。CK19在甲状腺乳头状癌可以特异性表达,我们发现CK19在本组肿瘤腺上皮细胞阳性表达很好,其意义何在,尚需研究。
ER和PR在男性患者的瘤组织不表达,而女性患者腺上皮有较好的阳性表达,阳性率分别为70%
和80%。令人感兴趣的是PR表达强于ER的概率约为70%。这可能是乳头状汗腺瘤的一个特点,有待于大样本的分析。乳腺部位的增生病变或乳腺癌往往ER与PR表达强度或一致或ER表达强于PR。在这一点可能提示乳头状汗腺瘤来源腺体与乳腺不同。GCDFP存在于大汗腺细胞、乳腺内化生的大汗腺上皮细胞,偶可表达于正常乳腺小导管和小叶的极少数单个细胞及非大汗腺腺体的某些浆液性细胞,目前作为大汗腺相对特异性标记物。因此,有学者[9]将GCDFP-15阳性细胞数大于50%为大汗腺标记。我们认为较为合理,故也采用这一标准。本组结果显示10%女性患者GCDFP-15阳性,男性1例亦呈阳性表达,与刘宇飞等的阴性结果不同[10]。说明有少数病例可以明确表达大汗腺标记物GCDFP-15,但表达率较低。值得一提的是,本组约60%病例可见灶性表达GCDFP-15,但阳性细胞数仅为5%~10%,而周围的大汗腺腺体阳性细胞数超过50%,这或许提示该肿瘤本质与大汗腺不完全相同。综合分析S-100、ER、PR、和GCDFP-15的免疫组织化学结果,我们发现女性外阴肛周的乳头状汗腺瘤兼有乳腺和大汗腺的特点,不能仅用其中一种腺体来解释其来源。
3.4 发病机制:乳头状汗腺瘤来源于“乳腺样腺体”。该腺体既非乳腺又非大汗腺,为一种特殊的分枝,即螺旋管状腺伴小叶形成趋势并能表达雌、孕激素受体,开口于外阴和肛周皮肤黏膜交界处。对于女性肛周和外阴部位的乳头状汗腺瘤,本组免疫组织化学结果支持这一观点。但本组发生于女性耳后的病例ER、PR、GCDFP-15均阴性表达,男性肛周的病例ER、PR阴性,GCDFP-15阳性表达。这是否提示这些部位的病例与“乳腺样腺体”无关呢?检索文献发现男性肛周乳头状汗腺瘤和异位乳头状汗腺瘤均少见,难以总结其免疫组织化学特征。Lee等[11]报道男性鼻部的乳头状汗腺瘤免疫组织化学GCDPF-15阳性表达,未做ER、PR检测。有报道女性乳房皮肤的乳头状汗腺瘤ER、PR均为阳性,但未检测GCDFP-15[12]。虽然如此,有一点是明确的,即异位的乳头状汗腺瘤男女比例无明显差别,而外阴肛周部位乳头状汗腺瘤男性罕见,男女发病率悬殊。根据我们的结果,推测男性肛周部位和异位的乳头状汗腺瘤不具有典型“乳腺样腺体”的特点,应与女性外阴肛周部位的乳头状瘤汗腺瘤区别对待。造成这一差别的原因可能与ER、PR有关。我们知道,大汗腺可以受到性激素的影响,青春期分泌增多,女性受到月经和妊娠影响更明显,推测正常情况下应该有性激素受体,只是量较少而已。笔者推测,由于女性外阴肛周部位特殊,大汗腺随着性腺发育出现超常量的雌孕激素受体而出现“乳腺样腺体”,局部肿瘤的发生可能与激素调节有关。男性肛周部位的乳头状汗腺瘤和异位的乳头状汗腺瘤可能与大汗腺以及少见的异位乳腺关系更密切。上述有趣的问题尚需进一步深入研究。
[1] SHAH SS,ADELSON M,MAZUR MT.Adenocarcinoma in situ arising in vulvar papillary hidradenoma:report of2 cases[J].Int JGynecol Pathol,2008,27(3)453-456.
[2] LOANE J,KEALY WF,MULCAHY G.Perianal hidradenoma papilliferum occurring in amale:a case report[J].Ir JMed Sci,1998,167(1):26-27.
[3] WEIGAND DA,BURGDORF WH.Perianal apocrine gland adenoma[J].Arch Dermatol,1980,116(9):1051-1053.
[4] MORIUMRA S,KADONO T,SUGAYA M,et al.Ectopic hidradenoma papilliferum on the abdomen[J].Eur JDermatol,2011,21(2):278-279.
[5] 姚明,华夏,张谊芝.多发性乳头状汗腺瘤[J].临床皮肤科杂志,2012,41(2):99-100.
[6] PELOSIG,MARTIGNONIG,BONETTIF.Intraductal carcinoma of mammary-type apocrine epithelium arising within a papillary hydradenoma of the vulva.Report of a case and review of the literature[J].Arch Pathol Lab Med,1991,115(12):1249-1254.
[7] 赵辩.中国临床皮肤病学[M].南京:江苏科学技术出版社,2010:1564.
[8] NISHIEW,SAWARURA D,MAYUZUMIM,et al.Hidradenoma papilliferum with mixed histopathologic features of syringocystadenoma papilliferum and anogenital mammary-like gland[J].JCutan Pathol,2004,31(8):561-564.
[9] 邵牧民,孟刚,龚西马俞.乳腺大汗腺癌的形态学与免疫表型特征[J].临床与实验病理学杂志,2005,21(1):14-19.
[10] 刘宇飞,陈路,胡余昌,等.乳头状汗腺瘤9例临床病理分析[J].临床与实验病理学杂志,2010,26(2):215-218.
[11] LEE HJ,LEE DA,JUNG SY,et al.Hidradenoma papilliferum occurring on the nasal skin[J].Ann Dermatol,2011,23(2):S254-257.
[12] KIM YJ,LEE JW,CHOI SJ,et al.Ectopic hidradenoma papilliferum of the breast:ultrasound finding[J].J Breast Cancer,2011,14(2):153-155.
(本文编辑:赵丽洁)
R730.261.6
B
1007-3205(2013)07-0825-03乳头状汗腺瘤在皮肤肿瘤中发病率低,容易误诊,本文对20例乳头状汗腺瘤进行临床与病理分析,旨在探讨其发病机制,提高对其认识,指导临床诊断及治疗。报告如下。
2013-02-25;
2013-04-17
许丽娟(1975-),女,黑龙江肇东人,首都医科大学潞河教学医院主治医师,医学硕士,从事皮肤科疾病诊治研究。
*通讯作者
10.3969/j.issn.1007-3205.2013.07.030
