旋覆花素对AD模型大鼠脑海马组织PPARγ表达的影响
2013-03-04王英杰王文胜耿淑坤柴锡庆
王英杰,王文胜,耿淑坤,柴锡庆,3*
(1.河北省邯郸市第一医院神经内科,河北邯郸056002;2.河北医科大学基础医学研究所,省部共建教育部重点实验室,河北石家庄050017;3.河北化工医药职业技术学院新药研发基地,河北石家庄050026)
·论 著·
旋覆花素对AD模型大鼠脑海马组织PPARγ表达的影响
王英杰1,2,王文胜2,耿淑坤1,柴锡庆2,3*
(1.河北省邯郸市第一医院神经内科,河北邯郸056002;2.河北医科大学基础医学研究所,省部共建教育部重点实验室,河北石家庄050017;3.河北化工医药职业技术学院新药研发基地,河北石家庄050026)
目的 观察旋覆花素对β淀粉样蛋白25~35片段(β-Amyloid protein 25-35,Aβ25-35)海马内注射致阿尔茨海默病(Alzheimers disease,AD)模型大鼠海马过氧化物酶体增殖物激活受体γ(peroxisome proliferatoractivated receptorγ,PPARγ)表达的影响,探讨其对AD大鼠的治疗作用及机制。方法30只SD大鼠随机分为对照组、模型组及旋覆花素给药组,Aβ25~35海马内注射制备AD大鼠模型,给药组给予旋覆花素26mg·kg-1·d-1、模型组给予等量溶剂,分2次灌胃,共21d。Western Blot测定大鼠海马PPARγ表达。结果模型组海马PPARγ表达下降,给药组PPARγ表达升高,与模型组比较差异有统计学意义(P<0.05)。结论旋覆花素通过上调PPARγ的表达,从而抑制Aβ诱导的AD模型大鼠脑海马脑内炎症反应。
阿尔茨海默病;过氧化物酶体增殖物激活受体;大鼠
过氧化物酶体增殖物激活受体(peroxisome proliferator activatived receptors,PPARs)是由配体激活的转录因子,属于核激素受体超家族,参与体内众多生理和病理反应的调节,如糖代谢、脂肪代谢和细
胞分化等[1]。PPARs的活性降低与炎症介质的水平上升密切相关,PPARs的抗炎效应在多种炎症性疾病中有重要作用,对于多种人体的疾病,以PPAR作为治疗靶点可以取得明显的效果。越来越多的证据显示阿尔茨海默病(Alzheimers disease,AD)的神经毒性由中枢神经系统炎症介导[2-3],PPARγ在脑内的表达与炎症、神经退行性变关系正在被广泛研究,研究[4-5]显示PPARγ基因参与了AD的发病。本文采用免疫组织化学及Western Blot方法研究旋覆花素对核转录因子κB(nuclear factor-κB,NF-κB)、PPARs激活的影响,为探明旋覆花素抑制AD脑炎症反应提供实验依据。
1 材料与方法
1.1 实验动物:健康雄性SD大鼠30只(由河北省实验动物中心提供,动物合格证号611071),鼠龄10~12月龄,体质量(364.5±15.0)g,随机分为对照组、模型组和旋覆花素给药组,每组10只。给药组术前3 d及术后每天用旋覆花素26mg·kg-1· d-1灌胃,共21d。模型组用旋覆花素的溶剂吐温80水溶液同法处理。
1.2 试剂与仪器:旋覆花素由河北医科大学药学院从欧亚旋覆花的氯仿提取物中分离制备(已获专利授权),含旋覆花内酯(1-o-acetylbritannilactone,ABL)2.66g/L。β淀粉样蛋白25~35片段(β-Amyloid protein 25~35,Aβ25~35)购自Sigma公司;PPARγ抗体购自Santa Cruz公司;免疫组织化学试剂盒购自北京中杉金桥生物技术公司;脑立体定向仪,江湾Ⅰ型C,上海川沙花木农机厂制造。
1.3 Aβ25~35的孵育:用无菌生理盐水将Aβ25~35稀释成10g/L,37℃孵育72h,使其变为聚集状态的Aβ25~35,置于在4℃冰箱备用。
1.4 药物海马内注射方法:大鼠用质量浓度为20g/L的乌拉坦60mg/kg腹腔注射麻醉后,固定于脑立体定向仪上。参照大鼠脑立体定位图谱[2],以前囟为零点,于前囟后3.5mm,中线右侧旁开2mm,为穿刺点,用牙科钻钻开颅骨,以微量注射器自脑表面垂直进针3mm,分别于双侧海马CA1区于5min内缓慢注射Aβ25~35各1μL(10μg),5min缓慢注入,留针5min,对照组注射等量生理盐水,退针缝合切口。术前3d及术后18d,给药组给予旋覆花素26mg·kg-1·d-1分2次灌胃,模型组给予等量溶剂。
1.5 免疫组织化学染色:参照使用说明书进行经过乙醇梯度脱水、石蜡垂直包埋,间断均匀切片,切片厚约10μm,采用链霉亲和素-生物素复合素(strept advin-biotin complex,SABC)方法进行免疫组织化学染色。以抗PPARγ(1∶100)抗体为一抗,其他操作按试剂盒说明书进行。以镜下出现棕黄色颗粒作为判定阳性染色的标准。用磷酸盐缓冲液替代一抗作为阴性对照。
1.6 Western Blot分析:各组取等量蛋白提取液80μg,经12%聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electroresis,SDS-PAGE)电泳分离后,于半干转膜仪上转移至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF),用5%脱脂奶粉封闭,与抗PPARγ抗体(1∶300)在4℃条件下反应过夜。然后与HRP标记的相应二抗(1∶10 000)室温反应2h,室温条件下用TTBS、TBS充分振荡洗膜后采用化学发光法显影。用美国Kodak公司ID数码成像分析系统分析结果。
1.7 统计学方法:应用SPSS 13.0统计软件包处理数据,计量资料以±s表示,采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
免疫组织化学染色结果显示,模型组大鼠脑海马组织中PPARγ表达较对照组明显下降,染色细胞数量少,着色浅。旋覆花素给药组大鼠脑海马组织PPARγ的表达明显较模型组增强,染色细胞数量多,着色变深(图1)。
Western Blot显示,对照组大鼠脑海马组织PPARγ表达量高,模型组海马组织表达量显著降低,旋覆花素给药组大鼠脑海马组织PPARγ表达量明显上调,与模型组比较差异有统计学意义(P<0.05)(图2)。

图1 大鼠海马CA1区PPARγ表达免疫组织化学染色(×400)A.对照组;B.模型组;C.给药组
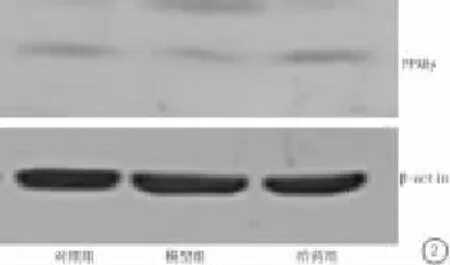
图2 Western Blot检测海马组织PPARγ表达
3 讨 论
PPAR在AD中发挥多种作用,其中抗炎效应是其重要的一方面。Sung等[6]研究发现,PPARγ合成配体噻唑烷二酮类药物(thiazolidinediones,TZDs)2,4-TZD可以减少p65核移位,降低NF-κB的结合能力,说明PPAR通过抑制NF-κB途径发挥其抗炎效应。PPAR激动剂可以抑制Aβ25~35介导的小胶质细胞的活化,从而阻止皮质和海马神经元死亡,PPARγ激动剂可以治疗AD、帕金森病等神经变性病[7-9]。Sastre等[10]研究表明,与健康人比较AD患者前脑PPAR蛋白水平降低40%,并且与β位点APP内切酶1(beta-site amyloid precursor protein cleavage 1,BACE1)启动子的过氧化物酶体增殖物反应元件结合能力下降50%,这导致了BACE1的活化,Aβ25~35产生增多,加重AD脑的慢性炎症。PPARγ已成为合成治疗AD药物的有效靶点。
欧亚旋覆花性味咸、温,属菊科旋覆花属植物,是一种传统的中草药,具有活血化瘀、抗炎止痛之功效。旋覆花素的抗炎机制与抑制NF-κB活化、下调其下游基因环氧化酶2和诱导型一氧化碳合酶表达有关。本文中模型组大鼠海马内PPAR基因表达显著低于对照组,说明Aβ25~35海马内注射可抑制海马组织PPAR基因的表达。
给予旋覆花素治疗后,大鼠脑海马组织内PPAR基因表达明显上调,表明旋覆花素能够促进Aβ海马内注射诱发的AD模型大鼠PPAR基因的表达。
综上所述,旋覆花素能上调PPAR基因表达,从而抑制NF-κB表达,抑制其下游炎症因子,减轻Aβ25~35海马内注射引起的脑内炎症反应,减轻神经元的损伤。
[1] XU P,XU K,WANG J,et al.Pioglitazone:a promising therapeutictool in sodium taurocholate-induced severe scute pancreatitis[J].Dig Dis Sci,2011,56(4):1082-1089.
[2] LEE YJ,HAN SB,NAM SY,et al.Inflammation and Alzheimer's disease[J].Arch Pharm Res,2010,33(10):1539-1556.
[3] CHUNG HY,SUNG B,JUNG KJ,et al.The molecular inflammatory process in aging[J].Rev Clin Gerontol,2006,8(3/ 4):572-581.
[4] SCACCHI R,PINTO A,GAMBINA G,et al.The peroxisome proliferator-activated receptor gamma(PPAR-gamma2)Pro12Ala polymorphism is associated with higher risk for Alzheimer's disease in octogenarians[J].Brain Res,2007,1139:1-5.
[5] KOIVISTO AM,HELISALMI S,PIHLAJAMAKI J,et al. Association analysis of peroxisome proliferator-activated receptor gamma polymorphisms and late onset Alzheimer's disease in the Finnish population[J].Dement Geriatr Cogn Disord,2006,22(5/6):449-453.
[6] SUNG B,PARK S,YU BP,et al.Amelioration of age-related inflammation and oxidative stress by PPARgamma activator:suppression of NF-kappaB by 2,4-thiazolidinedione[J].Exp Gerontol,2006,41(6):590-599.
[7] KAUNDAL RK,SHARMA SS.Peroxisome proliferator-activated receptor gamma agonistsasneuroprotective agents[J].Drug News Perspect,2010,23(4):241-256.
[8] MANDREKAR-COLUCCIS,LANDRETH GE.Nuclear receptors as therapeutic targets for Alzheimer's disease[J].Expert Opin Ther Targets,2011,15(9):1085-1097.
[9] BAJDA M,GUZIOR N,IGNASIK M,et al.Multi-target-directed ligands in Alzheimer's disease treatment[J].Curr Med Chem,2011,18(32):4949-4975.
[10] SASTRE M,DEWACHTER I,ROSSNER S,et al.Nonsteroidal anti-inflammatory drugs repress beta-secretase gene promoter activity by the activation of PPARgamma[J].Proc Natl Acad Sci USA,2006,103(2):443-448.
(本文编辑:赵丽洁)
R743.9
B
1007-3205(2013)07-0802-03
2012-11-08;
2013-03-05
王英杰(1973-)男,河北邯郸人,河北省邯郸市第一医院副主任医师,医学博士,从事老年痴呆疾病诊治研究。
*通讯作者。E-mail:xqchai@163.com
10.3969/j.issn.1007-3205.2013.07.021
