缬沙坦预处理后缺血再灌注损伤大鼠冠状动脉重构与AT2R表达
2013-03-04唐显军钟艺华
唐显军,钟艺华
(重庆市肿瘤研究所 400031)
心脏作为内分泌器官存在独立的肾素-血管紧张素系统(RAS),它是心血管生理、病理最重要的调节系统,血管紧张素Ⅱ(AngⅡ)被证实可以引起血管重构,血管内皮细胞分泌的AngⅡ可促进血管平滑肌细胞的增殖与肥大[1]。在某些病理状态下:如缺血性心脏病、组织重建、心肌梗死、血管新生内膜损伤、血管紧张素Ⅱ2型受体(AT2R)再度重新表达。
血管重构在原发性高血压研究颇多,而临床常见急性冠脉缺血事件,反复的缺血及再血管化实则已触发了相应冠状动脉构型的变化。本实验采用术前相对较长时间的血管紧张素Ⅱ1型受体(AT1R)阻断,缺血再灌注术后持续阻断AT1R来观察大鼠冠状动脉重构与AT2R表达关系。
1 材料与方法
1.1 动物模型制备 健康雄性SD大鼠123只,体质量150~250g。随机分成3组:假手术(Sham)组11只;对照(Control)组即生理盐水灌胃组:14只×4组(分设4个时间点:3、7、14、28d);缬沙坦(ARB)组即缬沙坦10mg·kg-1·d-1灌胃组:14只×4组(分设4个时间点:3、7、14、28d)。各组术前4周开始灌胃。手术行气管切开插管,连通动物呼吸机(潮气量约40mL/kg,呼吸频率为每分钟70次)。沿左侧胸骨旁斜切口,手术采用开胸结扎左冠状动脉前降支,30min后松脱结扎线,恢复血流再灌注,Sham组开胸不结扎动脉。术后继续给药:前3d腹腔注射给药,剂量各组不变,3d后改为灌胃,直至于相应时间点(3、7、14、28d)对照组,ARB组各亚组处死取材,假手术组7d处死取材。
1.2 血流动力学检测 各时间点给予2.5%戊巴比妥钠腹腔内注射麻醉大鼠,逐层切开皮肤、浅筋膜、深筋膜,分离出颈总动脉,结扎远心端,近心端血管钳钳夹,插入聚苯乙烯心导管,松开血管钳,将导管推送至主动脉,连接MPA-2000M型多道生理记录仪,当数值稳定时记录动脉收缩压(SBP)、动脉舒张压(DBP);然后将导管插进左心室,当数值稳定时记录左室收缩压(LVSP)、左室舒张末压(LVEDP),左室压力上升、下降速率。
1.3 标本取材 各时间点大鼠测定完血流动力学后,导管退出左心室,从导管内注射30mmol/L氯化钾后拔除导管,活体灌注生理盐水,再灌注4%多聚甲醛以预固定心脏;取出心脏标本再行固定24h(4℃4%多聚甲醛);常规石蜡包埋;自心脏中部开始分别向上、向下沿左室长轴垂直每隔1mm横断面连续切片,两张为一对(4μm厚),分别标记+1对、+2对……;-1对、-2对……。免疫组化(immunohistochemistry,IHC)检测AT2R等均用配对切片。
1.4 主要试剂 兔抗鼠Ⅰ型胶原抗体、兔抗鼠Ⅲ型胶原抗体(SantaCruz公司);天狼猩红(Sigma,美国);即用型SABC、DAB显色试剂盒、兔抗鼠AT2抗体(武汉博士德生物有限公司)。
1.5 病理检查 血管周围胶原容积分数测定:每张经PSR染色的切片,在光镜下分为外径为100μm以上(大冠状动脉)和100μm以下(小冠状动脉)的血管[2],用Image Pro Plus 4.0专业显微图像分析软件进行图像分析,计算每个视野中胶原组织所占面积与血管内腔面积之比值(划轮廓线计算面积)。并计算中膜面积与内膜面积之比值以及F值。F=1视为正圆,0.75≤F<1视为椭圆,F<0.75的血管视为不规则弃之。血管紧张素受体光密度值测量:随机取4个视野,用Image Pro Plus 4.0专业显微图像分析软件进行图像分析,通过灰度调节测量每个视野的光密度值。
2 结 果
2.1 AT2R的定位 AT2R定位于冠状动脉外膜呈放射状分布。冠脉内膜也有部分表达,见图1。
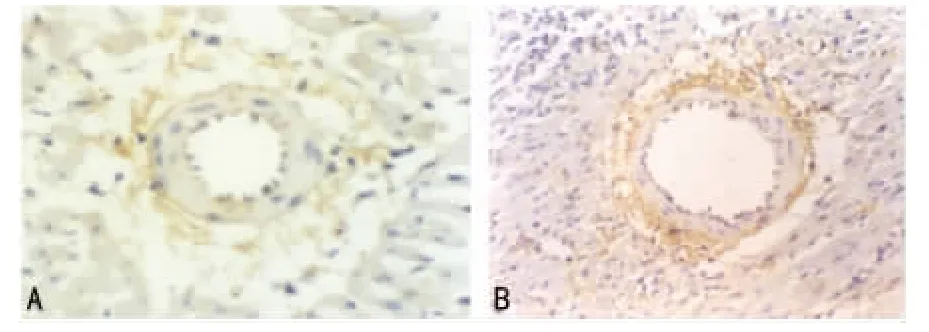
图1 血管紧张素受体分布
2.2 血流动力学改变 缺血再灌注损伤(I-R)术后3d心功能明显下降,舒张功能受损尤为明显;28d心功能有明显恢复,ARB组各血流动力学指标恢复接近正常水平(表1)。
2.3 I-R损伤后AT2R的动态变化 AT2R在对照组I-R术后3d较低表达,7d时达峰值。ARB组I-R术后3、7d时AT2R高表达,且它的这两个时间点光密度值相接近。AT2R在Sham组未检出。I-R术后14d及28d时对照组、ARB组AT2R低检出(图2)。
2.4 冠状动脉重构 I-R术后冠状动脉重构表现为血管周围胶原沉积;血管中膜增生,血管腔狭窄。I-R术后28d时大冠状动脉血管周围胶原容积分数对照组高于假手术组和ARB组,差异有统计学意义(P<0.05);而ARB组略高于Sham组,差异无统计学意义。阻力小动脉血管周围胶原容积分数各实验组差异无统计学意义。I-R术后血管 M/L:在阻力小动脉、大冠状动脉中对照组及ARB组较Sham组高,但差异无统计学意义(表2、图3)。
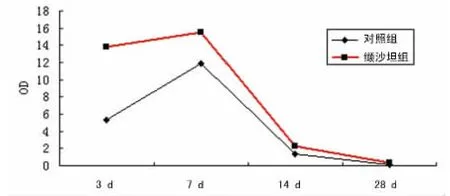
图2 冠状动脉血管周围AT2R的变化
表1 各实验组I-R术后3、28d血流动力学变化(±s)
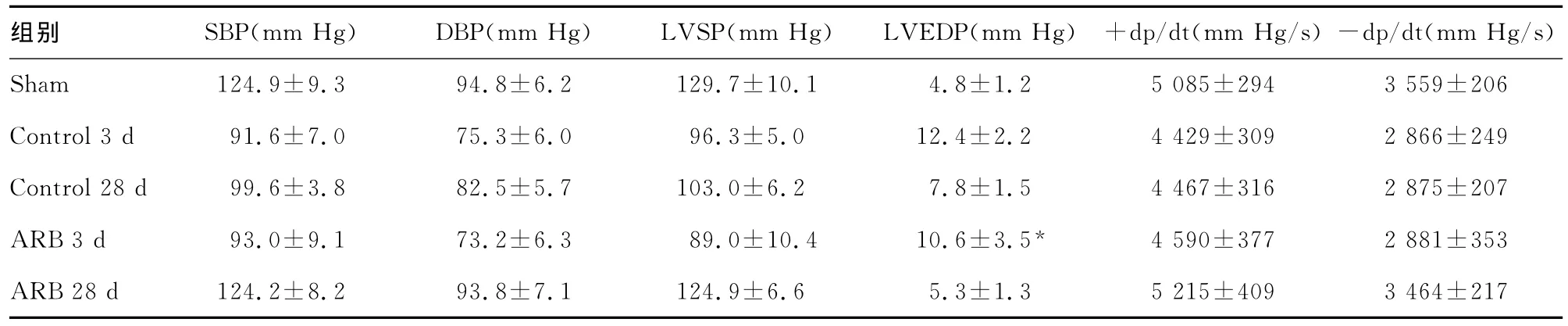
表1 各实验组I-R术后3、28d血流动力学变化(±s)
*:P<0.05,与Sham组比较。
组别 SBP(mm Hg) DBP(mm Hg) LVSP(mm Hg) LVEDP(mm Hg) +dp/dt(mm Hg/s)-dp/dt(mm Hg/s)Sham 124.9±9.3 94.8±6.2 129.7±10.1 4.8±1.2 5085±294 3 559±206 Control 3d 91.6±7.0 75.3±6.0 96.3±5.0 12.4±2.2 4 429±309 2 866±249 Control 28d 99.6±3.8 82.5±5.7 103.0±6.2 7.8±1.5 4 467±316 2 875±207 ARB 3d 93.0±9.1 73.2±6.3 89.0±10.4 10.6±3.5* 4 590±377 2 881±353 ARB 28d 124.2±8.2 93.8±7.1 124.9±6.6 5.3±1.35 215±409 3 464±217
表2 I-R术后28d冠状动脉重构(±s)
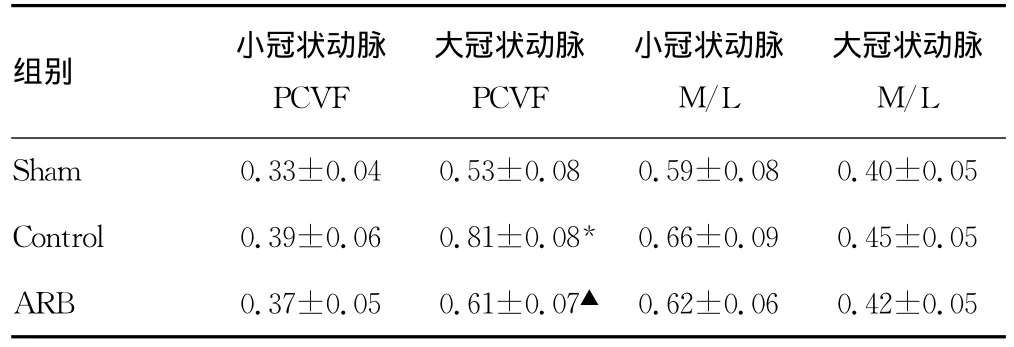
表2 I-R术后28d冠状动脉重构(±s)
*:P<0.05,与Sham 组比较;▲:P<0.05,与Control组比较。
组别 小冠状动脉PCVF大冠状动脉PCVF小冠状动脉M/L大冠状动脉M/L Sham 0.33±0.04 0.53±0.08 0.59±0.08 0.40±0.05 Control 0.39±0.06 0.81±0.08* 0.66±0.09 0.45±0.05 ARB 0.37±0.05 0.61±0.07▲0.62±0.06 0.42±0.05
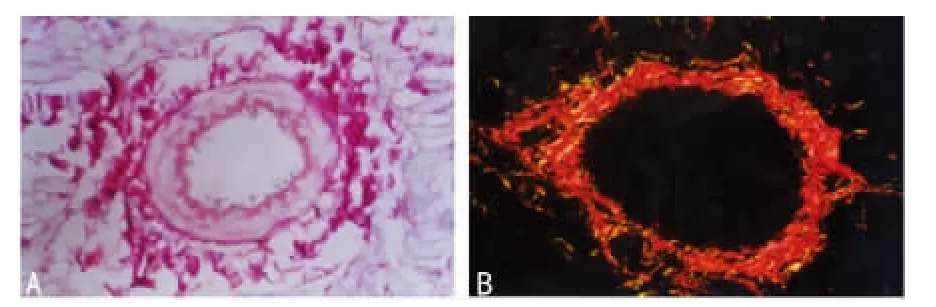
图3 胶原沉积
3 讨 论
本实验发现:AT2R定位于冠状动脉外膜呈放射状分布,尤以大血管冠周密度较高,冠状动脉内膜也有部分表达。Akishita等[3]认为 AT2R定位于冠状动脉管周区,成纤维细胞、平滑肌细胞、内皮细胞表达AT2R,与本实验观察较一致。
血管重构一直以来受到学术界广泛的关注,有学者用中膜/内腔比值来观察[4]。管腔狭窄、中膜平滑肌增生导致的中膜增厚、血管周围胶原的沉积无一不影响着血管的生物学活性,而不同口径的冠状动脉发生重构及其产生的生物学效应是不完全一致的。相关文献报道:大动脉重构主要表现主动脉中层VSMC增加,而小动脉主要通过持续收缩状态增加微循环阻力,而其VSMC增殖和细动脉管壁纤维化的器质性病变不明显[5]。
本实验因客观条件的限制粗略地将冠状动脉按内径大小以100μm为界值分成两组:大冠状动脉(内径远大于100μm)和小冠状动脉(内径小于100μm)。为减少可能产生的误差,在图像分析处理时,尽量采集规则圆形或近圆形分析。对照组冠状血管周围胶原沉积,I-R术后28d大冠状动脉血管周围胶原容积分数对照组高于假手术组,差异具有统计学意义。而冠状动脉中膜面积与内腔面积的比值虽然与Sham组无显著性差异,但大冠状动脉及阻力小动脉M/L高于Sham组,且阻力小动脉M/L增加的幅度相对高于主冠状动脉,这些结果提示:在I-R的冠状动脉重构中,大冠状动脉的血管周围胶原沉积可能占相对优势,而阻力小血管中膜增厚可能会在此后更长时间的小冠状动脉重构中会占相对优势。冠状动脉的这种形态结构的几何改变与小冠状动脉阻力增加,大动脉的弹性、顺应性下降等生物学行为变化是相关联的。冠状动脉构型的这种改变最终将传导至心脏血流动力学的改变,以致本实验观察到IR术后3d心功能明显下降,尤以舒张功能受损明显。
在ARB组作者观察到胶原在血管周围的沉积受到抑制,在大冠状动脉管周PCVF与对照组比较明显下降,差异具有统计学意义,28d时的PCVF较接近于Sham组。同时,IHC染色发现AT2R在血管周围有一过性的高表达,血管内皮细胞也有少量表达,在本实验中AT2R在血管重构方面的这种变化是与文献报道相一致的。不同级别的动脉血管发生重构的形态学变化不同,其机制也不一致[6-7]。血管紧张素转换酶受体拮抗剂(ARB)可通过阻断AngⅡ的介导反应,从而抑制血管内皮细胞的表达,影响血管重构,延缓动脉硬化及心血管病的进展[8]。RAS系统、血管重构之间存在着复杂的网络联系,AngⅡ在其中起关键调控作用[9]。AngⅡ还可能通过结缔组织生长因子、炎症因子的表达刺激胶原纤维增生以及细胞外基质沉积、加速血管平滑肌的生长发育,促进血管重构的形成[10]。
因此作者推测I-R损伤术后冠状动脉血管发生重构:主要表现为大冠状动脉血管周围的胶原沉积,小冠状动脉M/L增加。AT2R在抑制胶原沉积,改变动脉中膜内腔比值中起重要作用,缬沙坦可能正是通过心肌I-R损伤后AT2R的一过性高表达来抑制冠状动脉重构而达到保护心功能的目的。
[1]Dhingra S,Sharma AK,Singla DK,et al.p38and ERK1/2 MAPKs mediate the interplay of TNF-a and IL-10in regulating oxidative stressand cardia myocyte apoptosis[J].Am J Physiol Heart Circ Physiol,2007,293(16):3524-3531.
[2]Numaguchi K,Egashira K,Takemoto M,et al.Chronic inhibition of nitric oxide synthesis causes coronary microvascular remodeling in rats[J].Hypertension,1995,26(pt 1):957.
[3]Akishita M,Ewai M,Wu L,et al.Lan inhibitory effect of angⅡiotensinⅡtype 2receptor on coronary arterial remodeling after aortic banding in mice[J].Circulation,2000,102(14):1684-1689.
[4]Kassiri Z,Zhong J,Guo D,et al.Loss of angiotensin-converting enzyme 2accelerates maladaptive left ventricular remodeling in response to myocardial infarction[J].Circ Heart Fail,2009,2(5):446-455.
[5]曹相玫,孙金萍,景丽,等.原发性高血压大鼠动脉血管重构的形态学研究[J].重庆医学,2012,41(27):2801-2803.
[6]Nguyen Dinh Cat A,Touyz RM.Cell signaling of anglotensinⅡ on vascular tone:novel mechanisms[J].Curr Hypertens Rep,2011,13(2):122-128.
[7]Paravicini TM,Montezano AC,Yusuf H,et al.Activation of vascular p38MAPK by mechanical stretch is independent of c-Src and NADPH oxidase:influence of hypertension and angiotensinⅡ[J].J Am Soc Hypertens,2012,14(2):275-298.
[8]王筱梅,刘少奎.缬沙坦对血管损伤小鼠血管重构的影响[J].中国循证心血管医学杂志,2012,4(4):363-365.
[9]Galderisi M,de Divitiis O.Risk factor-induced cardiovascular remodeling and the efects of angiotensin-converting enzyme inhibitors[J].J Cardiovasc Pharmacol,2008,51(4):523-531.
[10]Zhong JC,Yu XY,Lin QX,et al.Enhanced angiotensin converting enzyme 2regulates the insulin/Akt signalling pathway by blockade of macrophage migration inhibitory factor expression[J].Br J Pharmacol,2008,153(1):66-74.
