内皮-单核细胞激活多肽对人U118胶质瘤细胞自噬的影响及机制
2013-02-27刘丽波孟繁杰薛一雪刘云会
刘丽波,孟繁杰,薛一雪,刘云会
(1.中国医科大学基础医学院神经生物学教研室,辽宁沈阳 110001;2.中国医科大学附属盛京医院神经外科,辽宁 沈阳 110004)
脑胶质瘤是恶性程度很高的原发性颅内肿瘤,约占中枢神经系统肿瘤的60%。脑胶质瘤患者虽经手术、放疗及化疗等多种治疗手段的干预,但死亡率仍高达98%以上,因此提高疗效,延长患者的生存期成为亟待解决的一大难题[1]。内皮-单核细胞激活多肽Ⅱ(endothelial monocyte activating polypeptideⅡ,EMAP-Ⅱ)是从甲基胆蒽A诱导形成的纤维肉瘤细胞的培养液中发现的,具有促进细胞凋亡和抑制肿瘤血管生成的特性[2]。研究显示,EMAP-Ⅱ能够抑制多种原发性和继发性肿瘤的生长、增殖和侵袭,因而被广泛应用于抗肿瘤治疗的研究[3]。自噬(又称为Ⅱ型程序性死亡)是广泛存在于真核细胞中的生命现象,是利用溶酶体清除受损细胞器及异常蛋白质的过程,与细胞稳态的维持和疾病的发生密切相关。在肿瘤的发生过程中,自噬通过影响细胞周期、调节肿瘤细胞的凋亡以及调控肿瘤血管生成等方面参与肿瘤的发生与发展[4]。但EMAP-Ⅱ是否通过诱导肿瘤细胞自噬发挥抑制肿瘤细胞增殖,尚不清楚。本研究拟以人U118胶质瘤细胞为研究对象,观察EMAP-Ⅱ对自噬标志蛋白LC3、自噬降解底物p62/SQSTM1和自噬相关蛋白Beclin1表达水平的影响,探讨 EMAP-Ⅱ抑制人U118细胞活力及诱导自噬的作用效果及可能机制,为EMAP-Ⅱ的临床应用提供实验依据。
1 材料与方法
1.1 试剂和仪器EMAP-Ⅱ (PeproTech公司);MTT、3-MA(Sigma公司);DMEM细胞培养液(Gibco公司);胎牛血清(杭州四季青公司);兔抗LC3多克隆抗体、小鼠抗p62/SQSTM1单克隆抗体和兔抗Beclin1多克隆抗体(Abcam公司);小鼠抗GAPDH单克隆抗体、辣根过氧化物酶标记的二抗、TRITC标记的二抗和ECL化学发光检测试剂盒(Santa Cruz公司)。主要仪器:多功能酶标仪(Molecular Devices,美国),正置显微镜(Olympus,日本),电泳装置(Bio-Rad,美国)。
1.2 细胞培养人U118神经胶质瘤细胞株由中国医科大学神经生物学教研室保存。用高糖DMEM培养基加10%胎牛血清培养U118细胞,置37℃、5%CO2培养,2~3 d传代1次。取对数生长期细胞进行实验。
1.3 细胞活力测定细胞活力采用MTT方法检测。制备U118细胞悬液,以每孔100 μl含1×104细胞数接种于96孔板,培养24 h后对照组(DMEM培养液)和不同浓度的 EMAP-Ⅱ (0.005、0.05和0.5 nmol·L-1)组分别作用0.5、1、2、3和6h,而后终止反应,弃去培养液,加入0.5 g·L-1的 MTT溶液孵育4 h,弃去液体,加入100 μl DMSO振荡溶解10 min,使结晶充分溶解,酶标仪测定490 nm波长处各孔光吸收值。实验重复8次。
1.4 流式细胞术检测线粒体膜电位取对数生长期的U118细胞,分组给药后,收集5×105个细胞,用PBS洗涤2次,取500 μl JC-1工作液将细胞均匀悬浮,37℃,5%CO2培养箱中孵育 20 min,收集细胞,用1×孵育缓冲液洗涤2次,用500 μl的1×孵育缓冲液重新悬浮细胞。用流式细胞仪检测,绿色荧光通过通道FL1检测,红色荧光通过通道FL2检测。JC-1的聚集依赖于线粒体的膜电位,在线粒体膜电位较高时,JC-1以多聚体的形式聚集在线粒体内发红色荧光;当线粒体膜电位较低时,JC-1不能聚集到线粒体内,以单体形式存在于胞质内发绿色荧光。
1.5 免疫荧光法检测LC3的表达和分布4%多聚甲醛固定EMAP-Ⅱ作用不同时间的生长在盖玻片上的U118细胞,PBS漂洗后用10%BSA封闭30 min,兔抗LC3一抗反应过夜(阴性对照用0.01 mol·L-1的PBS代替一抗),PBS清洗后用TRITC标记的二抗避光条件下反应30 min,甘油封片,在荧光显微镜下,用激发波长为565 nm的滤光片进行观察,采集图像。
1.6 Western blot实验收集EMAP-Ⅱ作用不同时间的人U118胶质瘤细胞,加入RIPA裂解液(10 g ·L-1aprotinin,10 g·L-1PMSF 和50 mmol·L-1sodium orthovanadate)。采用考马斯亮蓝G250结合法测定细胞提取物的蛋白浓度,以每加样孔10~20 μg蛋白总量经SDS-PAGE电泳进行分离,并转移至PVDF膜,于4℃用5%脱脂奶粉封闭过夜。分别加入LC3、p62/SQSTM1、Beclin1和 GAPDH 的一抗室温2 h,辣根过氧化物酶标记的二抗室温2 h后,向膜上滴加ECL工作液,进行压片曝光,显影定影,用Chemi Imager 5500 V2.0软件扫描获取图像,通过Fluor Chen 2.0软件进行定量分析,测得光密度值(integrated density value,IDV)。以目的蛋白与内参照GAPDH的吸光度值的比值代表目的蛋白的相对表达量。
1.7 统计学处理所有数据以±s表示,采用SPSS 13.0统计学软件进行统计学分析,两组间采用t检验,多组间采用单因素方差分析和Bonferroni检验。
2 结果
2.1 EMAP-Ⅱ对U118细胞活力的影响如Fig 1A 所示,不同浓度(0.005、0.05 和0.5 nmol·L-1)的 EMAP-Ⅱ作用于 U118 细胞0.5、1、2、3 和6 h 后,U118细胞的活力受到明显抑制,在EMAP-Ⅱ作用0.5 h时抑制效果最明显;EMAP-Ⅱ抑制U118细胞活力的效果呈剂量依赖性,其中0.05和0.5 nmol·L-1EMAP-Ⅱ组之间没有差异,证明0.05 nmol·L-1是EMAP-Ⅱ作用的最适剂量,因此我们选用0.05 nmol·L-1EMAP-Ⅱ进行后续实验。
为检测EMAP-Ⅱ是否通过诱导U118胶质瘤细胞自噬抑制其活力,应用5 mmol·L-1的3-MA预处理1 h 后给予0.05 nmol·L-1的 EMAP-Ⅱ,作用0.5 h后检测U118细胞活力,结果显示3-MA能够有效阻断EMAP-Ⅱ的作用,使细胞活力恢复(Fig 1B)。
2.2 EMAP-Ⅱ对U118细胞MMP的影响线粒体探针JC-1用于检测细胞MMP,反映线粒体的功能。0.05 nmol·L-1的EMAP-Ⅱ作用后能够明显降低U118细胞的MMP,抑制线粒体功能,在EMAP-Ⅱ作用0.5 h时效果最明显;3-MA能有效阻断EMAP-Ⅱ的作用,使U118胶质瘤细胞的MMP升高,线粒体功能恢复(Fig 2)。
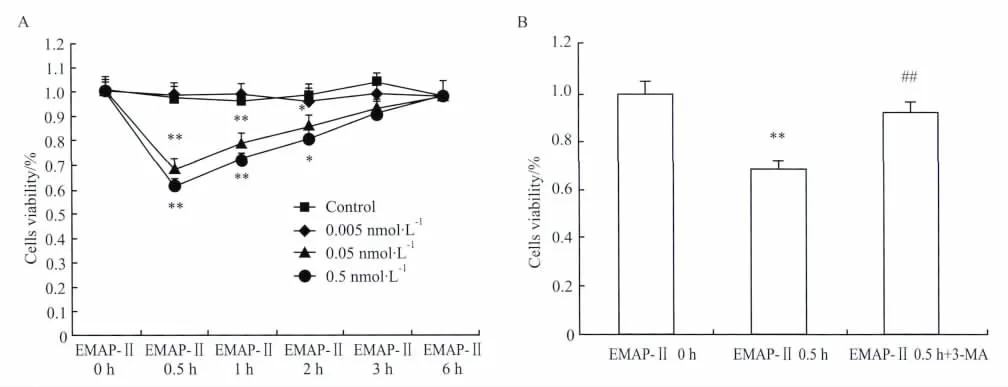
Fig 1 A:Cells viability of human U118 glioma cells after treatment with 0.005,0.05 and 0.5 nmol·L-1EMAP-Ⅱ for 0.5,1,2,3 and 6 h(±s,n=8).*P<0.05,**P<0.01 vs EMAP-Ⅱ0 h group values.B:Effects of 3-MA on cells viability of human U118 glioma cells after treatment with 0.05 nmol·L-1EMAP-Ⅱfor 0.5 h(±s,n=8).**P<0.01 vs EMAP-Ⅱ0 h group values;##P<0.01 vs EMAP-Ⅱ0.5 h group values
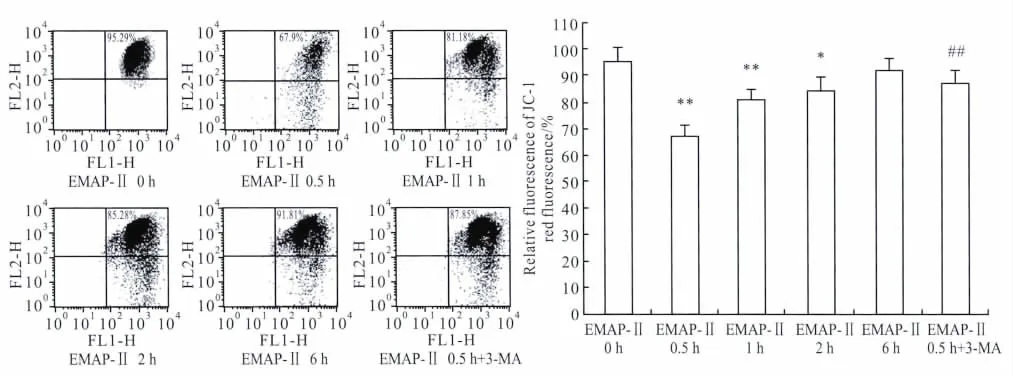
Fig 2 Effects of EMAP-Ⅱand 3-MA on MMP of human U118 glioma cells(±s,n=5)
2.3 EMAP-Ⅱ对LC3分布和表达的影响免疫荧光染色显示,EMAP-Ⅱ0 h组的U118细胞中,在细胞质中可见到微弱的LC3荧光表达(Fig3A)。EMAP-Ⅱ作用后,LC3的表达明显上调(Fig 3B),呈点状分布在细胞质中。Western blot实验结果也证实,EMAP-Ⅱ作用能够明显增加 LC3-Ⅱ的表达,在0.5 h时达峰值(Fig 4)。
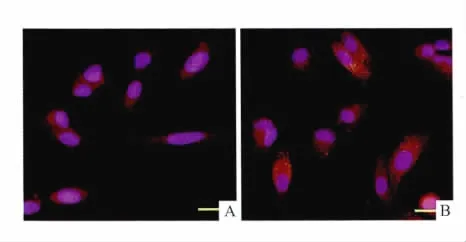
Fig 3 Expression and distribution of LC3 analyzed by immunofluorescence assay after treatment with EMAP-Ⅱin human U118 glioma cells for 0.5 h
2.4 EMAP-Ⅱ作用后p62/SQSTM1和Beclin1在U118细胞中的表达EMAP-Ⅱ作用于U118细胞0.5、1、2、3 和 6 h 后,Western blot结果显示,与EMAP-Ⅱ0 h组相比,EMAP-Ⅱ作用后自噬降解底物p62/SQSTM1的蛋白表达水平明显下降,而自噬相关蛋白Beclin1的蛋白表达水平则明显增加,二者均在EMAP-Ⅱ作用0.5 h时变化最明显(Fig 5)。
3 讨论
目前对于脑胶质瘤的治疗,特别对于恶性或高级别胶质瘤的治疗,即使采取综合治疗仍然很难达到长期控制肿瘤。化疗是胶质瘤综合治疗的重要环节,可提高患者生活质量,延长平均中位生存期和无效进展期。近年研究发现,化疗可以诱导胶质瘤细胞产生自噬,并参与了自噬的分子调控[5]。目前,调节自噬反应已经成为包括胶质瘤在内的多种癌症治疗的新靶点,对自噬调节机制的深入研究可能为脑胶质瘤的治疗提供新的有效途径。

本研究中,我们应用MTT法检测发现,EMAP-Ⅱ能够明显降低人U118胶质瘤细胞的活力,在EMAP-Ⅱ作用0.5 h时效果最明显,随着作用时间延长细胞活力逐渐恢复。为探讨EMAP-Ⅱ作用能快速降低人U118细胞活力的原因,我们检测了EMAP-Ⅱ对人U118胶质瘤细胞的MMP的影响,结果显示EMAP-Ⅱ作用0.5 h即能有效降低U118细胞的MMP,抑制线粒体功能,随着作用时间的延长MMP逐渐恢复;上述结果显示EMAP-Ⅱ能通过抑制线粒体功能影响人U118胶质瘤细胞的活力,随着EMAP-Ⅱ作用时间的延长,线粒体功能的恢复,导致细胞活力得以恢复。
EMAP-Ⅱ是否通过自噬途径抑制U118胶质瘤细胞活力,尚不清楚。LC3是检测自噬的标志蛋白,细胞内存在两种形式的LC3蛋白:LC3-Ⅰ和LC3-Ⅱ。LC3蛋白在合成后其C端即被Atg4蛋白酶切割变成LC3-Ⅰ,分布于胞质中;当自体吞噬发生时,LC3-Ⅰ与磷脂酰乙醇胺偶联形成LC3-Ⅱ,定位于自噬体内膜和外膜,并且LC3-Ⅱ始终稳定地保留在自噬体膜上直到与溶酶体融合,因此被用来做为自噬体的标记,而且LC3-Ⅱ的水平在某种程度上反映了自噬体的数量[6]。我们的研究结果显示,EMAP-Ⅱ作用后人U118胶质瘤细胞内的点状聚集明显增多,并且 LC3-Ⅱ的蛋白表达水平明显上调,在EMAP-Ⅱ作用0.5 h时上调最明显。同时,Western blot结果显示,EMAP-Ⅱ能够降低U118细胞 p62/SQSTM1的蛋白表达,其变化趋势与LC3-Ⅱ的趋势相一致。p62/SQSTM1被认为是泛素化蛋白聚集体和自噬复合物之间的接头蛋白,可与LC3结合定位于自噬体,作为自噬的一个选择性降解底物,最终能被自噬溶酶体系统降解[7]。因此,p62/SQSTM1的表达也可以作为检测自噬的一个指标。上述结果证明,EMAP-Ⅱ可通过诱导人U118胶质瘤细胞的自噬,进而抑制细胞活力,但具体机制需要深入研究。
Beclin1是第一个确定的哺乳动物自噬蛋白,能够与Vps34 PI3K(Ⅲ型)、紫外线照射耐药相关基因等形成蛋白复合物,参与自噬体双膜结构的形成[4]。研究证明[8]Beclin1等位基因在人类乳腺癌、卵巢癌和前列腺癌缺失,并且Beclin1的缺失能够导致小鼠肿瘤的发生,而Beclin1表达的恢复则能诱导自噬,抑制肿瘤发生发展。有报道认为[9]Beclin1也参与了脑胶质瘤的自噬反应。在本研究中,EMAP-Ⅱ作用后能够明显促进人U118胶质瘤细胞中Beclin1的蛋白表达水平,提示Beclin1是EMAP-Ⅱ诱导U118细胞自噬,进而抑制其活力的调节机制之一。
自噬在癌症和治疗应答中的作用很复杂,自噬既可以作为肿瘤抑制者,也可以作为癌细胞生存保护者[10]。在胶质瘤的治疗中,EMAP-Ⅱ对人 U118胶质瘤细胞究竟起到怎样的作用呢?我们应用3-MA预处理后给予EMAP-Ⅱ,检测U118胶质瘤细胞的活力和 MMP,结果显示3-MA能够有效阻断EMAP-Ⅱ抑制细胞活力和降低细胞MMP的能力,提示EMAP-Ⅱ可通过诱导细胞自噬,导致线粒体功能严重受损,抑制细胞活力。研究显示自噬过程经历的时间相对较短[11],随着EMAP-Ⅱ作用时间的延长,自噬减少,能够使U118胶质瘤细胞的线粒体功能恢复,进而引起细胞活力恢复。
综上所述,EMAP-Ⅱ能够有效抑制人U118胶质瘤细胞的活力,降低细胞MMP,其作用机制可能与EMAP-Ⅱ上调胶质瘤细胞中自噬相关蛋白Beclin1表达,进而降低p62/SQSTM1、增加LC3-Ⅱ的表达,诱导胶质瘤细胞自噬有关。
[1] Kuijlen J M,Bremer E,Mooij J J,et al.Review:on TRAIL for malignant glioma therapy [J] ?Neuropathol Appl Neurobiol,2010,36(3):168-82.
[2] Shalak V,Guigou L,Kaminska M,et al.Characterization of p43(ARF),a derivative of the p43 component of multiaminoacyl-tRNA synthetase complex released during apoptosis[J].J Biol Chem,2007,282(15):10935-43.
[3] Schwarz R E,Awasthi N,Konduri S,et al.EMAP Ⅱ-based antiangiogenic-antiendothelial in vivo combination therapy of pancreatic cancer[J].Ann Surg Oncol,2010,17(5):1442 - 52.
[4] Chen N,Karantza V.Autophagy as a therapeutic target in cancer[J].Cancer Biol Ther,2011,11(2):157 -68.
[5] Kaza N,Kohli L,Roth K A.Autophagy in brain tumors:a new target for therapeutic intervention[J].Brain Pathol,2012,22(1):89-98.
[6] Levine B,Yuan J.Autophagy in cell death:an innocent convict[J]?J Clin Invest,2005,115(10):2679 -88.
[7] Wu W K,Wu Y C,Yu L,et al.Induction of autophagy by proteasome inhibitor is associated with proliferative arrest in colon cancer cells[J].Biochem Biophys Res Commun,2008,374(2):258-63.
[8] Karantza-Wadsworth V,White E.Role of autophagy in breast cancer[J].Autophagy,2007,3(6):610 -3.
[9] Hamed H A,Yacoub A,Park M A,et al.OSU-03012 enhances Ad.7-induced GBM cell killing via ER stress and autophagy and by decreasing expression of mitochondrial protective proteins[J].Cancer Biol Ther,2010,9(7):526 -36.
[10]虞燕霞,顾振纶,秦正红,梁中琴.自噬激活与抗肿瘤药物的作用[J].中国药理学通报,2006,22(2):137-41.
[10] Yu Y X,Gu Z L,Qin Z H,Liang Z Q.The role of autophagy in pharmacological actions of anticancer drugs[J].Chin Pharmacol Bull,2006,22(2):137 -41.
[11] Mizushima N.The pleiotropic role of autophagy:from protein metabolism to bactericide[J].Cell Death Differ,2005,12(Suppl 2):1535-41.
