中国碳青霉烯类耐药肠杆菌科细菌的流行病学和防控策略
2013-02-27徐英春北京协和医院教授研究员
徐英春 北京协和医院 教授、研究员
肖永红 浙江大学医学院附属第一医院 教授、主任医师
卓 超 广州医学院附属第一医院 教授、主任医师
郑 波 北京大学第一医院 主任医师
王 辉 北京大学人民医院 教授、研究员
杨启文 北京协和医院 助理研究员
1 背景
中国与全球各国都面临细菌耐药的挑战,各地区和各国家耐药的具体情况有所不同。亚洲属于耐药高负担的地区,积极应对细菌耐药是各国的重要任务,为此2011年世界卫生组织(WHO)提出了“遏制细菌耐药,今天不采取行动,明天就无药可用”的口号,细菌耐药已成为一个极其重要的公共卫生安全问题。
碳青霉烯类药物是治疗革兰阴性杆菌感染,特别是肠杆菌科细菌的最强效β-内酰胺类药物[1]。一旦碳青霉烯类药物耐药,临床治疗此类菌株感染将面临极大困难。目前,碳青霉烯类药物耐药的肠杆菌科菌(carbapenem-resistant Enterobacteriaceae,CRE)已在很多国家出现和报道[2-5]。我国局部地区也已报道CRE的暴发流行。
碳青霉烯类药物耐药可以由3种机制引起。第1种为产碳青霉烯酶[2,6],目前国际流行的主要有KPC、IMP、VIM、NDM酶,我国流行的主要为KPC和IMP酶。第2种耐药机制是高产AmpC头孢菌素酶或超广谱β-内酰胺酶合并孔道蛋白(Porin)缺失或表达降低导致的外膜通透性降低[4-5,7]。第3种机制为碳青霉烯药物作用位点PBP蛋白改变[8]。到目前为止,第1和第2种机制被认为是主要的耐药机制。
2 CRE的流行病学特征
2.1 国外的CRE发生率 SENTRY细菌耐药监测中心于2007-2009年从美国30个中心、欧洲10个中心和拉丁美洲43个中心收集了10 432株大肠埃希菌和5 516株克雷伯菌,发现CRE在大肠埃希菌和克雷伯菌中的发生率分别为0.3%和5.3%,其中55%的碳青霉烯耐药大肠埃希菌(CREc)和72%的碳青霉烯耐药肺炎克雷伯菌(CRKp)为产碳青霉烯酶的菌株[9]。
SENTRY 2008-2010年的拉丁美洲监测[10]显示美罗培南不敏感的克雷伯菌发生率在巴西、阿根廷、智利和墨西哥分别为11.1%、8.2%、5%和 0.8%。KPC-2型酶在CRKp中的检出率为65.9%。
美国的纽约州是CRE的高发区,1项纽约14家医院的耐药监测[11]显示纽约市2006年的肺炎克雷伯菌中KPC耐药基因的携带率为38%,而2009年为29%,远高于欧洲和亚洲平均水平。
欧洲EARSS监测网的数据[12]显示,2007年欧洲各国CRE的发生率差异较大,在肺炎克雷伯菌中,希腊和以色列的CRE发生率最高,分别为45.9%和21.9%,而欧洲其他各国的CRKp发生率均在3%以下。
2.2 我国的CRE发生率
我国CRE发生率总体水平不高且大多数CRE集中在三级医院,二级医院较少。卫生部全国细菌耐药监测网(Mohnarin)目前已覆盖全国数百家不同等级的医院。Mohnarin显示我国三级医院大肠埃希菌中CRE的发生率近4年间未明显升高,为1%~2.4%,而肺炎克雷伯菌中CRE的发生率连年上升,从2009年的3.2%升至2012年的6.0%以上,见图1。
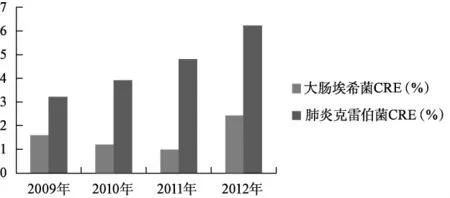
图1 Mohnarin 2009-2012年大肠埃希菌和肺炎克雷伯菌的CRE发生率
2.3 我国CRE发生率的地域差异
根据Mohnarin 2012年监测初步分析数据显示,我国三级医院大肠埃希菌中CRE的发生率为0.3%(华南地区)~7.2%(东北地区),肺炎克雷伯菌中CRE的发生率为1.0%(华南地区)~13.3%(东北地区),阴沟肠杆菌中CRE的发生率为2.4%(西南地区)~20.1%(东北地区)。有较大的地域差异。
2.4 CRE分子流行病学
KPC是近几年发现的一种新型碳青霉烯酶,blaKPC一般位于可转移的质粒上,KPC酶的水解底物包括所有类型的β-内酰胺类药物[6]。Yigit H等于2001年首先报道在美国北卡罗来纳的1株分离自1996年ICARE监测中的肺炎克雷伯菌中发现KPC-1[2]。目前该酶已在世界各地报道。在中国,魏泽庆等[13]最早报道了浙江产KPC-2的肺炎克雷伯菌,随后在浙江等地有大肠埃希菌、黏质沙雷菌产KPC-2的报道[14-15]。目前KPC-2型酶在我国的浙江、上海、江苏、湖南、北京、山东等多省市均有报道,其中长江三角洲地区报道最多。2012年杭州报道了产KPC-2的奇异变形杆菌[16]。2002-2009年上海的77株菌中84.4%产碳青霉烯酶[17]。
IMP型碳青霉烯酶属于金属酶,其能水解的底物包括青霉素类、头孢菌素类和碳青霉烯类药物,但不能水解氨曲南。质粒介导的IMP-1酶于1991年在日本的铜绿假单胞菌中首次发现[18],随后IMP型酶在世界多个国家多种菌种中被广泛检出。在中国大陆,最早由Hawkey PM等[19]于2001年报道在广州的1株杨氏枸橼酸杆菌中发现IMP-4,随后在2006年上海报道了8株来源于同一克隆的产IMP-8 like酶的弗劳地枸橼酸杆菌[20],2008年Mendes RE[21]等报道了1株武汉的产IMP-4的肺炎克雷伯菌。目前IMP型金属酶也在四川、福建、广东、山东、上海等地有报道,涉及的病原菌主要有阴沟肠杆菌、弗劳地枸橼酸杆菌和肺炎克雷伯菌等。
产NDM-1的CRE在我国报道较少,多属于散发,暂无暴发流行。2013年江西南昌报道2例碳青霉烯耐药肺炎克雷伯菌携带NDM-1基因,并且分属于两种不同的型别[22]。重庆2012年首次报道了国内第1株同时产IMP-26和NDM-1的阴沟肠杆菌[23]。香港也多次报道了产NDM-1的CRE[24]。
2.5 CRE的传播方式
CRE的传播方式主要有克隆传播和质粒传播。
CRE在世界范围内屡有暴发流行的报道,主要以肺炎克雷伯菌最为普遍。美国纽约多次报道了产KPC-2和KPC-3酶肺炎克雷伯菌的暴发流行[25-26]。
在中国的浙江等地有产KPC-2酶大肠埃希菌、黏质沙雷菌克隆传播的报道[14-15]。2011年上海[27]报道23株碳青霉烯耐药的弗劳地枸橼酸杆菌,其中15株属于相同克隆。2011年浙江报道某医院病房的产KPC-2肺炎克雷伯菌暴发流行[28]。2011年,杭州对来自5个省9个城市13家医院的95株产KPC-2碳青霉烯耐药株肺炎克雷伯菌进行了菌株亲缘性分析,发现产KPC-2的CRE肺炎克雷伯菌有很大的菌株亲缘性[29]。对于克隆传播的菌株,快速识别携带或感染CRE的病人并进行相应的隔离措施是主要的防控措施。
由于碳青霉烯酶基因多位于可接合的质粒上,因此对碳青霉烯的耐药性也可通过质粒的转移在不同菌株和不同菌种间传递。对于耐药质粒传播的防控,合理使用抗菌药物,防止耐药菌株在抗菌药物压力下的筛选是主要措施。
3 CRE感染的危险因素和临床预后
与其他多重耐药菌感染相似,以下患者属于CRE感染的易感人群:疾病危重、入住重症监护室(ICU)、长期使用抗菌药物、插管、机械通气等。
CRE感染患者临床表现与敏感菌感染没有差别。主要感染类型包括泌尿道感染、伤口感染、医院获得性肺炎、呼吸机相关肺炎、血流感染、导管相关感染等。
1项肝移植病人术后感染的研究发现175个肝移植病人有14个术后罹患CRKp感染,其中10人死亡,且有7人在感染CRKp后30天内死亡[30]。
另1项病例对照研究显示CRKp感染的病死率为50%,高于碳青霉烯敏感的肺炎克雷伯菌(CSKp)的病死率(25.7%)。中心静脉插管的长期使用是感染CRKp的独立危险因素[31]。
1项回顾性病例对照研究[32]纳入了214例CSKp菌血症和103例CRKp菌血症,显示前期大环内酯类抗生素使用以及抗菌药物暴露≥14天是获得CRKp菌血症的独立危险因素。在病死率比较上,CRKp组明显高于CSKp组。而多因素分析显示与CRKp菌血症死亡相关的独立危险因素是严重的基础疾病,而不是碳青霉烯类耐药。
4 CRE的治疗
CRE几乎对所有β-内酰胺抗菌药物耐药,同时携带有其他耐药机制,对氨基糖苷类、喹诺酮类等也耐药,对多黏菌素和替加环素具有较高体外敏感性。
4.1 治疗原则
①依据临床微生物检测结果,合理选择抗菌药物;②临床微生物室应扩大抗菌药物敏感性测定范围,包括范围更广的非β-内酰胺抗菌药物(如氨基糖苷类、氟喹诺酮类、替加环素、米诺环素、磷霉素、多黏菌素、呋喃妥因等),为临床用药提供参考;③去除感染危险因素,尽量减少对患者的侵袭性操作,及时拨出导管、脓肿引流等;④积极治疗原发疾病;⑤根据临床特征进行中医辨证治疗。
4.2 治疗方案
轻、中度感染:敏感药物单用即可,如氨基糖苷类、氟喹诺酮类、磷霉素等,也可联合用药,如氨基糖苷类联合环丙沙星或加酶抑制剂复合制剂(头孢哌酮-舒巴坦、哌拉西林-他唑巴坦)、环丙沙星联合磷霉素或加酶抑制剂复合制剂等。无效患者可以选用替加环素、多黏菌素。
重度感染:根据药物敏感性测定结果,选择敏感或中介的抗菌药物联合用药,如替加环素联合多黏菌素或磷霉素或氨基糖苷类、加酶抑制剂复合制剂联合氨基糖苷类或多黏菌素或氟喹诺酮类。应严密观察患者治疗反应,及时根据药物敏感性测定结果以及临床治疗反应调整治疗方案。
5 CRE的感染控制
5.1 加强CRE的监测
发现CRE后及时加以确认,并反馈相关科室,指导治疗与感染控制,同时按规定报告;各医疗机构应定期回顾耐药监测结果,如有CRE被遗漏,及时采取补救措施。
5.2 加强抗菌药物合理使用管理
严格执行抗菌药物合理使用的管理规定,将碳青霉烯类按照特殊使用类抗菌药物进行管理。
5.3 加强医院感染预防与控制
5.3.1 加强医务人员感染控制教育、培训,强化对CRE等多重耐药菌感染的预防、控制的认识。
5.3.2 在进行各种侵袭性操作中,严格执行无菌操作。
5.3.3 严格执行《医务人员手卫生规范》(WS/T313-2009):医疗机构必须提供充足的手卫生设施。医务人员在接触病人前后、进行侵入性操作前、接触病人使用的物品或处理其分泌物、排泄物后,必须洗手或用含醇类速干手消毒剂擦手。
5.3.4 加强对重点部门尤其是ICU物体表面的清洁、消毒。对医务人员和病人频繁接触的物体表面,如生命监护仪、微量输液泵、呼吸机等医疗器械的面板或旋钮表面、计算机键盘和鼠标、电话机、病人床栏杆和床头桌等,采用适宜的消毒剂,每天必须仔细擦拭、消毒,疑似或确认有CRE感染或带菌者,所处病室需增加消毒次数。
5.3.5 隔离确诊CRE感染或定植者,预防耐药菌传播。在标准预防的基础上,采用接触隔离的方法,将病人安置单独房间,接触患者时需要穿隔离衣、戴手套,相关医疗器械或物品如听诊器、血压计等专用,不能专用的物品,需用后严格消毒。隔离期间需要定期检测耐药菌情况。
5.4 正确认识细菌耐药与传染病的区别
细菌耐药与传染病不同,传染病是由各种致病菌导致的严重特殊感染,具有流行规律和流行特征,如特殊病原菌、易感人群、特定传播途径等,引起传染病的细菌都属于致病菌,如结核菌、伤寒沙门菌、志贺菌、百日咳杆菌等;细菌耐药是细菌产生对抗菌药物的抵抗能力,细菌获得耐药性一般不改变自身的致病能力,现阶段耐药菌感染主要在医院内流行,对住院患者构成严重威胁;防控耐药菌主要目的在于减少住院患者感染病死率、预防耐药菌向社区扩散。
耐药菌的防控有其自身特点,不应该像启动传染病应急反应一样,针对单一病原体进行处理。传染病的发病是单一病原,具有明确传播途径,采取隔离、消毒、疫苗接种等防控效果非常明显。耐药菌控制不能采用这种方式,细菌耐药的发生是多因素造成的,与临床不合理使用抗生素等有关。各种耐药菌可在医院内共存,而CRE只是其中的一种。如果只针对某一种耐药菌采取措施则达不到控制目的,必须作为一个整体来管理。把CRE这种耐药菌当成传染病来防控,与科学的耐药管理与防控方法是格格不入的。
耐药的处理要从整体、全局出发,例如医生的手部卫生、抗菌药物的合理使用等方面着手,使耐药得到整体控制。遇到特殊情况,对患者采取隔离等感染控制措施是必要的。
按照WHO推荐,细菌耐药控制主要有以下几个方面:政府重视,适当管理与立法;开展监测与实验室能力建设;专业人员与民众的教育;科学研究新型感染治疗技术与药物;药品良好供应体系与基本药物;临床合理使用抗菌药物。其中临床合理使用抗菌药物最为重要。
6 我国已经采取的耐药控制措施
整体来讲,我国政府按照国际推崇原则,已经开展了系统的耐药控制策略,并不断深入,包括对CRE的控制,现在所采取的应对耐药的措施是正确、科学、合理的。卫生部在细菌耐药控制方面采取了一系列积极措施,包括建立Mohnarin、卫生部抗菌药物应用监测网和抗菌药物专项治理活动,提倡合理用药,颁布《抗菌药物临床应用管理办法》,最终目的就是降低耐药,这是全面减少细菌耐药的正确方式,也是WHO所推荐的。
6.1 十余年来,我国卫生主管部门针对细菌耐药采取的行动包括:2004年,颁布实施了《抗菌药物临床应用指导原则》;2005年,建立了Mohnarin和抗菌药物临床应用监测网;2009年卫生部制定了《多重耐药菌医院感染预防与控制技术指南(试行)》;2010年卫生部组织专家制定了《产NDM-1泛耐药肠杆菌科细菌感染诊疗指南(试行版)》,已有了防控预案。
6.2 近年来,在卫生部的统一部署下,全国基层医疗机构广泛开展了合理使用抗菌药物的培训,例如星火计划、萌芽计划等。
2012年,卫生部颁布制定了《抗菌药物临床应用管理办法》,是抗菌药物合理使用、耐药控制的里程碑式事件。
6.3 2011年起开展的抗菌药物专项整治活动取得了积极成效。
6.4 Mohnarin也采取了相应的行动。在监测方案中已经明确要求:出现特殊情况例如出现CRE时,“各参加单位首先需自行复核实验结果,若确为此结果,立即通过E-mail或电话报告分中心,并由分中心决定是否送菌。如需送菌,请按菌种运送要求尽快找快递公司将菌株送交中心,同时保留菌株直至收到分中心的反馈信息。各分中心确认后,一方面将确认情况反馈参加单位,另一方面,需上报卫生部合理用药专家委员会,由耐药监测网学术委员会讨论后提出具体措施和意见。”
7 需要进一步开展的工作
7.1 建议开展细菌耐药对整个社会经济和医疗体系影响的评估。包括对人员、经济、健康的影响等。可以在卫生部合理用药专家委员会指导下,由Mohnarin成员单位参与进行评估,提出我国耐药危机的科学评估报告,供政府决策。
7.2 在医院感染控制中,对一些高度耐药的菌株和一些重要的抗菌药物,需加强对医院的管理,包括抗菌药物的使用、医院感染的控制等。
7.3 建议国家投入专项资金,开展控制“超级耐药菌”的科学技术研究,指导医疗机构快速诊断、正确治疗、合理防控。同时,将这类细菌的基础及临床研究与新药开发紧密结合起来。
7.4 建议国家加强耐药监测的建设工作,使现有被动监测向更加主动、快速的监测发展。
7.5 进一步加强抗菌药物合理使用的管理工作,使之成为可持续发展的医疗质量管理工作。
8 系统意见
8.1 细菌耐药是全球面临的公共卫生问题与挑战,随着经济的发展、国际间交流的增加,我国应积极应对,在国际舞台发挥应有的作用。
8.2 我国大肠埃希菌中CRE的发生率近4年间未明显升高,为1%~2.4%,而肺炎克雷伯菌中CRE的发生率连年上升,从2009年的3.2%升至2012年的6.2%。大多数CRE集中在三级医院,二级医院较少。CRE发生率有地域差异。国家应该设专项耐药菌监测资金、关注CRE等中国重要耐药菌临床流行趋势。
8.3 我国CRE的耐药机制主要为产碳青霉烯酶,包括KPC和IMP酶等。CRE的传播方式主要有克隆传播和质粒传播。应该密切监测、防止大规模传播。
8.4 CRE感染的病死率较高。CRE对临床常用的抗菌药物广泛耐药,治疗选择较少。应该投入资金针对重要耐药菌的危险因素及治疗方案进行研究、以降低耐药菌发病率、改善患者预后。
8.5 耐药菌感染与传染病流行本质不同,具有自身的防控要求。耐药的处理要从整体、全局出发,涉及抗菌药物合理使用、病原菌检测、耐药菌监测、病人管理、医院感染管理等各方面,整体配合才能使耐药得到控制。
8.6 CRE是耐药细菌的一类,需要统一纳入到耐药控制体系中,不能单一应对。
8.7 我国已经采取一系列符合国际要求并充分结合我国实际情况的耐药控制措施。但目前政府投入仍然捉襟见肘,应加大资金投入,保证耐药控制工作的持续性,为我国经济建设保驾护航。
(杨启文 执笔)
[1]Rahal JJ.The role of carbapenems in initial therapy for serious Gram-negative infections[J].Crit Care,2008,12(S4):5.
[2]Yigit H,Queenan AM,Anderson GJ,et al.Novel carbapenem-hydrolyzing beta-lactamase,KPC-1,from a carbapenem-resistant strain of K lebsiella pneumoniae[J].Antimicrob Agents Chemother,2001,45(4):1151-1161.
[3]Vatopoulos A.High rates of metallo-beta-lactamase-producing K lebsiella pneumoniae in Greece--a review of the current evidence[J].Euro Surveill,2008,13(4),pii:8023.
[4]Oteo J,Delgado-Iribarren A,Vega D,et al.Emergence of im ipenem resistance in clinical Escherichia coli during therapy[J].Int J Antim icrob Agents,2008,32(6):534-537.
[5]Kaczmarek FM,Dib-Hajj F,Shang W,et al.High-level carbapenem resistance in a K lebsiella pneumoniae clinical isolate is due to the combination of bla(ACT-1)beta-lactamase production,porin OmpK35/36 insertional inactivation,and down-regulation of the phosphate transport porin phoe[J].Antim icrob Agents Chemother,2006,50(10):3396-3406.
[6]Queenan AM,Bush K.Carbapenemases:the versatile beta-lactamases[J].Clin M icrobiol Rev,2007,20(3):440-458.
[7]Yigit H,Anderson GJ,Biddle JW,et al.Carbapenem resistance in a clinical isolate of Enterobacter aerogenes is associated w ith decreased expression of OmpF and OmpC porin analogs[J].Antim icrob Agents Chemother,2002,46(12):3817-3822.
[8]Villar HE,Danel F,Livermore DM.Permeability to carbapenems of Proteusm irabilismutants selected for resistance to im ipenem or other beta-lactams[J].JAntimicrob Chemother,1997,40(3):365-370.
[9]Castanheira M,Mendes RE,Woosley LN,et al.Trends in carbapenemase-producing Escherichia coli and Klebsiella spp.from Europe and the Americas:report from the SENTRYantimicrobial surveillance programme(2007-09)[J].JAntim icrob Chemother,2011,66(6):1409-1411.
[10]Gales AC,Castanheira M,Jones RN,et al.Antim icrobial resistance among Gram-negative bacilli isolated from Latin America:results from SENTRY Antimicrobial Surveillance Program(Latin America,2008-2010)[J].Diagn M icrobiol Infect Dis,2012,73(4):354-360.
[11]Landman D,Babu E,Shah N,et al.Transm ission of carbapenem-resistant pathogens in New York City hospitals:progress and frustration[J].JAntim icrob Chemother,2012,67(6):1427-1431.
[12]Souli M,Galani I,Giamarellou H.Emergence of extensively drug-resistantand pandrug-resistantGram-negative bacilli in Europe[J].Euro Surveill,2008,13(47),pii:19045.
[13]Wei ZQ,Du XX,Yu YS,et al.Plasm id-mediated KPC-2 in a K lebsiella pneumoniae isolate from China[J].Antim icrob A-gents Chemother,2007,51(2):763-765.
[14]Zhang R,Zhou HW,Cai JC,et al.Plasmid-mediated carbapenem-hydrolysing beta-lactamase KPC-2 in carbapenem-resistant Serratiamarcescens isolates from Hangzhou,China[J].JAntim icrob Chemother,2007,59(3):574-576.
[15]Cai JC,Zhou HW,Zhang R,et al.Emergence of Serratia marcescens,Klebsiella pneumoniae,and Escherichia coli Isolates possessing the plasm id-mediated carbapenem-hydrolyzing beta-lactamase KPC-2 in intensive care units of a Chinese hospital[J].Antimicrob Agents Chemother,2008,52(6):2014-2018.
[16]Hu YY,Cai JC,Zhang R,et al.Emergence of Proteusm irabilis harboring blaKPC-2 and qnrD in a Chinese Hospital[J].Antim icrob Agents Chemother,2012,56(5):2278-2282.
[17]Hu F,Chen S,Xu X,et al.Emergence of carbapenem-resistant clinical Enterobacteriaceae isolates from a teaching hospital in Shanghai,China[J].JMed M icrobiol,2012,61(Pt1):132-136.
[18]Watanabe M,Iyobe S,Inoue M,etal.Transferable im ipenem resistance in Pseudomonas aeruginosa.Antim icrob[J].Agents Chemother,1991,35(1):147-151.
[19]Hawkey PM,Xiong J,Ye H,et al.Occurrence of a new metallo-β-lactamase IMP-4 carried on a conjugative plasm id in Citrobacter youngae from the People’s Republic of China[J]. FEMSM icrobiol Lett,2001,194(1):53-57.
[20] 骆俊,朱德妹,徐晓刚,等.泛耐药弗劳地枸橼酸杆菌产β内酰胺酶及同源性[J].中华传染病杂志,2006,24(5):291-295.
[21]Mendes RE,Bell JM,Turnidge JD,et al.Carbapenem-resistant isolates of Klebsiella pneumoniae in China and detection of a conjugative plasm id(blaKPC-2 plus qnrB4)and a blaIMP-4 gene[J].Antim icrob Agents Chemother,2008,52(2):798-799.
[22]Hu L,Zhong Q,Tu J,et al.Emergence of blaNDM-1 among Klebsiella pneumoniae ST15 and novel ST1031 clinical isolates in China[J].Diagn M icrobiol Infect Dis,2013,pii:S0732-8893(13)00011-4.doi:10.1016/j.diagm icrobio.2013.01.006.
[23]DaiW,Sun S,Yang P,etal.Characterization of carbapenemases,extended spectrumβ-lactamases andmolecular epidem iology ofcarbapenem-non-susceptible Enterobacter cloacae in a Chinese hospital in Chongqing[J].InfectGenet Evol,2013(14):1-7.
[24]Tsang KY,Luk S,Lo JY,et al.Hong Kong experiences the‘Ultimate superbug’:NDM-1 Enterobacteriaceae[J].Hong Kong Med J,2012,18(5):439-441.
[25]Bratu S,Landman D,Haag R,et al.Rapid spread of carbapenem-resistant Klebsiella pneumoniae in New York City:a new threatto ourantibiotic armamentarium[J].Arch Intern Med,2005,165(12):1430-1435.
[26]Bratu S,Landman D,Alam M,etal.Detection of KPC carbapenem-hydrolyzing enzymes in Enterobacter spp.From Brooklyn,New York.Antim icrob[J].Antim icrob Agents Chemother,2005,49(2):776-778.
[27]Chen S,Hu F,Liu Y,et al.Detection and spread of carbapenem-resistant Citrobacter freundii in a teaching hospital in China [J].Am JInfect Control,2011,39(9):e55-60.
[28]Zhang R,Wang XD,Cai JC,et al.Outbreak of K lebsiella pneumoniae carbapenemase 2-producing K.pneumoniae w ith high qnr prevalence in a Chinese hospital[J].JMed M icrobiol,2011,60(Pt7):977-982.
[29]Qi Y,Wei Z,Ji S,et al.ST11,the dom inant clone of KPC-producing Klebsiellapneumoniae in China[J].JAntimicrob Chemother,2011,66(2):307-312.
[30]Kalpoe JS,Sonnenberg E,Factor SH,et al.Mortality associated with carbapenem-resistant K lebsiellapneumoniae infections in liver transplant recipients[J].Liver Transpl,2012,18(4):468-474.
[31]Correa L,Martino MD,Siqueira I,etal.A hospital-basedmatched case-control study to identify clinical outcome and risk factors associated w ith carbapenem-resistantKlebsiella pneumoniae infection[J].BMC InfectDis,2013(13):80.
[32]Hussein K,Raz-Pasteur A,Finkelstein R,et al.Impact of carbapenem resistance on the outcome of patients'hospital-acquired bacteraem ia caused by K lebsiella pneumoniae[J].JHosp Infect,2013,83(4):307-313.
