不同脂肪酸组成的食用油热氧化稳定性研究
2013-02-22徐婷婷阚丽娇范亚苇郑天闻邓泽元
徐婷婷,李 静,阚丽娇,范亚苇,郑天闻,邓泽元,2,*
(1.南昌大学食品科学与技术国家重点实验室,江西南昌330047;2.南昌大学高等研究院,江西南昌330047)
油脂的氧化稳定性对其感官和营养品质极其重要,氢过氧化物的降解,一级氧化产物和诸如醛酮类的二级氧化产物等都会影响油脂的口感、风味和色泽,降低油脂的营养品质,从而影响人体健康[1]。在高温加热过程中,食用油脂会发生一系列复杂的化学反应,产生许多有害人体健康的物质。
植物油的热氧化稳定性主要取决于加热的温度、植物油的脂肪酸组成和它本身所含的抗氧化剂,抗氧化剂主要包括维生素E、植物甾醇及其他一些未皂化成分[2]。由于油脂的氧化速率与脂肪酸的不饱和脂肪酸总量、双键位置等有关,不同脂肪酸结构的植物油的氧化稳定性也各有差异[3]。油脂氧化检测方法可分为感官检验,化学方法和物理方法。油脂氧化过程通常包括初级氧化阶段和次级氧化阶段,不同阶段测定的指标不同,因此综合几种油脂测量指标更能准确反映油脂的氧化程度[4]。中国传统的烹饪方法中,通常将油温加热至150~180℃,且很少文献研究对比多种不同脂肪酸组成的食用油的热氧化稳定性。故本实验选取三种不同特征的具有代表性的食用油,即富含饱和脂肪酸的棕榈油、富含多不饱和脂肪酸的花生油以及富含单不饱和脂肪酸的山茶油,于170℃高温加热,从酸价、碘值、过氧化值、p-茴香胺值、全氧化值、维生素E含量及脂肪酸组成的变化等综合角度,研究食用油在加热过程中的氧化稳定性,以期从本质上探讨高温加热对不同脂肪酸组成的食用油氧化稳定性的影响。
1 材料与方法
1.1 材料与仪器
山茶油、压榨一级花生油、18度棕榈油 均未加人工抗氧化剂,购于江西绿源实业有限公司;正己烷、甲醇 色谱纯;甲醇钠、乙酸甲酯、草酸、乙醇、乙酸、异辛烷、p-茴香胺、韦氏试剂、硫代硫酸钠、碘化钾、氢氧化钾、酚酞试剂、淀粉 分析纯;脂肪酸甲酯标准品GLC-463+C21∶0+CLA 购于美国NuChekPrep公司。
Anke TDL-5-A型飞鸽牌台式离心机 上海安亭科学仪器厂;电子天平 上海精科天平厂;友田牌多功能油炸锅 上海容声电子有限公司;722G可见分光光度计 上海精科;6890N型气相色谱仪[配备CP-Sil88熔融石英毛细管柱(100mm×0.25mm)]、Agilent 1100高效液相色谱仪 美国Agilent公司。
1.2 实验方法
1.2.1 加热油样的制备 (170±2)℃的温度下,分别连续加热棕榈油、花生油、山茶油,每加热5m in记为加热一次,加热5次后取一组油样,取样量为50m L。每天共加热25次,取5组油样。初始油量为2L,不添加新油,按相同的方法反复加热3d,共加热75次,取油样15组,将油样密封,-20℃冷冻保存。
1.2.2 理化指标的测定
1.2.2.1 酸价的测定 参考GB/T 5530-2005/ISO 660:1996《动植物油脂酸值和酸度测定》。
1.2.2.2 碘值的测定 参考GB/T 5532-2008/ISO 3961∶1996,MOD《动植物油脂碘值的测定》。
1.2.2.3 过氧化值的测定 参考GB/T 5538-2005/ ISO 3960:2001《动植物油脂过氧化值测定》。
1.2.2.4 p-茴香胺值和全氧化值的测定 参考GB/T 24304-2009/ISO 6885:2006,IDT《动植物油脂茴香胺值的测定》。
1.2.3 维生素E的测定 采用反相高效液相色谱法测定[5],色谱柱:Hypersil ODS2-C18(5μm,4.6μm×150mm)流动相:甲醇∶水=98∶2,流速:0.8m L/min,进样量:3μL,柱温:室温,荧光检测波长:λexc=295nm,λem= 325nm,检测时间:10m in。
1.2.4 脂肪酸的甲基化 分别取2mg左右油脂,加入1.5m L正己烷[6],涡流30s,加入40μL乙酸甲酯和100μL甲醇钠-甲醇溶液,涡流30s,于37℃水浴锅中振荡反应20min,然后于-20℃冰箱中冷冻10min,取出后迅速加入60μL草酸,离心取上清液300μL,氮气吹干后加入1m L正己烷,涡流后进行气相色谱分析,每组油样同时做3个平行样。
1.2.5 气相色谱分析 色谱柱采用CP-Sil88熔融石英毛细管柱[7];载气为H2,燃烧气为N2、H2和空气;进样口温度250℃,压力24.52psi,总流量29.4m L/m in;气相色谱柱柱压24.52psi,柱内流速1.8m L/m in;炉温为程序升温:45℃时保持4min,然后以13℃/min的升温速率将温度升至175℃,保持此温度27m in,再以4℃/m in的升温速率将温度升至215℃,保持35m in,总测定时间为86m in;检测器温度250℃,氢气流速30.0m L/m in;空气流速300m L/m in;氮气流速30.0m L/min。通过与脂肪酸甲酯标准对照,采用面积归一化法确定脂肪酸的相对含量(以峰面积的百分数表示)。
2 结果与分析
2.1 加热过程中酸价的变化
由图1可知,随着加热次数的增加,三种植物油的酸价均呈上升趋势:在整个加热过程中,三种植物油的酸价均未超出食用植物油煎炸过程中的卫生标准(酸价≤5mg KOH/g),且棕榈油的酸价最小,变化程度也较小,由0.12mg KOH/g上升至0.39mg KOH/g;花生油的酸价最高,未加热前酸价为0.73mg KOH/g,最后升高至1.04mg KOH/g;山茶油的酸价由0.17mg KOH/g上升至0.55mg KOH/g,棕榈油、花生油、山茶油分别在加热5、20、15次后其酸价与未加热油具有显著性差异(p<0.05),棕榈油的酸价变化最快。但三种植物油的酸价增加量基本一样,酸价反映了加热过程中发生水解反应产生游离脂肪酸的多少,实验结果说明三种食用油在加热过程中产生新的游离脂肪酸量基本一致。
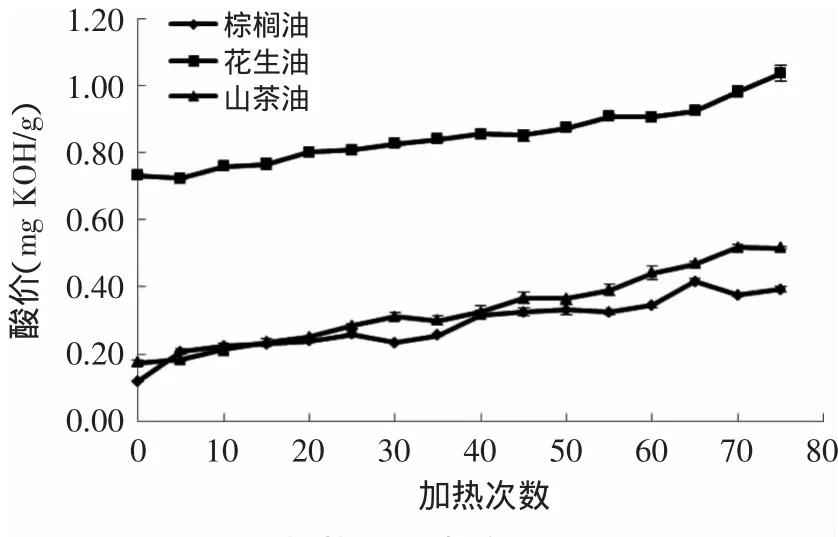
图1 加热过程中酸价的变化Fig.1 Changes in acid value during heating process
2.2 加热过程中碘值的变化
由图2可知,花生油的碘值在三种食用油中最高,棕榈油则最低。随着加热次数的增加,三种食用油的碘值呈下降趋势,棕榈油、花生油和山茶油碘值的下降量分别是7.12、21.32和8.31g/100g。且三种食用油加热处理与未加热处理的碘值均存在显著性差异(p<0.05),故加热对食用油的碘值影响很大。高温加热过程中,油脂之间会发生一系列的热聚合、热氧化过程,不饱和脂肪酸逐渐氧化成饱和脂肪酸,因此碘值降低。
碘值的大小反映了油脂的不饱和程度,碘值越高代表该油脂的不饱和脂肪酸含量越多,多不饱和脂肪酸的含量与碘值大小呈正相关。表1中列出了三种食用油的脂肪酸组成变化,花生油的不饱和脂肪酸含量最高,棕榈油含量最小,故花生油的碘值最大,棕榈油的碘值最小。
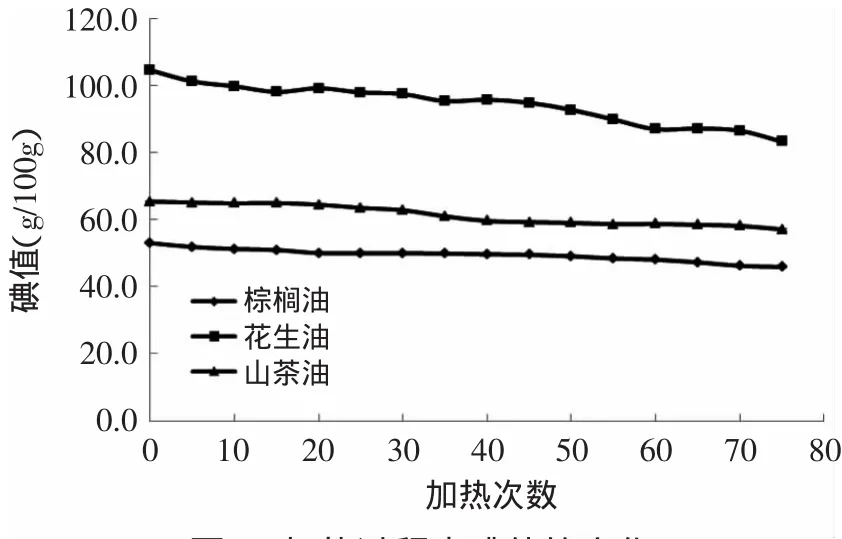
图2 加热过程中碘值的变化Fig.2 Changes in iodine value during heating process
2.3 加热过程中过氧化值的变化
由图3可知,随着加热次数的增加,三种植物油的过氧化值总体呈上升趋势,但均未超过国际食品法典委员会制定的过氧化值标准20meq/kg:在整个加热过程中,山茶油过氧化值的变化程度最高,从初始的4.65meq/kg逐渐上升到10.05meq/kg,花生油的过氧化值变化趋势最缓慢。棕榈油、花生油、山茶油分别在加热35、10、20次以后,其过氧化值与未加热油具有显著性差异(p<0.05)。过氧化值主要用来衡量油脂在氧化过程生成的初级产物氢过氧化物的含量的多少[8-9],结果说明山茶油在加热过程中发生水解、氧化、聚合等一系列反应,生成了较多的氢过氧化物,初级氧化产物比较多。

图3 加热过程中过氧化值的变化Fig.3 Changes in peroxide value during heating process
2.4 加热过程中p-茴香胺值的变化
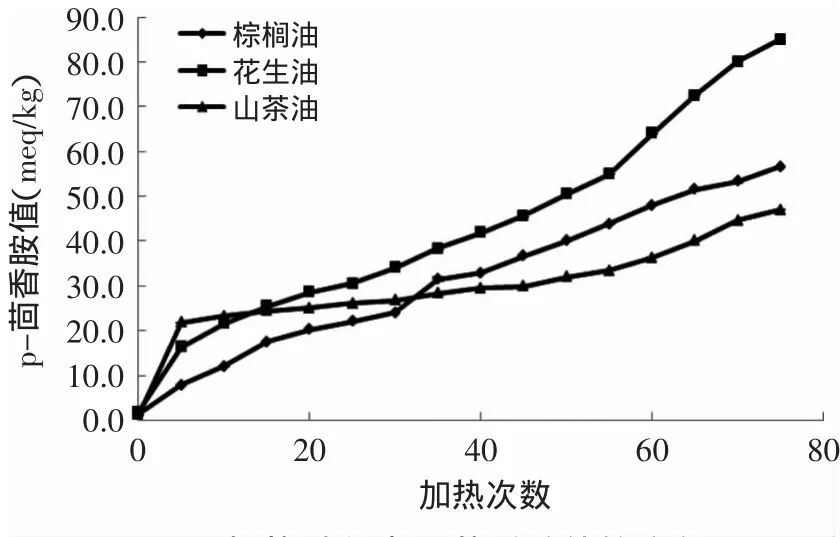
图4 加热过程中p-茴香胺值的变化Fig.4 Changes in p-anisidine value during heating process

表1 加热过程中脂肪酸组成的变化Table1 Changes in fatty acids composition during heating process
由图4可知,未加热前的三种食用油的p-茴香胺值均接近于0,但经过加热处理后急剧增高,加热油与未加热油的p-茴香胺值均有显著性差异(p<0.05),说明加热后会产生大量的烯醛类物质,且花生油中不饱和脂肪酸含量最高,油脂最易被氧化,生成的烯醛类二级氧化产物最多,故花生油的p-茴香胺值最高,达到了85.05。在加热次数低于30次时,山茶油的p-茴香胺值比棕榈油高,但超过30次后棕榈油的p-茴香胺值比山茶油高,棕榈油在加热次数为35次后与未加热处理的过氧化值存在显著性差异,表明棕榈油开始大部分进入次级氧化阶段,故后期其p-茴香胺值比山茶油高。
2.5 加热过程中全氧化值的变化
食用油在加热过程中,不饱和脂肪酸氧化分解产生烯醛类化合物,p-茴香胺值是衡量食用油脂中醛类物质的含量的指标,即表明二级氧化产物的多少,全氧化值可以更全面地反映油脂氧化酸败的程度,目前国际上公认用2倍的过氧化值与1倍的p-茴香胺值之和来表征全氧化值[10]。

图5 加热过程中全氧化值的变化Fig.5 Changes in total oxidation value during heating process
由图5可知,三种食用油的全氧化值在起始时基本相等,随着加热次数的增加,全氧化值不断升高,三种加热油与未加热油的全氧化值均有显著性差异(p<0.05),表明加热处理使三种食用油的氧化程度都发生了显著改变。山茶油的全氧化值在三种食用油中升高的程度最低,达到67.12,棕榈油和花生油则分别达到76.61、103.10,这说明在连续3d的加热过程中,山茶油总体的酸败程度最低。
2.6 加热过程中维生素E含量的变化
维生素E是一种脂溶性维生素,许多植物油中富含维生素E,它具有抗氧化功能。由表2可知,未加热前花生油的总维生素E含量最高且三种食用油中均未检测出β-VE。在整个加热过程中,三种油中的α-VE降低程度最快,γ-VE、δ-VE的降低速率相对较慢,说明α-VE的氧化稳定性相对于γ-VE、δ-VE较低,在加热过程中损失最快,其他两种维生素E的变化则相对较慢。三种食用油经加热处理后,其VE含量与未加热油的VE含量均有显著性差异(p<0.05)。在加热过程中,维生素E主要起抗氧化作用,尽量保护食用油不被氧化,故食用油中的维生素E含量锐减。
2.7 加热过程中脂肪酸组成的变化
由表1可知,三种油的饱和脂肪酸的百分比含量均呈上升趋势,多不饱和脂肪酸的百分比含量则呈下降趋势。棕榈油和山茶油的单不饱和脂肪酸含量分别由42.77%、76.82%降低至40.84%、76.69%,而花生油则由39.50%升高至40.29%。由于花生油中含有大量的多不饱和脂肪酸,而多不饱和脂肪酸易受高温影响,发生裂变、聚合等反应。在连续三天的高温油炸过程中,花生油中的部分多不饱和脂肪酸氧化生成单不饱和脂肪酸和饱和脂肪酸,从而导致加热后花生油中单不饱和脂肪酸和饱和脂肪酸的百分比含量增加。

表2 加热过程中维生素E含量的变化Table2 Changes in tocopherol contents during heating process
随着加热时间的不断增加,棕榈油的各种脂肪酸均与未加热的食用油的脂肪酸存在显著性差异(p<0.05);花生油的单不饱和脂肪酸、多不饱和脂肪酸和反式脂肪酸则分别在加热次数为75、45、60次时与未加热的花生油的脂肪酸存在显著性差异(p< 0.05);山茶油的饱和脂肪酸、多不饱和脂肪酸、反式脂肪酸也先后有显著性差异(p<0.05)。这说明在加热过程中,三种食用油的脂肪酸组成变化均比较大。此外,每种食用油的脂肪酸组成和抗氧化剂的不同都会导致其在加热过程中反式脂肪酸的生成量不同[11-12]。在本研究中,棕榈油、花生油和山茶油中反式脂肪酸的增加量分别是0.19、1.53和0.33,花生油的反式脂肪酸的增加量最大。
3 讨论
加热过程中,食用油的多不饱和脂肪酸含量降低,因此碘值下降。花生油的p-茴香胺值高于棕榈油和山茶油,但过氧化值低于棕榈油和山茶油,说明花生油氧化过程中生成了较多的二级氧化产物,而棕榈油和山茶油则大部分处于初级氧化阶段,与鲍丹青的研究结果一致[13]。本文还发现,加热次数超过35次后,山茶油的p-茴香胺值和全氧化值比棕榈油低,过氧化值比棕榈油高。表明,在加热前期,维生素E起主要的抗氧化作用,当维生素E含量降低到一定程度后,脂肪酸组成对食用油的热氧化稳定性起主要作用。
目前国际上公认使用全氧化值来衡量食用油的氧化稳定性,则三种食用油的氧化稳定性依次为:山茶油>棕榈油>花生油。Calculated oxidizability(COX,[1(18∶1%+10.3(18∶2%)+21.6(18∶3%)]/100)[14]可反映不同脂肪酸组成食用油的氧化稳定性。新鲜棕榈油、花生油和山茶油的COX值依次为1.615、4.631和1.772,三种油的COX值大小依次为花生油>山茶油>棕榈油,而维生素E含量高低依次是花生油>山茶油>棕榈油,山茶油维生素E含量是棕榈油的2倍。从三种油的氧化稳定性差异说明:食用油氧化稳定性主要由其脂肪酸的组成(COX值)决定,当COX值相近时维生素E含量影响其氧化稳定性,这值得进一步深入研究。
4 结论
研究结果表明,在加热过程中,食用油的酸价、过氧化值、茴香胺值、全氧化值均呈上升趋势,碘值均下降,且山茶油的变化程度最小,花生油的变化程度最大,即富含单不饱和脂肪酸的山茶油的热氧化稳定性最高,富含饱和脂肪酸的棕榈油次之,富含多不饱和脂肪酸的花生油最低。同时,维生素E也是决定食用油的热氧化稳定性的一个重要因素,花生油的总维生素E含量下降量最大,降低了429.3mg/kg,维生素E含量的急剧减少也会影响食用油的品质。因此,应尽量避免使用富含多不饱和脂肪酸的食用油长时间煎炸食品。
[1]Verardo V,Ferioli F,Riciputi Y,et al.Evaluation of lipid oxidation in spaghetti pasta enriched with long chain n-3 polyunsaturated fatty acids under different storage conditions[J].Food Chemistry,2009,114(2):472-477.
[2]Afaf Kamal-Eldin.Effect of fatty acids and tocopherols on the oxidative stability ofvegetable oils[J].Eur JLipid SciTechnol,2006,58:1051-1061.
[3]曹文明,王鑫,包杰,等.油脂氧化评价研究进展[J].粮食与油脂,2013,26(4):1-5.
[4]曹君,李红艳,邓泽元.植物油氧化稳定性的研究进展[J].食品工业科技,2013(7):378-386.
[5]唐亮,胡蒋宁,刘蓉,等.几种植物油抗氧化物质的测定[J].中国食品学报,2012,12(8):210-214.
[6]邓泽元,范亚苇.不同饲养类型鸡蛋中脂类的含量测定[J].食品科学,2004,25(9):140-144.
[7]Cruz H C,Deng Z Y,Zhou JQ,et al.Methods for analysis of conjugated linoleic acids and trans-18∶1 isomersin dairy fats by using a combination of gas chromatography,silverionthin-layer chromatography/gas chromatography,and silver-ion liquid Chromatography[J].AOAC Int,2004,87(2):545-562.
[8]李红艳,邓泽元,李静,等.不同脂肪酸组成的植物油氧化稳定性的研究[J].食品工业科技,2010,31(1):173-182.
[9]龚东平,韩小军,陈国平,等.DHA油脂在精炼过程中氧化稳定性的变化[J].食品工业科技,2013,34(1):85-88.
[10]Casal S,Malheiro R,Sendas A,et al.Olive oil stability under deep-frying conditions[J].Food and Chemical Toxicology,2010(48):2972-2979.
[11]TsuzukiW,Matsuoka A,Ushida K.Formation of trans fatty acids in edible oils during the frying and heating process[J].Food Chemistry,2010,123:976-982.
[12]杨滢,陈奕,张志芳,等.油炸过程中三种植物油脂肪酸组分含量及品质的变化[J].食品科学,2012,33(23):36-41.
[13]鲍丹青,毕艳英,王梦华,等.植物油在储存过程中氧化情况的研究[J].中国油脂,2009,34(9):38-43.
[14]RossiM,Alamprese C,Ratti S.Tocopherols and tocotrienols as free radical-scavengers in refined vegetable oils and their stability during deep-fat frying[J].Food Chemistry,2007(102):812-817.
