一株产脂肪酶芽孢杆菌的鉴定及其脂肪酶基因LIP的克隆分析
2013-02-22刘生峰肖进文周蓓莉聂福平李应国
刘生峰,肖进文,周蓓莉,杨 俊,聂福平,王 昱,周 庆,李应国
(1.重庆出入境检验检疫局,重庆400020; 2.重庆市进出口食品安全工程研究中心,重庆400020; 3.西南大学,重庆400715)
脂肪酶(Lipase,EC3.1.1.3,甘油酯水解酶)是指催化酯酰甘油水解的一类酶的总称,是一类特殊的酯键水解酶,其天然底物是长链脂肪酸酯,既可以在两相系统(油、水界面)中起作用,也可以在水相中起作用。脂肪酶作为生物催化剂可催化由不同底物出发的水解和合成反应,且反应不需要辅酶,反应条件温和,副产物少。因此,脂肪酶的应用十分广泛,如食品工业、医药卫生、化学化工、环境保护、能源开发等领域。微生物来源的脂肪酶具备广泛的pH、温度范围以及底物专一性,是工业用脂肪酶研究的热点。地衣芽孢杆菌(B.licheniform is)是一种革兰氏阳性腐生性微生物,在自然界分布非常广泛,生理特性丰富多样,它可产生多种活性物质,包括脂肽类、肽类、磷脂类、多烯类、氨基酸类和核酸类物质。地衣芽孢杆菌具有耐热、酶系丰富、产酶量更高和安全等诸多优良特性,被认为是较理想的工业生产菌株[1],与枯草芽孢杆菌相比,地衣芽孢杆菌生长温度高5~7℃,地衣芽孢杆菌所分泌的酶系成为工业酶制剂的重要来源,其模式菌株的基因组序列也于2004年公布[2-3]。近年来,国内外对于地衣芽孢杆菌应用的报道日益增多,尤其在医药、饲料加工、农药等行业地衣芽孢杆菌已得到广泛的应用。地衣芽孢杆菌的功能基因,如纤维素酶[4]、β-甘露聚糖酶[5]、葡聚糖酶[6-7]、蛋白酶[8-10]、α淀粉酶[11-13]、亮氨酸脱氢酶[14]、碱性果胶酶[15]、植酸酶[16]、γ-聚谷氨酸降解酶[17]等都得到了克隆表达。本研究对实验室分离的一株芽孢杆菌进行初步鉴定并对其脂肪酶基因LIP进行克隆和序列分析,为进一步构建工程菌奠定基础。
1 材料与方法
1.1 材料与仪器
芽孢杆菌菌株BL03 由本实验室分离保藏;大肠杆菌(Escherichia coli)JM109 由本实验室保藏;质粒载体pMD19-T、PCR扩增试剂、胶回收试剂盒和载体连接试剂盒 宝生物工程(大连)有限公司;营养琼脂培养基、芽孢染色试剂和革兰氏染色试剂 北京陆桥技术有限责任公司;LB培养基 英国OXOID公司;芽孢杆菌生化鉴定卡 生物梅里埃公司;DNA提取试剂盒和质粒提取试剂盒 天根生化科技(北京)有限公司;引物 生工生物工程(上海)股份有限公司合成。
BX51型荧光正置相差显微镜日本OLYMPUS公司;全自动微生物鉴定/药敏分析系统-VITEK 32生物梅里埃公司;Mycycler核酸扩增仪和电泳仪美国Bio-Rad公司;200E型凝胶成像系统 美国SIM公司;IPP500型低温培养箱 德国MEMMERT公司。
1.2 实验方法
1.2.1 菌株鉴定 将菌株在营养琼脂平板上划线,37℃培养,观察菌落形态,革兰氏染色后镜检,观察其菌体形态。生理生化鉴定参照《伯杰细菌鉴定手册》[18],用全自动微生物鉴定/药敏分析系统-VITEK 32对菌株进行鉴定[19]。
1.2.2 LIP基因的PCR扩增 用细菌核酸提取试剂盒提取菌株BL03的基因组,用做PCR扩增的模板。根据GenBank中报道的B.licheniform is(ATCC 14580)菌株脂肪酶基因序列,应用Primer Prem ier 6.0软件设计一对引物,为了便于亚克隆,在上下游引物的两端分别设计一个EcoRI和NotI酶切位点,并在5'端加入保护性碱基。上游引物:5'-GGAATTC GTGCGTCGTCATTCATTT-3';下游引物:5'-TAGCGGCCGCAATCTTATTTCCC-3'。
LIP基因的体外扩增PCR反应总体积25μL:10 ×Buffer 2.5μL,10mmol/L dNTP 0.5μL,上、下游引物各0.5μL,地衣芽孢杆菌 DNA 1μL,DNA Taq酶0.5μL,25mmol/L MgCl22μL,ddH2O 17.5μL;反应条件:94℃预变性处理4m in;94℃变性30s,60℃退火30s;72℃延伸30s,30个循环;72℃延伸3min。1.5%琼脂糖胶电泳鉴定结果。
1.2.3 LIP基因的克隆 用DNA回收试剂盒切胶回收纯化PCR产物,目的片段与pMD19-T载体4℃连接过夜。连接产物转化入E.coli JM109感受态细胞,并涂布于铺有IPTG和X-gal的LB平板上,37℃倒置过夜。经蓝白斑筛选,挑选白色菌落用LB液体增菌培养,小量抽提质粒,以质粒为模板,PCR扩增鉴定。
1.2.4 LIP基因测序及分析 LIP基因序列测定由上海Invitrogen公司进行。测序结果经DNASTAR 7.10软件分析并与GenBank已发表的基因进行核酸序列比对。
2 结果与分析
2.1 菌株鉴定
2.1.1 菌体形态及菌落形态 在营养琼脂平板上,培养初期菌落上积累较多黏液,牢固地附着在培养基上,培养后期呈裂叶状,边缘毛发状(见图1),培养3d后菌落呈褶皱垒起的山丘状。在液体培养基中静止培养形成白色菌膜,能兼性厌氧生长。该菌革兰氏染色为阳性(见图2),菌体为杆状,菌株在生长过程中产生芽孢,可判定为芽孢杆菌。孢囊无膨大,无伴孢晶体,能运动。
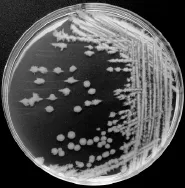
图1 菌株BL03在营养琼脂上的菌落形态Fig.1 Colonymorphology of strain BL03 on nutrient agar plate
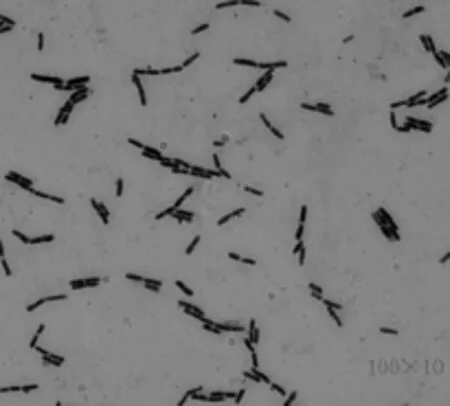
图2 显微镜下菌株BL03菌体形态Fig.2 Morphlogy of strain BL03 undermicroscope
2.1.2 生理生化鉴定结果 用全自动微生物鉴定/药敏分析系统-VITEK 32对菌株BL03进行鉴定,主要生理生化鉴定结果见表1,参照《伯杰细菌鉴定手册》及仪器分析结果,初步鉴定为地衣芽孢杆菌(Bacillus licheniform is)。
2.2 基因的PCR扩增
以Bacillus licheniformis染色体DNA为模板,按前述方法对其脂肪酶基因进行PCR扩增,成功扩增出一条大小约625bp的DNA片段(图3),结果与预期大小相符。
2.3 重组质粒的PCR鉴定
扩增培养白色菌落,小量抽提质粒后进行PCR扩增并电泳鉴定。结果显示得到了大约625bp的DNA片段(图4),表明LIP/pMD19-T克隆体系构建成功。
2.4 序列测定及分析
测序结果表明LIP基因的开放阅读框为615bp,编码204个氨基酸。用DNAStar软件预测氨基酸序列的分子质量、等电点,结果如下:LIP分子质量单位为21791.8u,理论等电点为9.32,碱性氨基酸残基(Arg+Lys)百分比为8.3%,酸性氨基酸残基(Asp+Glu)百分比为5.9%。包含有编码脂肪酶的蛋白活性中心“G-x-S-x-x-G”的核酸序列,菌株BL03的脂肪酶基因核酸序列和推导氨基酸序列如图5。

表1 BL03菌株主要生理生化特征Table1 Themajor physiological and biochemical characteristics of strain BL03
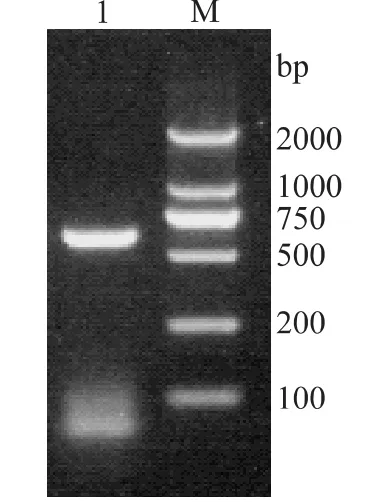
图3 LIP基因的PCR扩增产物电泳图Fig.3 Electrophoretogram analysis of LIP gene PCR product
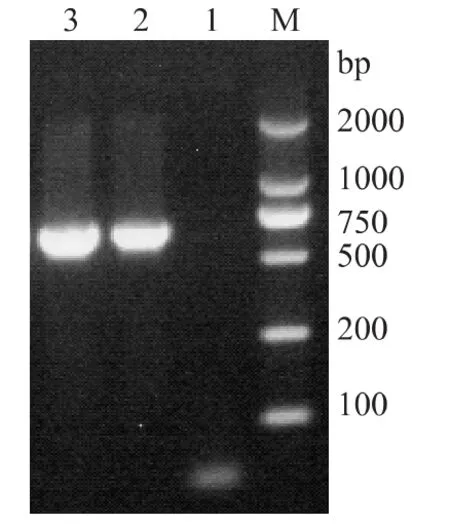
图4 重组质粒的PCR鉴定Fig.4 PCR identification of recombinant plasmids
菌株BL03的LIP基因与地衣芽孢杆菌ATCC 14580株LIP基因(GeneID:3098655)对比,核酸序列相似性达99.67%,推导理论氨基酸序列相似性为99.02%。与解淀粉芽孢杆菌(B.amyloliquefaciens FZB42G)的 LIP基因的核酸序列相似性仅为67.97%,推导理论氨基酸序列相似性为65.7%。与萎缩芽孢杆菌(B.atrophaeus)、解淀粉芽孢杆菌(B.amyloliquefaciens)和短小芽孢杆菌(B.pum ilus)的基因序列进化树分析如图6。
3 结论

图5 菌株BL03的脂肪酶基因核酸序列和推导氨基酸序列Fig.5 LIP gene sequence and putative amino acid sequence of BL03 strain

图6 几株芽孢杆菌的脂肪酶基因序列进化树分析图Fig.6 phylogenetic tree of lipase gene sequence analysis from some Bacillus
从自然界筛选出的天然菌株产酶能力一般不高,而通过基因重组技术将天然菌株中的目标基因克隆并构建工程菌株,实现较高的产酶能力,是获得工业微生物菌种的重要途径。天然菌株的分离鉴定及目标基因的克隆是构建基因工程菌株的基础,自2004年公布地衣芽孢杆菌模式菌株(ATCC 14580)的基因组序列以来,对于地衣芽孢杆菌基因的研究有较多的报道,然而对于地衣芽孢杆菌基因的认识还比较有限,其基因的克隆也有限。因此从地衣芽孢杆菌中克隆出功能基因,开发出稳定性好、活力强、产量高的工程菌株,为工业化生产奠定坚实基础,具有十分重要的实用价值。本研究对实验室分离的一株芽孢杆菌从形态和生理生化特征初步鉴定为,地衣芽孢杆菌,根据在GenBank已经发表的地衣芽孢杆菌LIP基因序列设计引物,PCR体外扩增该片段,测序表明,获取了LIP基因完整的开放阅读框,该段序列与已发布的地衣芽孢杆菌脂肪酶基因(GeneID:3098655)相比,核酸序列相似为99.67%,仅有2个碱基的差异。为了便于定向亚克隆,在该基因上下游引物上分别设计了EcoRI和NotI酶切位点,LIP基因的获取为后续研究该基因功能、工程菌株构建奠定了基础。
[1]唐娟,张毅,李雷雷,等.地衣芽孢杆菌应用研究进展[J].湖北农业科学,2008,47(3):351-354.
[2]Veith B,Herzberg C,Steekel S,et al.The complete genome sequence of Bacillus licheniformis DSM13,an organism with great industrial potential[J].JMol Microbiol Biotechnol,2004,7(4): 204-211.
[3]Rey MW,Ramaiya P,Nelson BA,et al.Complete genome sequence of the industrial bacterium Bacillus licheniformis and comparisons with closely related Bacillus species[J].Genome Biol,2004,5(10):R77.1-R77.12.
[4]Liu Y,Zhang J,Liu Q,et al.Molecular cloning of novel cellulase genes cel9A and cel12A from Bacillus licheniformis GXN151 and synergism of their encoded polypeptides[J].Curr Microbiol,2004,49(4):234-238.
[5]张清霞,黄姗姗,童蕴慧,等.地衣芽孢杆菌W10β-甘露聚糖酶基因的克隆与表达[J].扬州大学学报:农业与生命科学版,2010,31(4):77-81.
[6]吕文平,许梓荣,杜文理,等.地衣芽孢杆菌β-1,3-1,4葡聚糖酶基因的克隆和表达[J].农业生物技术学报,2004,12 (4):446-449.
[7]山其木格,包慧芳,王炜,等.地衣芽孢杆菌WS-6β-葡聚糖酶基因的克隆及表达[J].生物技术通报,2008(6): 135-138.
[8] Tang XM,Lakay FM,Shen W.Purification and characterisation of an alkaline protease used in tannery industryfrom Bacillus licheniformis[J].Biotechnol Lett,2004,26(18): 1421-1424.
[9]何小丹,李霜.地衣芽孢杆菌YP1A耐有机溶剂蛋白酶基因的克隆与功能表达[J].生物加工过程,2009,7(6):67-73.
[10]新疆农业科学院微生物应用研究所.一种耐高温金属蛋白酶基因工程菌及其获得方法:中国,CN 101117623 B[P].2011-01-12.
[11]Kim IC,Cha JH,Kim JR,et al.Catalytic properties of the cloned amylase from Bacillus licheniformis[J].JBiol Chem,1992,267(31):22108-22114.
[12]牛丹丹,徐敏.地衣芽孢杆菌α-淀粉酶基因的克隆和及其启动子功能鉴定[J].微生物学报,2006,46(4):576-580.
[13]蔡恒,陈忠军.地衣芽孢杆菌耐高温α-淀粉酶基因在大肠杆菌中的克隆及表达[J].食品与发酵工业,2004,30(12): 15-18.
[14]Nagata S,Bakthavatsalam S,Galkin AG,et al.Gene cloning,purification,and characterization of thermostable and halophilic leucine dehydrogenase from a halophilic thermophile,Bacillus licheniformis TSN9[J].Appl Microbiol Biotechnol,1995,44 (3-4):432-438.
[15]俞玲,沈微,牛丹丹,等.地衣芽孢杆菌碱性果胶酶基因pelB的克隆与鉴定[J].食品工业科技,2009,30(10):170-173.
[16]张江.地衣芽孢杆菌植酸酶基因的克隆及其在大肠杆菌中的表达[J].湖北大学学报:自然科学版,2004,26(4): 337-340.
[17]王计伟,施庆珊,欧阳友生,等.地衣芽胞杆菌ATCC9945A中γ-聚谷氨酸降解酶基因的克隆、表达及降解性能鉴定[J].生物技术,2012,22(1):13-18.
[18]布坎南RE,吉本斯NE.伯杰细菌鉴定手册[M].第八版.北京:科学出版社,1984:729-737.
[19]孙燕萍,彭浩,凌霞,等.VITEK2Compact全自动微生物分析系统的应用及鉴定结果分析[J].现代预防医学,2010,37 (20):3891-3893.
