马尾松松针总黄酮纯化工艺的研究
2013-02-22邱佳妹周爱存
邱佳妹,周爱存
(浙江农林大学,浙江杭州311300)
马尾松松针为松科(Pinaceae)松属(Pinus)马尾松(Pinusmassoniana Lamb.)的针叶,别名猪鬃松毛、松毛、山松须,广泛分布于江苏、浙江、安徽、河南及长江中下游各省山地。松针用药历史悠久,最早记载于《名医别录》上品卷一“松叶,其味苦温,主治风湿痹气,生毛发,安五脏,守中,不饥,延年。”现代研究表明,松针具有镇痛、抗炎、镇咳、祛痰、抗突变、降血脂、降血压、抑菌等作用,并广泛应用于治疗风湿病、心脑血管疾病、糖尿病、肥胖病等症[1-3]。近年来,国内外学者对松针的化学成分进行了深入研究,从中分离得到多种黄酮及其苷类[4]、木脂素类[5-8]等。有研究表明,松针中黄酮具有抗肿瘤、抗氧化、降血脂等多种生理功能[9-10]。当前,有关松针的研究主要集中在提取工艺以及粗提物药理活性等方面[11-13],而关于松针中总黄酮的纯化工艺未见有报道。本研究旨在寻找具有一定选择性、吸附容量大且易于解吸附的树脂,为分离纯化松针总黄酮,充分开发利用松针资源提供依据。
1 材料与方法
1.1 材料与仪器
马尾松松针 2011年8月采自浙江湖州和孚镇,40℃下烘干,剪成1~1.5cm小段装袋备用;芦丁对照品 中国食品药品检定研究院;Amberlite XAD-7HP树脂 美国罗门哈斯公司;AB-8、HPD-600、HPD-200A树脂 沧州宝恩化工有限公司;DM130树脂 杭州争光树脂有限公司;Diaion HP-20树脂日本三菱公司;聚酰胺(30~60目) 华东医药股份有限公司;乙醇、盐酸、氢氧化钠、亚硝酸钠、硝酸铝 华东医药股份有限公司,均为分析纯。
玻璃层析柱(Φ25×500mm) 华东医药股份有限公司;UV-2100紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;RE-52A旋转蒸发器 上海亚荣生化仪器厂;数显恒温水浴锅 嘉兴市中新医疗仪器有限公司;SHZ-95型循环水多用真空泵 河南予华仪器厂;FA2004A电子天平(万分之一) 河南兄弟仪器公司;101-A型电热恒温干燥箱 天津泰斯特仪器有限公司。
1.2 实验方法
1.2.1 树脂的预处理 实验用7种树脂先用95%乙醇浸泡24h,使之充分溶胀,倾去乙醇以及漂浮物后湿法装柱,用95%的乙醇以2BV/h的流速通过树脂层,洗至流出液加等体积的水不变白色浑浊为止;用蒸馏水以同样流速洗尽乙醇,然后用2BV的5%盐酸溶液以4~6BV/h流速通过树脂层,并浸泡2~4h,而后用水以同样流速洗至出水pH中性;再用2BV的4%氢氧化钠溶液以4~6BV/h的流速通过树脂层,并浸泡2~4h,最后用水以同样流速洗至出水pH中性。将预处理后的树脂过滤并用滤纸吸干表面水分,于室温(25℃)下放置24h,即得干树脂。
1.2.2 松针黄酮提取液的制备 称取松针50.0g置于圆底烧瓶中,以70%乙醇为提取剂,调节提取溶剂pH至10,回流提取2次,每次1h,料液比分别为1∶10、1∶8,过滤,合并两次提取液,于4℃冰箱中静置12h。减压抽滤静置后的松针提取液,用旋转蒸发仪70℃下减压回收乙醇至无醇味,用蒸馏水定容至500m L,并用浓HCl调pH3,即为实验用TFPMNs提取液。
1.2.3 总黄酮含量测定 精密称取干燥恒重的芦丁对照品12.8mg,加蒸馏水溶解并定容至100m L的量瓶中,摇匀得质量浓度0.128g/L的对照品溶液。分别精密量取上述芦丁对照品溶液0、1.0、2.0、3.0、4.0、5.0、6.0m L于25m L容量瓶中,各用蒸馏水补充至6.0m L,分别加入5%亚硝酸钠溶液1.0m L,摇匀,放置6m in后再各加入10%硝酸铝1.0m L,摇匀。6m in后再加入1mol/L的氢氧化钠溶液10m L,用蒸馏水稀释至刻度,摇匀静置。10min后于510nm处测吸光度,试剂为空白参比,以吸光度为横坐标,芦丁质量浓度为纵坐标绘制标准曲线,用最小二乘法进行线性回归,得芦丁质量浓度与吸光度之间的回归方程:C= 0.0819A+0.0008,R2=0.9995,式中A为吸光度,C为总黄酮浓度(mg/m L)。
液体样品的测定:先把液体样品定容至适当体积,过滤,弃去初滤液,精密量取续滤液1.0m L,置于10m L容量瓶中,加蒸馏水至刻度,摇匀。再从中取3.0m L于25m L容量瓶中,依次加入5%亚硝酸钠、10%硝酸铝、1mol/L的氢氧化钠,再用蒸馏水定容至刻度,测定吸光度,代入回归方程计算总黄酮浓度;固体样品的测定:精密称取样品粉末30mg,用蒸馏水定容在50m L容量瓶中,再从中取3.0m L于25m L容量瓶中,按上述方法操作,测定吸光度,计算总黄酮浓度,按式(1)计算固体中总黄酮纯度。
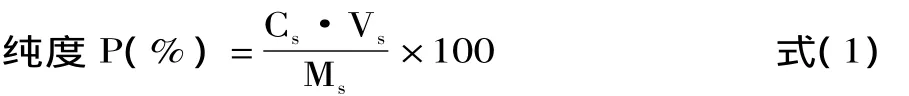
式中:P为固体中总黄酮纯度(%);Cs为液体中黄酮的浓度(mg/m L);Vs为液体体积(m L);Ms为固体的质量。
1.2.4 静态吸附实验
1.2.4.1 树脂饱和吸附量的测定 准确称取经预处理的6种干树脂、聚酰胺各2.0g于具塞磨口三角瓶中,精密加入松针总黄酮提取液20.0m L,密封后室温下振荡(180 r/m in)12h至吸附平衡,吸取上层液体测定总黄酮浓度。实验平行进行三次,取三次实验数据的平均值,并按式2、式3计算饱和吸附量Q和吸附率A:

式中:Q为吸附量(mg/g干树脂);C0为吸附前溶液浓度(mg/m L);Cr为吸附后溶液浓度(mg/m L); V为溶液体积(m L);W为干树脂重量(g)。
1.2.4.2 脱附率的测定 将上述吸附饱和后的树脂过滤,吸干树脂表面的水分,精密加入80%乙醇10m L,室温振荡(180 r/m in)12h,使其达到饱和脱附,滤过后滤液定容,测此时溶液中总黄酮的浓度。实验平行进行三次,取三次实验数据的平均值,按照式4、式5计算脱附率和回收率:
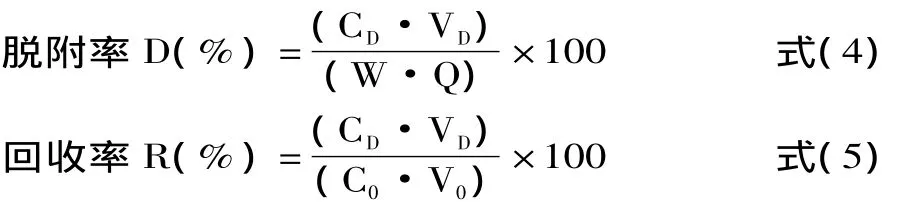
式中:D为脱附率,R为回收率,CD为脱附液浓度(mg/m L),C0为样品中总黄酮浓度(mg/m L),VD为脱附液体积(m L),V0为样品提取液的体积(m L),W为干树脂重量(g),Q为吸附量(mg/g干树脂)。
1.2.4.3 上柱液浓度的选择 准确称取静态实验所筛选的干树脂2.0g于具塞磨口三角瓶中,精密加入一定体积的不同浓度的松针总黄酮提取液,其余操作同1.2.4.1。实验平行进行三次,取三次实验数据的平均值,比较提取液浓度对树脂吸附性能的影响。
1.2.4.4 上柱液pH的选择 准确称取静态实验所筛选的干树脂2.0g于具塞磨口三角瓶中,精密加入不同 pH的松针总黄酮提取液20m L,其余操作同1.2.4.1。实验平行进行三次,取三次实验数据的平均值,比较提取液pH对树脂吸附性能的影响。
1.2.5 动态吸附与脱附实验 称取静态实验所筛选的干树脂100mg,经预处理后湿法装入Φ25×500mm的层析柱中,用蒸馏水洗涤平衡。将TFPMNs提取液稀释并将pH调至最佳范围,得上柱液的总黄酮质量浓度为1.1mg/m L。然后以不同流速上样,分段收集上样流出液,通过测定流出液中总黄酮含量考察上柱液流速等因素对树脂吸附性能的影响,确定最佳吸附工艺条件。
对已吸附样品的树脂进行脱附实验,用2BV蒸馏水洗至流出液澄清,用不同浓度的乙醇以一定流速洗脱,收集洗脱液,通过测定流出液中总黄酮含量考察乙醇的浓度、流速等因素对树脂脱附性能的影响,确定最佳脱附工艺条件。
2 结果与分析
2.1 各树脂的静态吸附实验结果
2.1.1 树脂的初步筛选结果 7种树脂对松针总黄酮提取液的吸附-脱附性能实验结果见表1。由表1可以看出,Amberlite XAD-7HP和聚酰胺对松针总黄酮的静态饱和吸附量均较高,可以达到44.0mg/g以上,可以用于松针总黄酮的吸附。但是,两种树脂的脱附率差别较大,Amberlite XAD-7HP树脂的脱附率为83.7%,明显高于聚酰胺的脱附率28.1%,表现出最佳的综合性能。因而,优选Amberlite XAD-7HP分离纯化TFPMNs。

表1 7种树脂对TFPMNs静态吸附与解吸性能(n=3)Table1 Static adsorption and desorption properties of7 resins for TFPMNs(n=3)
2.1.2 浓度对树脂吸附性能的影响 总黄酮样品液的浓度对树脂Amberlite XAD-7HP吸附性能的影响结果如表2所示。由表2可知,当松针总黄酮质量浓度在1.36~10.84mg/m L区间内,随着黄酮浓度的增加,树脂对黄酮的饱和吸附量增大,但是当浓度达到21.68mg/m L时,树脂的饱和吸附量不增反而微降,可能与溶液浓度过高,粘度过大,影响吸附有关。综合考虑,选取10.8mg/m L的黄酮提取液作为最适宜上柱液。
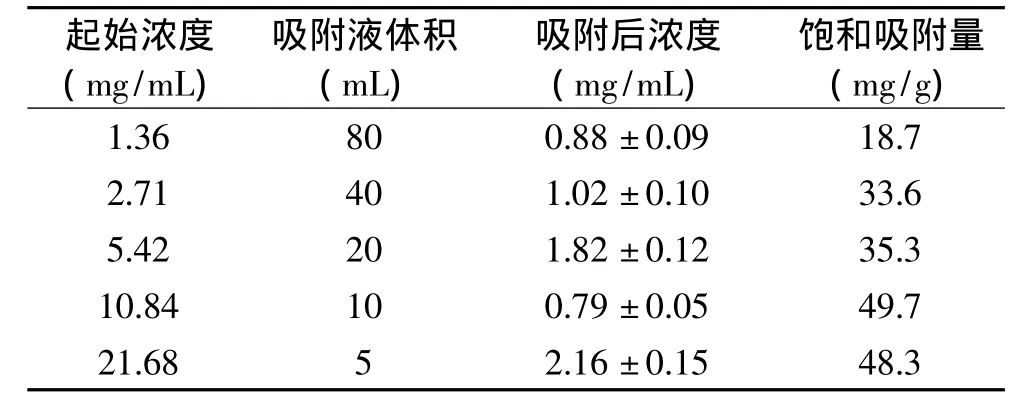
表2 浓度对XAD-7HP树脂吸附性能的影响(n=3)Table2 Effect of sample concentration on adsorption property of Resin XAD-7HP(n=3)
2.1.3 上柱液pH对树脂吸附性能的影响 上样液的pH对树脂Amberlite XAD-7HP吸附性能的影响结果如表3所示。由表3可知,随着松针总黄酮提取液pH的提高,树脂对总黄酮的饱和吸附量明显下降。这主要是由于随着pH的增大,浸提液中的总黄酮以盐的形式存在而不易被树脂所吸附,因此应尽可能的调低pH。但是,考虑到提取液的pH太低,容易造成黄酮苷类成分水解,故本实验选取上柱液的pH为3.0为宜。
2.2 大孔树脂对松针总黄酮动态吸附与脱附实验结果
2.2.1 上样流速对树脂动态吸附性能的影响 在同一实验条件下考察不同上样流速对树脂动态吸附性能的影响,结果如图1所示。
由图1得知,上样流速为1~2BV/h时,随着上样流速的增大,吸附量变化不大,而当流速在2~4BV/h时,树脂吸附量随着流速的增大下降显著。这可能是由于流速过快,被吸附物质分子尚未扩散到树脂的内表面就已泄露。1BV/h时吸附量虽然略高于2BV/h的吸附量,但考虑到1BV/h的上样速率太慢,上样耗时太长,故本实验选用2BV/h的流速进行动态吸附。经实验得知,一次处理松针总黄酮提取液的体积可达4BV。
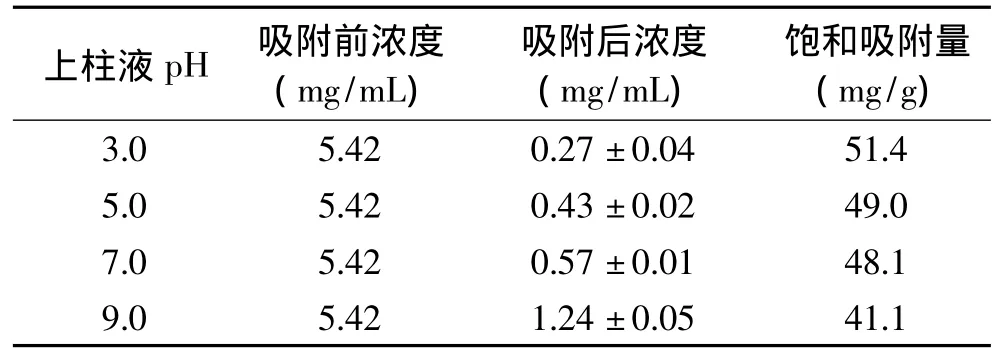
表3 pH对树脂吸附性能的影响(n=3)Table3 Effect of pH value on adsorption property of Resin XAD-7HP(n=3)
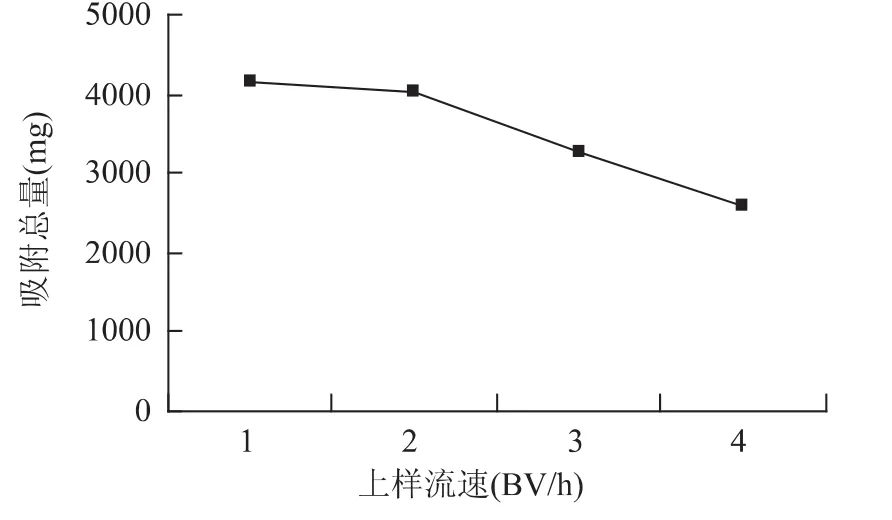
图1 上样流速对树脂动态吸附性能的影响Fig.1 Effect of flow rate on adsorption property of Resin XAD-7HP
2.2.2 洗脱液浓度对脱附性能的影响 在同一实验条件下考察不同浓度的乙醇洗脱液对树脂动态解吸附性能的影响,结果如图2所示。
由图2得知,总黄酮脱附率随着乙醇浓度的增大而增大,80%的乙醇的脱附率可达94.08%,95%乙醇的脱附率为94.69%,两者相差不大,因此选择80%的乙醇作为松针总黄酮的脱附剂。
2.2.3 洗脱液流速对脱附性能的影响 在同一实验条件下考察洗脱液的不同流速对树脂动态解吸附性能的影响,结果如图3所示。
从图3可以看出,脱附剂流速越快,脱附性能越差,达到基本脱附完全所需的脱附剂也就越多。从节省脱附剂的角度考虑应尽可能采用低流速洗脱。但洗脱流速太慢,又会使工作周期延长,因此,综合考虑各因素,选择1BV/h的洗脱流速为宜。本实验用2BV的80%乙醇以1BV/h的流速洗脱,脱附率可达93%以上。
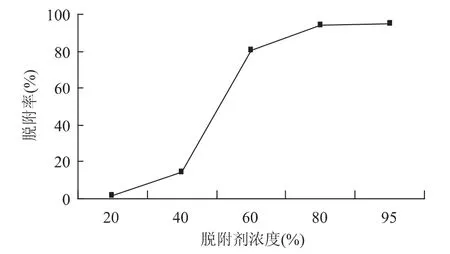
图2 洗脱液浓度对脱附性能的影响Fig.2 Effect of ethanol aqueous solution concentration on desorption propertyof Resin XAD-7HP
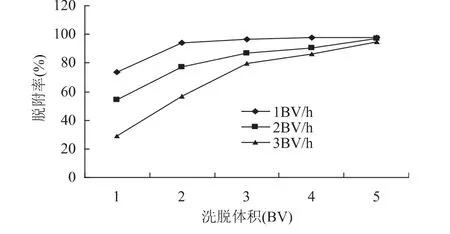
图3 洗脱液流速对脱附性能的影响Fig.3 Effect of eluent flow rate on desorption property of Resin XAD-7HP
2.3 工艺验证
量取上述马尾松松针提取液适量,按上述优化后的吸附条件和解析条件平行进行三次重复性实验,精制后的总黄酮液体经减压浓缩,50℃烘箱中烘干后可得棕黄色的黄酮粉末。以总黄酮回收率及粉末中总黄酮纯度为指标,考察工艺的稳定性。结果表明,粉末中总黄酮的纯度提高到65.9%±1.3%,总黄酮回收率可以达80.2%±2.6%,工艺具有良好的稳定性。
3 结论与讨论
大孔吸附树脂是一类新型高分子聚合物,在分离化学成分时具有稳定性高、不受无机物存在的影响、再生简便、环保节省费用等优点,广泛地应用于单味中药或复方中有效部位群以及单体成分的富集纯化中。近年来不断有文献[14-15]报道大孔吸附树脂在分离纯化黄酮类成分的过程中显示出卓越的性能。本文选取6种不同性质(包括非极性、弱极性、中极性以及极性)的大孔吸附树脂作为备选树脂用于TFPMNs的分离纯化。此外,亦有文献[16]报道聚酰胺分离具有酚羟基的黄酮类成分也收到了良好的效果,因此本文也将聚酰胺列为备选树脂之一进行筛选。以吸附率和解析率为指标,静态吸附实验的结果表明,Amberlite XAD-7HP对于TFPMNs具有良好的吸附和解析性能,可用于松针总黄酮的分离纯化。聚酰胺对TFPMNs虽然也具有较大的吸附容量,但是由于解析率低而予以舍弃。
在本实验范围内,Amberlite XAD-7HP在室温条件下分离纯化TFPMNs的最佳工艺参数为:上柱液总黄酮浓度为11mg/m L左右,上柱液pH3,上柱速度2BV/h,溶液处理量4BV/次;脱附剂为80%乙醇,脱附剂的流速 1BV/h,脱附剂用量 2BV。Amberlite XAD-7HP在该条件下对TFPMNs进行纯化,总黄酮纯度达65.9%±1.3%,总黄酮回收率可达80.2%± 2.6%,显示出良好的分离纯化性能,且工艺稳定性良好,具有潜在的工业应用前景。
本文研究的TFPMNs的纯化工艺可为开发利用马尾松松针的资源,提高松针产品附加值提供参考依据。此外,更高纯度的TFPMNs的分离纯化工艺尚需进一步的研究。
[1]杨鑫,邱建伟,张华,等.松属植物化学成分及生物活性的研究进展[J].中药材,2007,30(7):878-883.
[2]赵桂芝,寿旦,俞忠明,等.松针提取物的药理学研究进展[J].现代医院,2010,10(10):14-16.
[3]Kim YS,Shin DH.Volatile components and antibacterial effects of pine needle(Pinus densiflora S.and Z.)extracts[J].Food Microbiology,2005,22(1):37-45.
[4]Shen ZB,Theander O.Flavonoid glycosides from needles of Pinus Massoniana[J].Phytochemistry,1985,24(1):155-158.
[5]毕跃峰,郑晓珂,刘宏民,等.马尾松松针化学成分的研究[J].药学学报,2001,36(11):832-835.
[6]毕跃峰,郑晓珂,冯卫生,等.马尾松松针中木脂素苷的分离与结构鉴定[J].药学学报,2002,37(8):626-629.
[7]冯卫生,王彦志,郑晓珂,等.马尾松松针中化学成分的分离与结构鉴定[J].药学学报,2004,39(3):190-193.
[8]李萍,刘纬琦,万德光.四川不同产地马尾松针叶挥发油成分的气质谱分析[J].成都中医药大学学报,2002,25(2): 20-22.
[9]胡钧,吕圭源,李万里.马尾松松针降血脂作用的研究[J].浙江中医学院学报,1992,16(3):30-3l.
[10]张培刚,郑鸿雁,昌友权,等.松针黄酮的体外抗氧化作用研究[J].食品科学,2005,26(9):506-508.
[11]徐丽珊,张萍华,张瑜.松针总黄酮的提取工艺优化研究[J].浙江师范大学学报,2009,32(2):207-211.
[12]谢济运,蓝峻峰.减压内部汽化法提取马尾松松针中总黄酮的研究[J].安徽农业科学,2010,38(12):6213-6215.
[13]潘炘,陈顺伟,庄晓伟.不同提取方式马尾松松针抗氧化能力研究[J].食品工业科技,2009,30(8):108-110.
[14]程文明,张明,李俊,等.大孔树脂纯化野菊花总黄酮的工艺研究[J].中成药,2011,33(9):1508-1513.
[15]许亮,师俊玲,陈志娜,等.大孔树脂分离纯化宁夏枸杞总黄酮的研究[J].离子交换与吸附,2011,27(3):202-211.
[16]卫强,戴一,吴燕,等.聚酰胺-大孔树脂联用纯化菊叶总黄酮初步研究[J].中药材,2011,34(8):1285-1288.
