不同浸提方式下HPLC测定苹果渣中cAMP的研究
2013-02-21冉仁森刘永峰郭玉蓉牛鹏飞
冉仁森,刘永峰,郭玉蓉,牛鹏飞
(陕西师范大学食品工程与营养科学学院,陕西西安710062)
环腺苷酸(cyclic adenosine-3’,5’-monophosphate,cAMP)由三磷酸腺苷(Adenosine triphosphate,ATP)在腺苷活化酶催化下生成的生物活性物质[1]。cAMP普遍存在于动植物体内,可以激活依赖性蛋白激酶A磷酸化多种蛋白底物,调节cAMP反应元件结合蛋白活性,调控脂类的生物合成,促进脂肪酸β-氧化,调控基因转录,发挥其广泛的生物学功能[2-3]。因此,研究动植物中提取cAMP,对于开发功能性食品具有重大的意义。上世纪70年代国外开始高等植物中cAMP的研究[4-5],80年代后对于枣中的cAMP已开展了较多的研究[6-9],发现枣成熟果肉中环核苷酸含量达10~300nmol/g。但是,对于苹果及其果渣中cAMP的研究鲜有报道,仅有刘孟军等[10]采用放射免疫法在研究14种园艺植物cAMP含量时,对苹果鲜果进行了cAMP的测定。
众所周知,我国是世界上第一大苹果种植国和生产国,苹果产量为3000多万吨,其中大约有20%的苹果用于生产加工成浓缩果汁、苹果酒、果酱等产品,苹果经生产加工后将产生大量的苹果渣,约占苹果总重量的25%,然而大量的苹果渣除较少数用作饲料和燃料外,绝大部分被废弃[11-13]。苹果渣中的多种活性物质对于苹果渣资源的开发利用具有积极的意义。因此,本文针对苹果渣中的活性物质cAMP开展提取和检测,首次利用水浸提与乙醇浸提两种不同提取方式对苹果渣中cAMP进行提取,并采用高效液相色谱法(High Performance Liquid Chromatography,HPLC)对苹果渣中cAMP的含量进行测定,以期为苹果渣资源的综合开发利用提供参考依据。
1 材料与方法
1.1 材料与仪器
皇冠苹果的肉渣 去皮,去籽,干燥、粉碎,过80目筛得到;cAMP标准品 规格:CAS号为60-92-4,纯度≥99%,色谱纯,德国Sigma公司;甲醇 规格:纯度为99.8%,色谱纯,加拿大Promptar公司;乙醇、磷酸二氢钾 分析纯。
高效液相色谱仪 美国Waters公司;色谱柱 美国Agilent公司;TU-2000型紫外可见分光光度计日本日立公司;旋转蒸发仪 上海亚荣生化仪器厂。
1.2 实验方法
1.2.1 样品中cAMP的提取 设计两种不同的浸提方法制备样品溶液:利用蒸馏水浸提制备样品溶液,按1∶20(g/m L)的料液比加入蒸馏水,混合均匀,于40℃水浴环境下提取24h,每隔8h搅拌一次,提取完成后,将提取液于(50±5)℃、0.096MPa的条件下真空浓缩并定容至50m L,冷却至室温后放入冰箱保存;利用乙醇浸提制备样品溶液,按1∶20(g/m L)的料液比加入20%乙醇溶液,于40℃水浴环境下提取24h,每隔8h搅拌一次,提取完成后,将提取液于(50±5)℃、0.096MPa的条件下真空浓缩并定容至50m L,冷却至室温后放入冰箱保存。
1.2.2 标准品溶液的制备 精密称取cAMP标准品0.0143g,用双蒸水溶解并用容量瓶定容至250m L,摇匀得57.2μg/m L的储备液,放入冰箱保存备用,保存时间为1d。
1.2.3 色谱条件的选择
1.2.3.1 流动相的选择 参考张倩等[14]的方法,进行流动相的选择。本研究色谱柱为Agilent HCC18,5μm,4.6mm×250mm,流动相采用甲醇-含0.05moL/L磷酸二氢钾的双蒸水(体积比10∶90),流速1.0m L/m in,检测室温度为室温,进样量为20μL。
1.2.3.2 检测波长的选择 取上述cAMP标准品溶液,稀释1倍,对其进行紫外全波长扫描,根据最大吸收率,确定其检测波长。
1.2.4 cAMP的定性检测 本研究采用保留时间法[15],在相同的色谱条件下,以待测物质的保留时间与标准品保留时间相比对,相同的物质应具有一致的保留时间,进行所要分析组分的定性。
1.2.5 cAMP的定量检测
1.2.5.1 标准曲线绘制 分别精密吸取体积为:5、15、25、35、45m L的标准品溶液于50m L容量瓶中,加流动相定容至刻度摇匀,分别获得浓度为5.72、17.16、28.60、40.04、51.48μg/m L的系列标准溶液,过0.45μm滤膜。分别精密吸取系列标准溶液20μL注入液相色谱仪,记录色谱图,以cAMP浓度为横坐标,以cAMP峰面积为纵坐标进行线性回归,得线性回归方程,计算R2值。
1.2.5.2 cAMP含量的测定 用蒸馏水浸提苹果肉渣所获得的样品溶液记为W,分为3组:W1、W2、W3,过0.45μm滤膜,分别进样测定;用20%乙醇浸提苹果肉渣所获得的样品溶液记为A,分为3组:A1、A2、A3,过0.45μm滤膜,分别进样测定。根据下式,计算出样品中cAMP的质量含量:

式中:V为制备样品溶液浓缩后定容后的体积,m L;C为HPLC测定样品溶液中cAMP浓度,μg/m L;M为制备样品溶液所用样品的质量,g。
1.2.6 精密度实验 吸取同一浓度的样品溶液,过0.45μm滤膜,分别进样5次测定,测定样品中cAMP峰面积,并计算其cAMP浓度,计算RSD值。
1.2.7 重复性实验 吸取同一批稀释后的样品溶液,过0.45μm滤膜,分别进样5次测定,测定样品中cAMP峰面积,并计算其cAMP浓度,计算RSD值。
1.2.8 加样回收率实验 精密吸取5份已测定cAMP含量的样品溶液,每份1m L,分别加入0.5m L浓度为5.72μg/m L的cAMP标准品溶液,摇匀,过0.45μm滤膜,进样测定峰面积,按照下式计算加样回收率,并计算RSD值:
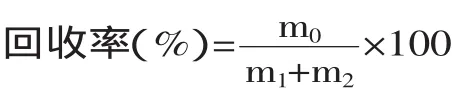
式中:m0为cAMP的测定量,μg;m1为cAMP加入量,μg;m2为样品中cAMP含量,μg。
2 结果与分析
2.1 色谱条件的选择
2.1.1 流动相的选择 流动相选择为:甲醇-含0.05moL/L磷酸二氢钾的双蒸水(体积比10∶90),流速1.0m L/m in,检测室温度为正常室温,进样量为20μL。
2.1.2 检测波长的选择 对cAMP标准品溶液进行紫外全波长扫描,扫描结果如图1所示。图1表示,cAMP在波长为209nm和259nm处有最大吸收峰,但是在210nm以下,溶液中氧气亦有吸收,故而产生误差,所以选择259nm作为检测波长。

图1 cAMP标准品扫描图谱Fig.1 The scanningmap of cAMP standard substance
2.2 cAMP的定性检测结果
本研究采用保留时间法定性,结果如图2所示。图2表明,样品中有组分与cAMP标准品的保留时间一致,大约为3.4m in,并且样品中的目标峰与其他峰分离效果较好,故证明样品中的目标峰为cAMP的峰。
2.3 cAMP定量检测结果
本研究所得线性回归方程为y=0.3294x。其中以峰面积为y轴,以cAMP质量含量为x轴,所得标准曲线如图3所示,相关系数R2=0.9997大于0.99,呈良好线性关系,以5倍音噪比计算,该方法的检出限为0.0900μg/g。

图2 cAMP标准品及样品中cAMP色谱图Fig.2 The chromatograms of cAMP standard substance and sample

图3 标准曲线图Fig.3 The figure of standard curve
样品中cAMP含量的测定结果如表1所示。表1显示,用蒸馏水浸提(序号中的W1、W2、W3)制备样品溶液,测定苹果渣中cAMP含量为(225.8401±4.9221)μg/g;用20%乙醇溶液浸提(序号中的A1、A2、A3)制备样品溶液,测定苹果渣中cAMP含量为(132.5300±5.4507)μg/g。由此可见,对于苹果渣不同的处理方式会影响到cAMP含量测定的结果,浸提液中添加乙醇可能会降低cAMP的溶出,使测定结果偏低。所以测定苹果渣中cAMP的含量时,最好选用蒸馏水浸提制备样品溶液。

表1 HPLC测定不同处理方式苹果渣中cAMP含量结果Table1 HPLC determination of the cAMP content in apple pomace by different treatments
2.4 精密度实验结果
cAMP标准品溶液精密度实验结果见表2。发现相对标准偏差RSD=1.01%(n=5)小于2%,所以本研究精密度较好。

表2 精密度实验结果Table2 The results of precision test
2.5 重复性实验结果
苹果渣样品溶液重复性实验结果见表3。发现相对标准偏差RSD=1.67%(n=5)小于2%,所以本研究重复性较好。

表3 重复性实验结果Table3 The results of repeatability test
2.6 回收率实验结果

表4 回收率实验结果Table4 The results of recovery rate test
苹果渣样品溶液回收率实验结果见表4。发现平均回收率为97.64%,相对标准偏差RSD=1.92%(n=5)小于2%,所以本研究回收率较好。
3 讨论
本研究用水提取、乙醇提取两种方式进行苹果渣中cAMP提取,并运用HPLC测定了苹果果渣中cAMP的含量。水浸提和乙醇浸提方法,已是活性物质提取中常用的方法,我们借鉴了枣中cAMP的提取方式[9,16-17],对苹果渣采取了两种浸提方式。
目前对于动植物中cAMP检测方法有纸色谱法、薄层色谱法、蛋白结合法、放射免疫法和高效液相色谱法。其中,纸色谱法操作繁琐其时间长、灵敏度低;薄层色谱法具有操作方便、设备简单、显色容易、展开速率快等特点,较纸色谱法效果好,但常被用于对样品的粗测,分离效果不及HPLC;放射免疫法需要借助液体闪烁计数仪,并要与蛋白结合法一起进行,造价比较高,试剂要求比较严格。因此,本文选用了目前应用最多的HPLC色谱分析方法,对苹果渣中cAMP进行定性、定量分析。
本研究在苹果渣cAMP定量分析中得到,用蒸馏水浸提制备样品溶液中的cAMP含量为(225.8401± 4.9221)μg/g,用20%乙醇溶液浸提制备样品溶液中的cAMP含量为(132.5300±5.4507)μg/g。与刘孟军等[10]运用放射免疫法测定苹果鲜果中cAMP含量为(336.00±95.15)pmol/g相差较大,这可能与测定方法不同、苹果材料不同等有关系。本研究中水提取所得的cAMP含量明显高于乙醇提取方式,是因为cAMP有3种异构体,每种异构体有顺、反两种构象,在溶液体系中cAMP共有6种稳定的构象,且各种异构体和构象处于一种快速的动态平衡过程[18];经分析,一是由于cAMP在水溶液中的溶解度比在一定浓度乙醇溶液中的溶解度高;二是由于cAMP的6种不同的分子结构在蒸馏水浸提液中的优势构象与在一定浓度乙醇溶液中的优势构象不同,所以溶剂化作用不同,从而导致测定结果有明显差异。然而样品溶液体系对cAMP含量影响的具体因素与机理,还有待于进一步深入研究。另外,本研究所得苹果渣中cAMP含量与枣中cAMP含量也明显不同,主要因为种属不同。张明娟等[9]用HPLC测定了8种枣果中cAMP的含量,cAMP含量最高为375.61μg/g,最低为46.01μg/g;而且发现在一定乙醇浓度范围内,随着乙醇浓度的增大,枣果中cAMP的提取率明显降低,与本研究结果有相同的趋势。王丽霞等[19]用和田玉枣进行了cAMP的提取与分离纯化的研究,最高提取率为72.3%,获得cAMP纯度为3.47%;夏泉鸣等[20]研究了红枣中cAMP提取工艺,最终得到cAMP提取率为65.0%,cAMP纯度为37.5%。本研究中,苹果果渣cAMP含量为225.8401μg/g,虽比枣果中cAMP含量375.61μg/g稍低,但对于开展苹果加工中果渣副产物的综合利用、变废为宝具有一定的实用价值,将为苹果果渣中活性功能物质的开发开辟新的领域。
4 结论
本研究通过实验,得出了HPLC测定苹果渣中cAMP含量的色谱条件,并通过在该条件下进行了定性和定量检测。采用保留时间法定性,相关系数R2为 0.9997;精密度实验中RSD为1.01%;重复性实验中RSD为1.67%;回收率实验中cAMP平均回收率为97.64%,RSD为1.92%。采用蒸馏水的提取方式并利用HPLC测定了皇冠苹果渣中的cAMP的含量为(225.8401±4.9221)μg/g;采用20%乙醇溶液的提取方式测定苹果渣中cAMP含量为(132.5300±5.4507)μg/g;对于cAMP提取,更适合选用水提取方法。
[1]唐雪,马海田,邹思湘.脱氢表雄酮(DHEA)对鸡胚原代肝细胞cAMP/PKA信号通路和cAMP反应元件结合蛋白(CREB)的影响与调节[J].农业生物技术学报,2012,20(6):649-656.
[2]Miao J,Fang S,Bae Y,et al.Functional inhibitory cross-talk between constitutive androstane receptor and hepatic nuclear factor-4 in hepatic lipid/glucose metabolism is mediated by competition for binding to the DR1 motif and to the common coactivators,GRIP-1 and PGC-1alpha[J].Journal of Biological Chemistry,2006,281(21):14537-14546.
[3]杨夏,彭生,刘功俭.cAMP/PKA/CREB信号通路及相关调控蛋白PDE-4和ERK对学习记忆的影响[J].医学综述,2011,17(15):2241-2243.
[4]Amrhein N.Evidence against the occurrence of adenosine 3’,5’-cyclic monophosphate in higher plants[J].Plarrta,1974,118(3):241-258.
[5]Amrhein N.The current status of cyclic AMP in higher plants[J].Anrnal Review of Plant Physiology,1977(28):123-132.
[6]Hanabusa K,Cyong J,Takahashi M.High-level of cyclic AMP in the jujube plum[J].Planta Medica,1981,42:380-384.
[7]Jyong-Chyul Cyong,Kiyomichi Hanabusa.Cyclic adenosine monophosphate in fruits of zizyphus jujuba[J].Pytochemistry,1980(19):2747-2748.
[8]Jyong-Chyul Cyong,Makoto Takahashi.Identification of guanosine 3’,5’-monophosphate in the fruit of zizyphus jujuba [J].Phytochernistry,1982(21):1871-1874.
[9]张明娟,李薇,庞晓明.枣果中环磷酸腺苷cAMP的提取工艺及含量测定[J].食品与发酵工业,2012,38(5):228-231.
[10]刘孟军,王永蕙.枣和酸枣等14种园艺植物cAMP含量的研究[J].河北农业大学学报,1991,14(4):20-23.
[11]Kaushal Nk,Joshi VK,Sharma RC.Effect of stages of apple pomace collection and treatment on physic-chemical and sensory qualities of pomace leather[J].Journal of Food Science and Technology,2002,39(4):388-393.
[12]Francielo V,Patrcia MA,Fernanda S,etal.Apple pomance:a versatile substrate for biotechnology applications[J].Critical Reviews in Biotechnology,2008,28(1):1-12.
[13]于滨,吴茂玉,朱凤涛,等.苹果渣综合利用研究进展[J].中国果蔬,2012(12):31-34.
[14]张倩,樊军,罗云伟.HPLC测定陕北大枣和新疆大枣中环磷酸腺苷含量的研究[J].药物与分析杂志,2008,28(6):895-897.
[15]史景江,熙中.色谱分析法[M].重庆:重庆大学出版社,1995:182-242.
[16]王立霞,陈锦屏,张娜,等.和田玉枣中cAMP提取工艺的研究[J].食品工业科技,2009,30(10):234-236.
[17]蒲云峰,万英,侯旭杰.HPLC法测定不同品种红枣中cAMP含量[J].食品研究与开发,2011,32(7):109-112.
[18]张爱华,杨宝华.cAMP的构象及其异构化反应的理论研究[J].信阳师范学院学报:自然科学版,2012,25(4):461-464.
[19]王立霞,陈锦屏,张娜,等.和田玉枣中环磷酸腺苷(cAMP)的分离纯化工艺研究[J].食品科学,2008,29(12):250-254.
[20]夏全明,周洋,赵黎明,等.离子交换法提取大枣中环磷酸腺苷(cAMP)的工艺研究[J].生物技术进展,2012,2(4):288-292.
