蜂胶提取液对草菇及其污染菌抑制作用的研究
2013-02-21曹红刚范家恒李亮梅赵风云
曹红刚,范家恒,李亮梅,赵风云
(昆明理工大学食品工程研究中心,云南昆明650500)
草菇(Volvariella volvacea)又名稻草菇,国际上称之为“中国蘑菇”,在热带和亚热带地区被广泛栽培[1]。草菇子实体味道鲜美,营养丰富,深受消费者的喜爱[2-3]。草菇在菌种保藏和栽培过程中,通常使用化学药物,如抗生素、甲醛、多菌灵等化学药物控制其他微生物的污染[4],这些化学药物在抑制杂菌的同时,不免进入草菇子实体中,从而影响草菇的食用安全。蜂胶作为一种天然、无毒的广谱抗菌剂,若将其代替化学药物抑制草菇在菌种保藏和生产过程中的污染,可在一定程度上增强草菇的食用安全性。
蜂胶是西方蜜蜂(Apismellifera)采集植物树脂,并混入蜂蜡、花粉及蜜蜂腺体分泌物后经蜜蜂咀嚼加工而成的一种粘稠物质[5]。蜜蜂利用蜂胶填补蜂巢空隙,光滑蜂巢内壁,并利用蜂胶防止巢房内异物的腐烂和病菌的传染等[6]。黄酮类化合物是蜂胶中的重要生物学活性物质[5]。研究发现蜂胶的抑菌活性[7]、杀虫性[8]、抗氧化活性[9]等药理学活性与其中的黄酮类化合物有密切关系,因此黄酮类化合物的含量常作为蜂胶质量控制的一个重要的指标[10]。
Sawaya等发现不同提取方法和提取溶剂获得的蜂胶,其化学成分存在差异,其抑菌活性各自不同[11]。由于黄酮类化合物多为脂溶性,本实验采用75%的乙醇、95%的乙醇、75%的乙酸乙酯、95%的乙酸乙酯提取蜂胶中的活性成分,并对草菇及其污染菌进行抑制作用研究。以期得出蜂胶的提取方法、提取液浓度等因素对草菇及污染菌的抑制作用影响。作为一种天然抑菌剂,蜂胶已被用于果蔬、肉制品、乳品、鸡蛋等食品的防腐保鲜[12-14],然而,可否添加于草菇菌种和栽培生产中,延长菌种保藏,抑制杂菌污染,尚未见报道,本研究可为蜂胶的广泛应用提供新的思路。
1 材料与方法
1.1 材料与仪器
草菇V23 本实验室保藏菌种;粗蜂胶 采自云南蒙自;马铃薯综合培养基(potato dextrose agar medium,PDA) 马铃薯20%,葡萄糖2%,磷酸二氢钾0.3%,硫酸镁0.15%,琼脂2%,pH自然;牛肉膏蛋白胨培养基(beef-protein agar medium,BPA) 牛肉膏0.3%,蛋白胨1%,氯化钠1.5%,琼脂2%,pH自然。
AL204电子分析天平 中国梅特勒-托利多(上海)有限公司;UV-2550紫外-可见分光光度计日本岛津公司;ES-315高压灭菌锅日本TOMY KOGYO公司;KQ-500DB超声波清洗器 昆山市超声仪器有限公司。
1.2 蜂胶提取工艺
1.2.1 蜂胶的提取 称取适量粗蜂胶,置于-20℃下24h后,取出磨碎,称取磨碎后的蜂胶10g,分别用40m L 75%的乙醇、95%的乙醇、75%的乙酸乙酯、95%的乙酸乙酯,在40℃下浸48h,离心取上清液,-2℃下保存待用。滤渣洗涤、干燥并称重,计算可溶物含量和蜂胶提取液浓度。

蜂胶提取液浓度(mg/m L)=蜂胶总量(mg)×可溶物含量(%)/液总体积(m L)×100
1.2.2 黄酮含量的测定 蜂胶总黄酮含量的测定[15]:取蜂胶提取液1m L,加入1m L 5%NaNO3溶液,1m L 10%A l(NO3)3溶液,10m L 4.3%NaOH溶液,定容至25m L,摇匀,静置15m in,于517nm下测吸光值。以芦丁为标品做标准曲线。
1.3 草菇菌种污染菌的分离与初步鉴定
1.3.1 细菌 取草菇污染菌种接种于BPA平板,37℃培养24h,用接种环挑去少许细菌划线分离,培养出单菌落,通过菌落大小、形态、色泽及染色、镜检进行菌种鉴定。
1.3.2 霉菌 取草菇污染菌种接种于PDA平板,28℃培养1~2d,因污染菌生长速度大于草菇,从霉菌菌丝末端切取新生菌丝接种于新PDA平板上,培养1~2d,通过菌落大小、形态、表面特征、菌丝色泽及染色、镜检进行菌种鉴定。
1.4 蜂胶提取液对草菇、霉菌及细菌的抑制作用
将4种蜂胶提取液用蒸馏水分别稀释20、40、60、80、100、120、140、160、180、200、400倍,0.22μm微孔滤膜过滤除菌,收集滤液进行抑制实验,实验方法为:
1.4.1 草菇、霉菌 吸取1m L蜂胶稀释液用无菌L棒涂布于PDA平板,接种活化后的草菇或青霉菌,28℃恒温培养,对照组为相应的含有相同量的乙酸乙酯水或乙醇水,72h后测定菌落直径,每组实验设三个平行,计算抑制率。
1.4.2 细菌 制备浓度为1×106CFU的细菌菌悬液,涂布于BPA平板上,37℃恒温培养,待其长满培养基后,取直径约为6mm的菌块,接种至涂布有蜂胶稀释液的BPA平板上,对照组为相应的含有相同量的乙酸乙酯水或乙醇水,48h后测定抑菌圈直径,每组实验设三个平行,计算抑制率。
抑制率(%)=[对照组菌落直径(mm)-实验组菌落直径(mm)]/对照组菌落直径(mm)×100
2 结果与分析
2.1 不同浓度乙醇和乙酸乙酯对蜂胶可溶物和黄酮含量的影响
本实验采用75%乙醇、95%乙醇、75%乙酸乙酯、95%乙酸乙酯浸提粗蜂胶,测定其可溶物含量、黄酮含量。以芦丁作为标品,绘制标准曲线得出回归方程为y=10.95x-0.0042,R2=0.9997,依据此方程可求出黄酮含量。结果如表1所示,95%乙酸乙酯提取的蜂胶可溶物含量为60.3%,黄酮含量为6.23mg/m L,均显著高于其他3个溶剂(p<0.05),而75%和95%的乙醇提取液的可溶物含量和黄酮含量之间的差异不显著(p>0.05)。
黄酮类化合物是蜂胶中重要的活性成分,其种类繁多,结构与性质不同,在不同溶剂中的溶解性也不同。Vardar-Unlu G等认为提取溶剂的选择蜂胶提取物的成分有重要影响[16]。本实验中相同浓度的乙酸乙酯与乙醇,乙酸乙酯的提取效果优于乙醇提取效果,根据相似相溶原理,可初步推断云南蒙自蜂胶中含有较多极性较弱的黄酮类化合物。

表1 乙醇与乙酸乙酯的蜂胶提取成分对比Table1 Comparison of propolis extractby ethanol and ethyl acetate
本实验中提取的蜂胶液中黄酮含量为4.92~6.23mg/m L。胡福良等[17]、唐坤等[18]提取市售商品蜂胶中黄酮,其含量分别为51.4mg/m L和41.61mg/g,显著高于本实验的黄酮含量。其原因可能是:本实验采用的原料是采自云南蒙自蜂场的未加工的粗蜂胶,含有较多的蜂蜡等杂质,可溶物含量仅为48.1%~60.3%,使得提取液中的黄酮类化合物的含量偏低;蜂胶提取液中的黄酮类化合物的种类、含量与蜂胶来源、提取试剂、测定方法等因素有关,也会造成不同实验的测定数据有一定的差异性。
2.2 草菇污染菌的初步鉴定结果
2.2.1 细菌的形态特征 37℃培养24h,菌落直径为1~5mm,乳白色,不透明,边缘不规则,表面干燥粗糙、无隆起;经革兰氏染色镜检,菌体呈阳性,短杆状。
对该细菌的菌落特征和显微特征初步鉴定为革兰氏阳性杆菌。
2.2.2 霉菌形态特征 28℃培养2d,菌落直径为0.5~ 1cm,刚长出菌落为淡黄色,随菌落生长,中心出现墨绿色并向上突起,扩展过程中菌落边缘有一圈白色菌丝;正反颜色不同,背面为浅黄色;菌落生长致密、不透明、干燥;随菌落生长,白色菌丝消失,最终为墨绿色。
对菌株进行染色、制片,显微镜检特征为菌丝无色,分生孢子梗单枝,较长,无足细胞,有横膈膜;孢子梗顶端不膨大,排列成帚状的间枝,分支1次或2次,对称,顶层为小梗,上生分生孢子串,分生孢子串呈不分枝的链状;帚状枝较短,排列紧密。单个分生孢子为球形或椭圆形,紫红色。
对该霉菌的菌落特征和显微特征初步鉴定为丛梗孢科(Moniliaceae),青霉属(Penicillium)。
2.3 蜂胶提取液对草菇及其污染菌的抑菌作用
将4种蜂胶提取液用蒸馏水进行梯度稀释,得到稀释液的蜂胶提取液浓度如表2所示。

表2 4种蜂胶在不同稀释度下的蜂胶提取液浓度(mg/mL)Table2 The concentration of 4 kinds of propolis extraction in different dilutions(mg/mL)
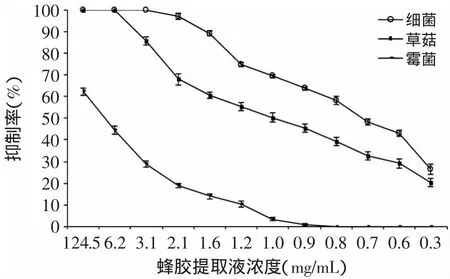
图1 75%乙醇提取液对草菇、霉菌、细菌的抑制曲线Fig.1 Inhibition curve of propolis extract by 75%ethanol on V.volvacea,bacteria andmould
由图1~图4可知,蜂胶提取液对草菇、霉菌和细菌的抑制作用趋势相似,随着稀释倍数的增加,蜂胶提取液对草菇、霉菌、细菌的抑制作用逐渐减弱;相同浓度的蜂胶液对草菇、霉菌及细菌的抑制作用强弱顺序为细菌>草菇>霉菌。进一步比较4种蜂胶提取液的抑菌作用发现,95%乙酸乙酯蜂胶提取液抑菌效果较优。由图4可知,蜂胶液在60倍(2.5mg/m L)的稀释度下,对细菌的抑制率为100%(致死);在20倍(7.5mg/m L)的稀释度下,对草菇是致死的;蜂胶提取液原液对霉菌的抑制率为72.83%,高于其他3种提取液的抑制效果(p>0.05)。
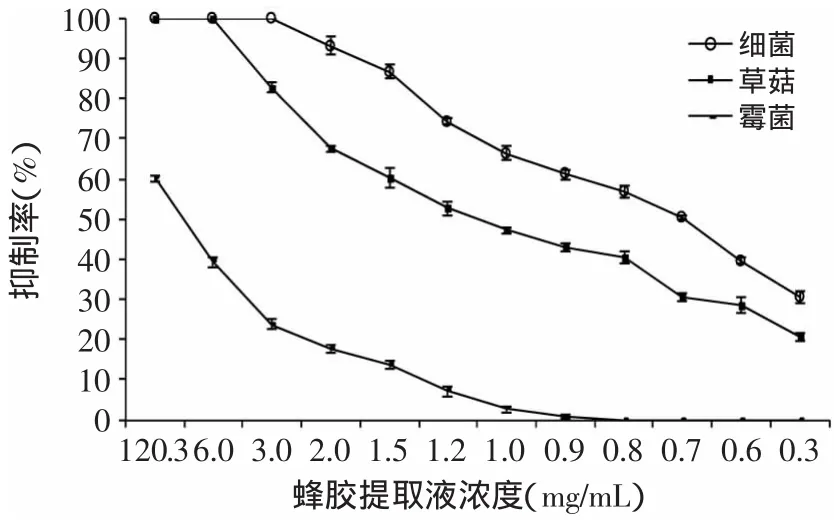
图2 95%乙醇提取液对草菇、霉菌、细菌的抑制曲线Fig.2 Inhibition curve of propolis extract by 95%ethanol on V.volvacea,bacteria andmould

图3 75%乙酸乙酯提取液对草菇、霉菌、细菌的抑制曲线Fig.3 Inhibition curve of propolis extractby 75%ethyl acetate on V.volvacea,bacteria and mould

图4 95%乙酸乙酯提取液对草菇、霉菌、细菌的抑制曲线Fig.4 Inhibition curve of propolis extractby 95%ethyl acetate on V.volvacea,bacteria and mould
抑菌实验表明,相同浓度的蜂胶浸提液对草菇及污染菌的抑制作用不同,其抑制作用强弱顺序为细菌>草菇>霉菌,因此在草菇的栽培过程中,添加适量的蜂胶提取液可有效抑制细菌的污染,但对控制霉菌的污染效果不够显著。这与杨艳彬等[19]的研究结果一致,蜂胶提取液对细菌的抑制作用更明显。
2.4 黄酮含量与抑菌作用的相关性分析
对蜂胶提取液中的黄酮含量和草菇及污染菌的抑菌作用进行相关性分析。由表3可知,草菇、霉菌和细菌的抑制率与黄酮含量的相关系数均大于0.9,说明黄酮含量和抑菌效果有较强的相关性,黄酮含量越高,抑菌效果越强;与Pepeljnjak等得出的蜂胶抗菌效果和蜂胶中黄酮类物质含量成正比的结论一致[20]。也进一步验证了黄酮类物质是一种重要的抗菌活性成分。
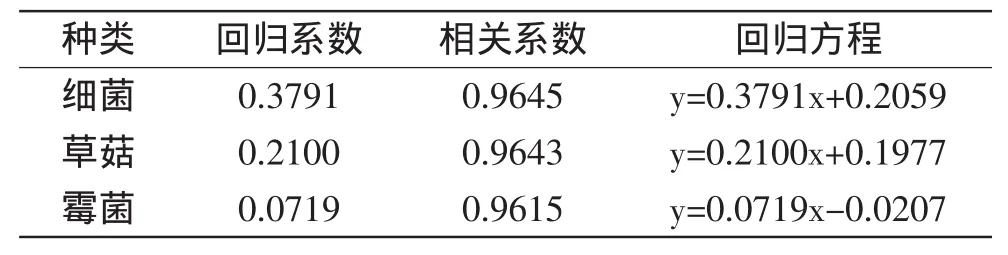
表3 蜂胶提取液中黄酮含量与抑菌作用的相关性分析Table3 Correlations analysis between antimicrobial effectand flavonoid content
3 结论
本研究以云南蒙自的粗蜂胶为材料,采用75%乙醇、95%乙醇、75%乙酸乙酯、95%乙酸乙酯浸提,测定蜂胶提取液的黄酮含量,并进行草菇及分离获得的污染菌的抑制作用研究。结果表明:分离获得的草菇污染菌初步鉴定为革兰氏阳性细菌和青霉属菌。95%乙酸乙酯提取效果优于其他三种溶剂(p<0.05),4种蜂胶提取液对草菇及污染菌均有一定的抑制作用,抑制强弱为细菌>草菇>霉菌。相关性分析表明,草菇、霉菌和细菌的抑制率与黄酮含量的相关系数均大于0.9,有较强的相关性。本研究表明,蜂胶提取液可以有效抑制草菇的生长速度,添加适量蜂胶液能适当延缓草菇菌种的退化速度。同时,将适量的蜂胶提取液代替合成的抗生素、杀菌剂等,应用于草菇的栽培生产、子实体保鲜及菌种保藏中,可有效抑制细菌污染,有一定的应用意义。
[1]Chang S T.Biology and cultivation technology of Volvariella volvacea[M].Hong Kong:The Chinese University Press,1993:73-83.
[2]Hsu H C,Hsu C I,Lin R H,et al.Fip-vvo,a new fungal immunomodulatory protein isolated from Volvariella volvacea[J].Biochemical Journal,1997,323(Part2):557-565.
[3]She Q B,Ng T B,Liu W K.A novel lectin with potent immunomodulatory activity isolated from both fruiting bodies and cultured mycelia of the ediblemushroom Volvariella volvace a[J].Biochemical and Biophysical Research Communications,1998,247(1):106-111.
[4]陈贵省.草菇杂菌污染的综合防治[J].植保技术与推广,2003,23(1):16-17.
[5]Bankova V S,de Castro SL,MarcucciM C.Propolis:recent advances in chemistry and plant origin[J].Apidologie,2000,31(1):3-15.
[6]Kismet K,Kilicoglu B,Koru O,et al.Evaluation on scolicidal efficacy of propolis[J].European Surgical Research,2006,38(5):476-481.
[7]Popova M,Silici S,Kaftanoglu O,et al.Antibacterial activity of Turkish propolis and its qualitative and quantitative chemical composition[J].Phytomedicine,2005,12(3):221-228.
[8]Prytzyk E,Dantas A P,Salomao K,et al.Flavonoids and trypanocidal activity of Bulgarian propolis[J].Journal of Ethnopharmacology,2003,88(2-3):189-193.
[9]Lima B,Tapia A,Luna L,et al.Main flavonoids,DPPH activity,andmetal contentallow determination of the geographical origin of propolis from the province of san juan(Argentina)[J].Journal of Agricultural and Food Chemistry,2009,57(7):2691-2698.
[10]Sha N,Guan S H,Lu Z Q,et al.Cytotoxic constituents of chinese propolis[J].Journal of Natural Products,2009,72(4):799-801.
[11]Sawaya A,Souza K S,Marcucci M C,et al.Analysis of the composition of Brazilian propolis extracts by chromatography and evaluation of their in vitro activity against Gram-positive bacteria[J].Brazilian Journal of Microbiology,2004,35(1-2):104-109.
[12]倪辉,杨远帆.蜂胶对鸡蛋保鲜作用的研究[J].食品工业科技,2001,22(4):12-14.
[13]魏强华,张娜萍,陈业,等.蜂胶涂膜剂在番茄保鲜中的应用[J].食品工业科技,2009,30(2):278-280.
[14]卢兆芸.蜂胶保鲜机理及其在食品保鲜中的应用[J].食品工业科技,2008,29(9):305-308.
[15]余晶晶,董群义.超声波协同萃取蜂胶中黄酮类物质的研究[J].食品工业科技,2013,34(4):314-317.
[16]Vardar-Unlu G,Silici S,Unlu M.Composition and in vitro antimicrobial activity of Populus buds and poplar-type propolis [J].World Journal of Microbiology and Biotechnology,2008,24(7):1011-1017.
[17]胡福良,李英华,朱威,等.不同方法提取的蜂胶液中总黄酮含量的测定及抗肿瘤与抗炎作用研究[J].中国食品学报,2005,5(3):11-15.
[18]唐坤,李标,蔡应繁,等.微波-超声波提取蜂胶的工艺研究[J].食品研究与开发,2008,29(10):74-77.
[19]杨艳彬,翟胜江,李登华,等.蜂胶抑菌防腐作用的研究及在王浆蜜生产中的应用[J].食品工业科技,1999,20(1):23-24.
[20]Pepeljnjak S,Kosalec I.Galangin expresses bactericidal activity againstmultiple-resistant bacteria:MRSA,Enterococcus spp.and Pseudomonas aeruginosa[J].Fems Microbiology Letters,2004,240(1):111-116.
