脱脂米抗氧化肽的分离纯化与研究
2013-02-21徐亚元周裔彬
徐亚元,周裔彬,万 苗,金 鑫
(安徽农业大学茶与食品科技学院,安徽省食品安全分析与检测重点实验室,安徽合肥230036)
功能活性肽因其具有高活性、易吸收、健康安全等特点已成为食品领域研究热点,而从植物蛋白中提取活性肽更受人们青睐,其中抗氧化肽是最为热门的课题之一[1-2]。米糠蛋白的效价比高,一般为2~2.5,其消化率高达90%[3],同时它具有低过敏性,是已知谷物中过敏性最低的蛋白[4-5]。抗氧化肽是指一类具有抑制生物大分子过氧化或清除体内自由基功效的生物活性肽[6],含有2~50个氨基酸残基不等[7]。米糠蛋白水解物中含有丰富的供氢体,可以清除自由基,终止自由基反应链,从而起到抑制和清除自由基的能力,达到抗衰老的功能[8]。通过酶解技术水解米糠蛋白能得到可溶性寡肽,而且具有特殊的生理功能,可以作为营养补充剂和功能因子,可以影响或改善人们的营养代谢、脂肪代谢、糖代谢、调节神经系统等[9-10]。梅德军等[11]用木瓜蛋白酶和风味蛋白酶双酶水解制备米糠蛋白抗氧化肽。付岩松等[12]研究表明了米糠抗氧化肽对D-半乳糖致衰小鼠的线粒体具有保护作用。Zhou mei等[13]通过酶水解法制得的米糠抗氧化肽的水解度为23.67%,对DPPH自由基清除率达64.26%。关于米糠抗氧化肽的分离、纯化、鉴定也有一定的研究,如Mei De jun等[14]研究得到M r<3ku的米糠抗氧化肽具有最好的DPPH自由基清除力。
由于脱脂米糠目前主要作为动物饲料,其营养价与经济价值未能被充分开发利用,关于其抗氧化肽也鲜有报道,因此本文探讨了脱脂米糠抗氧化肽的分离纯化的方法及其氨基酸含量的测定与分子分布,为其产业化生产和应用提供理论基础和依据。
1 材料与方法
1.1 材料与仪器
脱脂米糠 安徽金润米业有限公司;分子量标准品(BSA、核糖核酸酶A、Vitamin B12、尿嘧啶、氨基乙酸) 赛分公司;离子交换剂DEAE-52纤维素、葡聚糖凝胶Sephadex G-15 Pharmacia公司;碱性蛋白酶 Sigma公司;其他试剂 均为国产分析纯。
Waters 600高效液相色谱 美国Waters公司;氨基酸自动分析仪 美国安捷伦1100;BioLogic LP层析系 Bio-Rad Laboratories Inc。
1.2 实验方法
1.2.1 米糠蛋白的制备工艺流程 称取10g脱脂米糠与pH13的NaOH溶液按1∶10的比例混合,在35℃下提取3h,离心得到的米糠沉淀冷冻干燥后与pH 0.5的HCl溶液按1∶8的比例混合,在40℃下提取3.5h,离心得到的米糠沉淀冷冻干燥后与0.6mol/L的NaCl溶液按1∶10的比例混合,在45℃下提取2.5h,离心保留上清液,并与前两步所得的上清液合并,经等电点沉淀(pH4.5)、离心后所得到的沉淀即为脱脂米糠蛋白。
1.2.2 脱脂米糠抗氧化肽的制备工艺流程 将上述所制备的脱脂米糠蛋白粉粉碎过80目筛后,用缓冲液将其配制成pH为9,浓度为5%(w/v)米糠蛋白悬浮液,在25℃恒温水浴溶解30m in,然后加入碱性蛋白酶并调节酶与底物浓度比([E]/[S])为1.8%,通过pH-stat法使体系pH稳定为9,在温度为50℃的条件下酶解4.6h,然后100℃加热10m in灭酶。
1.2.3 离子交换层析分离米糠抗氧化肽 本实验选用DEAE-52作为离子交换层析介质,将处理后的DEAE-52纤维素用0.02mol/L的磷酸盐缓冲液(pH 6.5)平衡后装柱(26mm×20cm),选用pH 6.8、0.02mol/L磷酸盐缓冲液为起始缓冲液(A相),0.6mol/L的NaCl溶液为B相。洗脱程序为:0~45min A;45~90min 30%B;95~140m in 70%B;140~215m in 100%B;215~230m in A。将DRBAP配制成5mg/m L的溶液,上样量为4m L,在LP层析系统进行梯度洗脱,流速为1.5m L/min,280nm处检测,收集各洗脱峰,真空浓缩,冷冻干燥各级洗脱组分,以捕获DPPH自由基能力为检测指标筛选抗氧化活性最高的DRBAP作为下一步分离对象。
1.2.4 凝胶层析分离米糠抗氧化肽 将葡聚糖凝胶SephadexG-15处理好装成1cm×50cm的层析柱,对经离子交换层析分离后所得活性最高的组分进行分离,用0.1mol/L的磷酸盐缓冲液进行洗脱,流速为0.1m L/m in,280nm处检测,收集各洗脱峰,真空浓缩,冷冻干燥各级洗脱组分,以捕获DPPH自由基能力为检测指标筛选抗氧化活性最高的DRBAP作为下一步研究对象。
1.2.5 纯化后DRBAP抗氧化活性的测定
1.2.5.1 亚油酸体系中抗氧化能力的检测 采用硫氰酸铁法,按Tepe[15]和Osawa[16]的方法稍加修改。称取10mg RBPHs溶于10m L 50mmol/L磷酸缓冲溶液(pH 7.0)中,加入10m L的无水乙醇和65μL亚油酸,再用蒸馏水调整到25m L,在混匀器上混合均匀,用硅橡胶塞密封,放在60℃恒温培养箱中保温,每隔24h测定吸光度。吸光度的测定:取反应液0.1m L,依次加入4.7m L 75%的乙醇溶液,0.1m L 30%硫氰酸铵溶液和0.1m L 0.02mol/L硫酸亚铁溶液(含3.5%HCl),混合均匀5m in后在500nm处测定吸光度(A样),每天测定一次吸光度,以不添加RBPHs的为空白对照(A对照),所有吸光值均平行测定三次,取平均值,吸光值越高,表示抗氧化能力越低。
1.2.5.2 二苯代苦味肼基自由基(DPPH·)清除能力的测定 采用Shimada等[17]的方法并稍加修改。将RBPHs配制成0.2、0.4、0.6、0.8、1mg/m L溶液,取2m L样品溶液加入2m L 0.1mmol/L DPPH自由基的95%乙醇溶液,振荡摇匀后,室温下静置60m in,于517nm处测定其吸光值A样,同时以95%乙醇为空白对照,吸光值记为A空白,均平行测定三次,取平均值,DPPH·清除率计算公式为:

1.2.5.3 羟自由基(·OH)清除能力的测定 采用邻二氮菲法测定[18]。
1.2.5.4 超养阴离子(O2-·)清除能力的测定 参考李艳红[6]和汪建斌等[19]的方法。
1.2.5.5 螯合金属离子能力的测定 参考Dinis TCP等[20]的方法。
1.2.6 抗氧化肽纯度的鉴定 采用硅胶G薄层层析法:用硅胶GF254制备薄层层析板(20cm×10cm×0.2cm),以正丁醇∶冰醋酸∶水(4∶1∶1)作展层剂,点样量15μL,最后用0.5%茚三酮丙酮溶液显色[21]。
1.2.7 氨基酸的分析 参考王文平的方法[22],采用氨基酸自动分析仪进行分析。
1.2.8 HPLC测定DRBPHs的分子量分布 高效液相色谱:Waters;色谱柱:Sepax SRT-150,Sepax Zenix-150(5μm,300mm×7.8mm);流动相:150mmol/L磷酸盐缓冲液(pH=7.0);检测:UV210nm;流速:1m L/m in;柱温:25℃。分子量标准品为:BSA(M r 6600)、核糖核酸酶A(M r 13700)、Vitam in B12(M r 1355)、尿嘧啶(M r112)、氨基乙酸(Mr 75)。
2 结果与分析
2.1 离子交换层析分离DRBAP
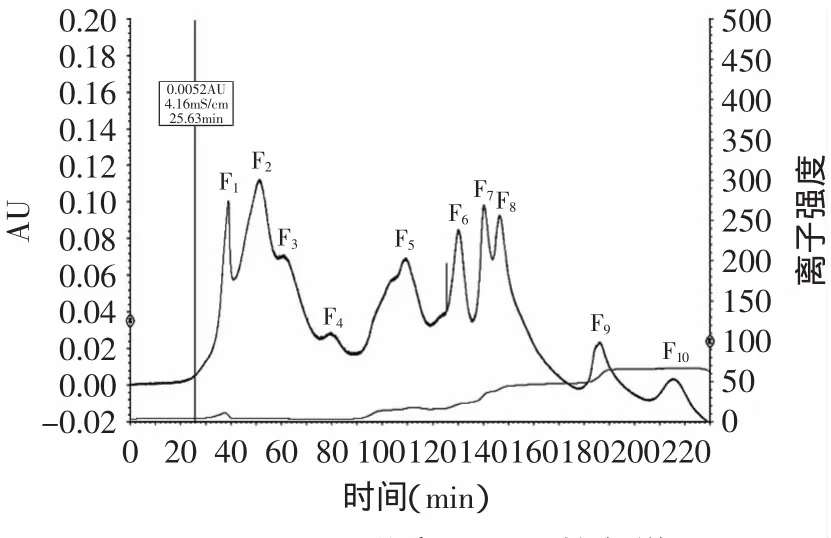
图1 DEAE-52分离DRBAP的色谱图Fig.1 Elution profileofDRBAP fractionsseparated by DEAE-52
离子交换层析主要是根据离子交换剂对各种离子或离子化合物的结合力的差异把不同的物质分开[23],在此条件下,DRBAP得到了较好的分离,混合肽被分离出了10个组分,结果如图1所示,从该图可以看出,随着NaCl溶液浓度的增加,分离效果越明显。分别收集10个组分,分别命名为F1、F2……F10对其进行DPPH自由基的清除率的测定,所得结果如图2所示,所有组分中,F6对DPPH·的清除能力最强,清除率为71.24%,较纯化前的DRBAP提高了近14%。重复分离收集组分F6,真空浓缩、冷冻干燥后,进行下一步的分离。

图2 各组分对DPPH·的清除能力(1mg/mL)Fig.2 DPPH free radical Scavenging activity of different fractions(1mg/mL)
2.2 凝胶色谱分离组分F6
凝胶色谱分离样品是根据分子量大小进行分离的,分子量大的先被洗脱出来,分子量小的,后出来。上样时,一般应尽可能地使用高浓度的样品,但又不影响分辨率[24],因为样品浓度过高,粘度增加,降低层析的分辨率;而且上样体积越小,凝胶色谱分离样品的分辨效果越好[25]。因此,为了保证较好的分离效果,本研究中选用葡聚糖凝胶Sephadex G-15,经条件摸索,确定分离组分6时选用进样浓度约为10mg/m L,进样体积为800μL。

图3 Sephadex G-15分离F6的色谱图Fig.3 Elution profile of F6 fractions separated by Sephadex G-15
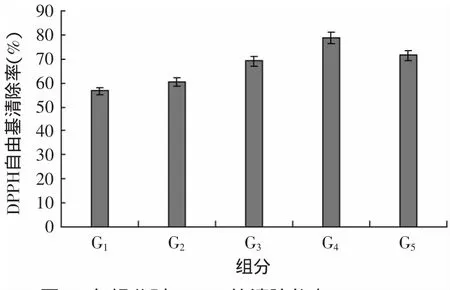
图4 各组分对DPPH·的清除能力(1mg/mL)Fig.4 DPPH free radical Scavenging activity of different fractions(1mg/mL)
分离结果如图3所示,F6组分经过凝胶色谱分离后得到5个组分,按分子由大到小命名为G1、G2……G5,重复分离收集个组分,真空浓缩、冷冻干燥后,测定其对DPPH自由基的清除力,结果如图4所示。
由图4知,不同组分对DPPH·清除能力的强弱顺序为:G1<G2<G3<G5<G4,组分G4活性最强,清除率达78.67%。抗氧化肽的活性与其分子量的大小密切相关,而本研究也证明了这点。随着分子的逐渐减小,组分的活性逐渐增强,其中,G5分子量最小,但活性却呈减弱趋势,这有可能是因为里面含有一些不具有活性的有氨基酸。这现象与其他一些研究者的报道是相吻合的,如Wang等[26]分离小麦面筋蛋白酶解物组分P,Sun等[27]报道的蘑菇肽以及李艳红[7]凝胶色谱分离鹰嘴豆蛋白酶解物组分Fra.IV的抗氧化活性均与分子量大小有关系。
2.3 G4抗氧化活性的测定

图5 未纯化的RBPHs与G4在亚油酸体系中的抗氧化作用(0.6mg/mL)Fig.5 Antioxidantactivities in linoleic acid system of unpurified RPBHs and G4(0.6mg/mL)

图6 未纯化的RBPHs与G4在亚油酸体系中的抗氧化作用(0.6mg/mL)Fig.6 Free radical scavenging and ferrous ion-chelating effect of unpurified DRBAP and G4(0.6mg/mL)
本实验研究了抗氧化肽G4的抗氧化活性,并与未纯化的DRBAP进行了比对,从图5~图6可以看出,经离子交换层析和凝胶色谱层析后的组分G4在亚油酸体系中的抗氧化能力、自由基捕获力以及金属离子螯合率均有大幅提升。G4浓度为0.6mg/m L时,对DPPH·、·OH、O·以及铁离子螯合率分别为:78.67%、56.14%、36.45%、60.22%,G4对DPPH·的捕获能力依旧最强,对·OH相对比较弱。其中,对DPPH·、·OH、O·清除率较纯化前的DRBAP依次提高了20%、9%、16%,对铁离子的螯合率提高了近11%,在亚油酸体系中吸光值下降了0.7,这些都说明经两步分离纯化后米糠抗氧化肽的活性得到提高,也证明了米糠蛋白中确实含有抗氧化活性肽。
2.4 G4纯度的初步鉴定
从图7结果可以看出,经DEAE-52纤维素柱层析和SephadexG-15柱层析纯化后的脱脂米糠抗氧化肽G4,经显色剂显色后为单一点,这可以说明米糠抗氧化肽的杂质组分已很少,基本可以推断其得到了纯化。

图7 组分G4的薄层层析图Fig.7 The thin-layer chromatogram of G4
2.5 G4氨基酸的分析
抗氧化肽的活性与氨基酸种类和组成密切相关,有研究发现,一些单一的氨基酸也会具有某些抗氧化活性,如Lys、Tyr、Glu、Pro、Gly、Phe和His,但活性不如多肽活性高,且很多氨基酸不具有抗氧化活性,而当它们组合在一起形成多肽时又具活性[28-29],所以氨基酸的组合与排列顺序对多肽的抗氧化活性非常重要,这有可能是肽链内的氨基酸之间的短程相互作用,增强了它们与自由基的作用[30]。
通过氨基酸自动分析仪对G4氨基酸组成进行测定,并与脱油米糠蛋白、未纯化的DRBAP的氨基酸组成进行比较,结果如表1所示。从表1中可以看出,米糠蛋白、DRBAP以及G4的氨基酸组成存在比较大的区别,经纯化后的G4含主要的氨基酸为Asp、Glu、Leu、Phe、Arg、Pro,含量较米糠蛋白与DRBAP均有大幅提高,除了A rg其他氨基酸的侧链均具有疏水性。Rajapakse等[31]研究表明,当蛋白水解物以及多肽中的疏水性氨基酸含量增加,脂溶性会提高从而增加其抗氧化活性。另外,谢正军[32]分离纯化酶解苜蓿蛋白酶解物得到的抗氧化活性肽为Glu-Tyr-Asp-Pro,李艳红[6]分离出鹰嘴豆蛋白抗氧化肽为Asn-Arg-Tyr-H is-Glu,以及吴建中[33]报道的大豆蛋白抗氧化肽也含有这几种主要氨基酸,均证明了抗氧化肽的活性与氨基酸的种类与组成有关系。除了上述的几种主要氨基酸,G4中其他氨基酸的含量基本都降低,不过赖氨酸的含量依旧达到7.54g/100g,这很好的弥补了赖氨酸是大米蛋白中的限制性氨基酸的缺陷。

表1 DRBAP和米糠蛋白的氨基酸组成的比较(g/100g蛋白质)Table1 Comparative amino acid profile of DRBAP and rice bran protein isolates(g/100g protein)
2.6 组分G4与DRBAP的相对分子质量分布
通过HPLC测定DRBAP和组分G4的相对分子得到的结果如表2所示,DRBAP相对分子质量小于1000u的组分比例为77.85%,这说明,DRBAP中2~9个氨基酸组成的小分子肽比例较大,这可能是其具有良好抗氧化性的原因所在。而DRBAP经过离子交换层析和凝胶色谱纯化后,相对分子质量小于1000u的组分比例达到90.83%,其中,分子量小于500u的组分也达到14.38%,这说明G4组分中2~4肽的含量也比较多。
3 结论
3.1 选用DEAE-52纤维素作为离子交换层析介质,用NaCl对DRBAP进行梯度洗脱,分离效果越明显,得到了10个组分,其中第6个组分F6对DPPH·的清除能力最强,清除率为71.24%。然后,通过葡聚糖凝胶Sephadex G-15对F6继续分离得到了5个不同组分,它们对DPPH·清除能力的强弱顺序为:G1<G2<G3<G5<G4,组分G4活性最强,清除率达78.67%。通过薄层层析对G4纯度初步鉴定,发现其经显色剂显色后为单一点,说明得到了较好的纯化。

表2 DRBAP与G4的相对分子质量分布(%)Table2 Molecularweight distribution of DRBAP and G4(%)
3.2 经离子交换层析和凝胶色谱层析后的组分G4的体外抗氧化活性较未纯化的DRBAP均有提升。对DPPH自由基、·OH、O·清除率较纯化前的DRBAP依次提高了20%、9%、16%,对铁离子的螯合率提高了近11%,在亚油酸体系中吸光值下降了0.7。
3.3 氨基酸组分析,得到G4的主要氨基酸成分为:Asp、Glu、Leu、Phe、Arg、Pro。组分G4的相对分子质量小于1000的比例达到90.83%,分子量小于500的达到14.38%。
[1]Abayomi P,Adebiyi Ayobamitale O,Adebiyi,et al.Isolation and characterization of protein fractions from deoiled rice bran [J].Eur Food Res Technol,2009,228(3):391-401.
[2]Zhang JH,Zhang H,Guo X,etal.Isolation and identification of antioxidative peptides from rice endosperm protein enzymatic hydrolysate by consecutive chromatography and MALD I-T OF/ TOFMS/MS[J].Food Chemistry,2010,119(1):226-234.
[3]郭学攀,王会霞,程丽英,等.米糠蛋白的提取及功能性质研究[J].河南化工,2007,7:23-25.
[4]杨念,芮汉明.金针菇提取物的提取工艺优化及其抗氧化性能研究[J].食品与发酵工业,2011,37(1):194-198.
[5]Agboola S,Ng D,Mills D.Characterization and functional properties of Australia rice Bran protein isolates[J].Journal of Cereal Science,2005,54(1):142-145.
[6]李艳红.鹰嘴豆蛋白酶解物得制备及其抗氧化肽的研究[D].无锡:江南大学,2008.
[7]Sbok Hyun Nam,Sun Phil Choi,MI Young Kang,et al.Antioxidative activities of bran extracts from twenty one pigmented rice cultivars[J].J Agric Food Chem,2006,4(4):613-620.
[8]樊金娟,罗霞,董智.米糠抗氧化肽的提取和纯化工艺的研究[J].食品科技,2008,33(12):169-172.
[9]俞明伟,张名位,孙远明,等.米糠蛋白及其活性肽的研究与利用进展[J].中国粮油学报,2009,24(5):154-159.
[10]Kaewka K,Therakulkait C,Cadwallader K R.Effect of preparation conditions on compositi-on and sensory aroma characteristics of acid hydrolyzed rice bran protein concentrate [J].Journal of Cereal Science,2009(50),56-60.
[11]梅德军,于国萍,孙安敏.双酶法制备米糠蛋白抗氧化肽[J].食品工业科技,2011,32(12):206-209.
[12]付岩松,罗霞,张心昱,等.米糠抗氧化肽对D-半乳糖致衰小鼠线粒体的保护作用[J].食品工业科技,2010,31(6):310-316.
[13]Zhoumei,Zhangmin.Preparation of anti-oxidation boactive peptide of rice bran protein[J].Journal of Natural Product Research&Developmen.2012,24(6):793-796.
[14]Mei D J,Yu G P,Sun A M.Preparation,Purification and Identification of Antioxidant Peptides with Bienzyme Hydrolysis from Rice Bran Protein[J].Journal of Advanced Materials Research,2013,610-612:72-78.
[15]Bektas Tepe,H Askin Akpulat,Munevver Sokmen,et al.Screening of the antioxidative and antimicrobial properties of the essential oils of Pimpinella anisetum and Pimpinella flabellifolia from Turkey[J].Journal of Food Chemistry,2006,97(4):719-724.
[16]Osawa T,Namiki M.Natural antioxidants isolated from eucalyptus leaf waxes[J].Journal of Agricultural and Food Chemistry,1985,33(5),777-780.
[17]Shimada K,Fujikawa K,Yahara K,et al.Antioxidative properties of xanthan on the antioxidation of soybean oil in cyclodextrin emulsion[J].Journal of Agricultural and Food Chemistry,1992,40(6):945-948.
[18]金鸣,蔡亚欣,李金荣,等.邻二氮菲-Fe~(2+)氧化法检测H2O2/Fe~(2+)产生的羟自由基[J].生物化学与生物物理进展,1996,23(6):553-555.
[19]郑冬梅.玉米蛋白及其水解肽的研究动态[J].食品与发酵工业,2002,28(11):55-58.
[20]Dinis TC,Madeira V M,Almeida LM.Action of phenolic derivates(acetaminophen,salycilate,and 5-aminosalycilate)as inhibitors ofmembrane lipid peroxidation and as peroxyl radical scavengers[J].Journal of Archives Biochemistry Biophysics,1994,315(1):161-169.
[21]杨雪莲.基础生物化学实验指导[M].沈阳:沈阳农业大学,2000:17-19.
[22]王文平.植物样品中游离氨基酸总量测定方法的改进[J].北京农学院学报,1998,13(3):9-13.
[23]王镜岩,朱圣庚,徐长法.生物化学[M].北京:高等教育出版社,2002:290-316.
[24]Kim SY,Je JY,Kim SK.Purification and characterization of antioxidant peptide from hoki(Johnius belengerii)frame protein by gastrointestinal digestion[J].Journal of Nutritional Biochemistry,2007,18(1):31-38.
[25]Je JY,Qian Z J,Kim SK.Purification and characterization of an antioxidant peptide obtained from tuna backbone protein by enzymatic hydrolysis[J].Journalof Process Biochemistry,2007,42(5):840-846.
[26]Wang JS,Zhao M M,Zhao Q Z.Antioxidant properties of papain hydrolysates of wheat gluten in different oxidation systems[J].Journal of Food Chemistry,2007,101(4):1658-1663.
[27]Sun J,He H,Xie B J.Novel antioxidant peptides from fermented mushroom Ganoderma lucidu-m[J].Journal of Agricultural and Food Chemistry,2004,52:6646-6652.
[28]Ranathunga S,Rajapakse N,Kim S K.Purification and characterization of antioxidative peptide derived from muscle of conger eel(Conger myriaster)[J].Journal of European Food Research Technology,2006,222:310-315.
[29]Ren JY,Zhao M M,Shi J.Purification and identification of antioxidant peptides from grass carpmuscle hydrolysates by consecutive chromatography and electrospray ionization-mass spectrometry[J].Journal of Food Chemistry,2008,108:727-736.
[30]Nam K A,You S G,Kim S M.Molecular and Physical Characteristics of Squid(Todarodes pacificus)Skin Collagens and Biological Properties of Their Enzymatic Hydrolysates[J].Journal of Food Science,2008,73:249-255.
[31]Niranjan Rajapakse,Eresha Mendis,Won-Kyo Jung,et al.Purific ation of a radical-scavenging peptide from fermented mussel sauce and its antioxidant properties[J].Journal of Food Research International,2005,38(1):175-182.
[32]谢正军,金征宇.苜蓿叶蛋白抗氧化肽水解用酶的筛选研究[J].食品科学,2007,28(2):342-346.
[33]吴建中.大豆蛋白的酶法水解及产物抗氧化活性的研究[D].广州:华南理工大学,2003.
