乳酸菌发酵豆粉取代日粮动物蛋白对仔猪生长性能及生理生化指标的影响
2013-02-20朱立鑫石枬弘
■朱立鑫 石枬弘
(全能生物科技(天津)有限公司,天津 301600)
猪只生产中的仔猪是饲养关键期,易消化失调造成生长迟缓,由于仔猪腹泻的发生与饲料蛋白质源有关(Pluske等,1995)。豆粉(soybean meal,SBM)是提供猪只蛋白质的主要来源,然而豆粉含有多种的抗营养因子(antinutrition factors,ANFs),例如胰蛋白酶抑制因子(trypsin inhibitor,TI)、凝集素(lectins)和大豆球蛋白(soybean globulins)等,干扰养分的消化、吸收和利用,对仔畜生长性能影响甚大(Dunsford等,1989;Jiang等,2000)。过去报告指出 TI会降低蛋白质的消化率和造成胰脏肥大(Liener,1981)。另外造成过敏反应的大豆球蛋白glycinin和β-conglycinin则会导致动物肠道异常表现(Stokes等,1984;Miller等,1986)。
利用微生物发酵技术降低ANFs可改善豆粉营养价值,有助于动物消化利用。传统上利用Aspergillus oryzae以制作酱油、清酒和味精等食品,也可应用于饲料豆粉的发酵以降低豆粉内的TI和增加小分子胜肽的含量,报告指出可改善鸡只生长和饲料利用率(Chah等,1975;Hong等,2004)。
日本的纳豆、越南的thua-nao和西非的dawadawa是使用Bacillus subtilis发酵的食品,Bacillus subtilis因具有大量水解蛋白质成氨基酸和肽的特性(Sarkar和Tamang,1995),故大量利用Bacillus subtilis发酵豆粉可促进猪只饲料消化率(Sarkar等,1997;Kiers等,2000),改善体增重及饲料效率(Kiers等,2003)。Rhizopus spp.用于制作印度尼西亚传统黄豆发酵食品Tempe,发酵过程为合成酵素以水解蛋白质,降低抗营养因子和产生独特风味(Mital等,1990)。
豆粉经由发酵可降低抗营养因子,有助于仔畜对蛋白质消化及吸收,改善体增重与饲料效率,本试验使用Lactobacillus spp.菌种发酵豆粉,饲料中添加10%发酵豆粉,取代部分豆粉、鱼粉和乳清粉,评估对离乳仔猪生长、肠道发育及免疫反应之影响。
1 研究方法与步骤
1.1 动物试验
实验动物为24只三周龄二元种猪(Landrace×Yorkshire),随机分成3个处理组,分别为对照组(CTRL)、乳酸菌+酵母菌+芽孢杆菌复合菌发酵豆粕处理组(TRT2D)及乳酸菌发酵+熟化工艺处理发酵豆粕处理组(TRT1N),每处理组2个重复,每重复4只,分别为对照组及两种发酵豆粉试验组,发酵豆粉试验组是以发酵豆粉取代部分豆粉、鱼粉和乳清粉作为饲料蛋白质主要来源(见表1)。试验进行3周,每周记录体增重和采食量。饲养期结束,每重复组取2只猪收集粪便和采血,麻醉方式牺牲,取胃至结肠食糜检测pH值,收集的小肠分三段储存于10%福尔马林,脾脏组织于4℃保存,以评估对生长性能、肠道菌群、肠道形态与免疫功能的影响。
1.2 生长性能评估
饲养期为3周,每周称量猪只体重与饲料重,评估增重、饲料采食量及饲料效率。
1.3 食糜菌相分析
取胃、十二指肠、空肠、回肠、盲肠和结肠腔内食糜,测定各肠段食糜pH值,将食糜保存于-20℃待菌相检验。取2 g检体加入20 ml稀释液,加入沸石数粒,振荡混合,作为原液,以100 μl原液+900 μl稀释液的方式,稀释至所需的稀释倍数。将培养基划分为三区,取50 μl的稀释液到对应稀释倍数的一区,以L棒涂抹,培养37℃及24~48 h后计数菌落数目。
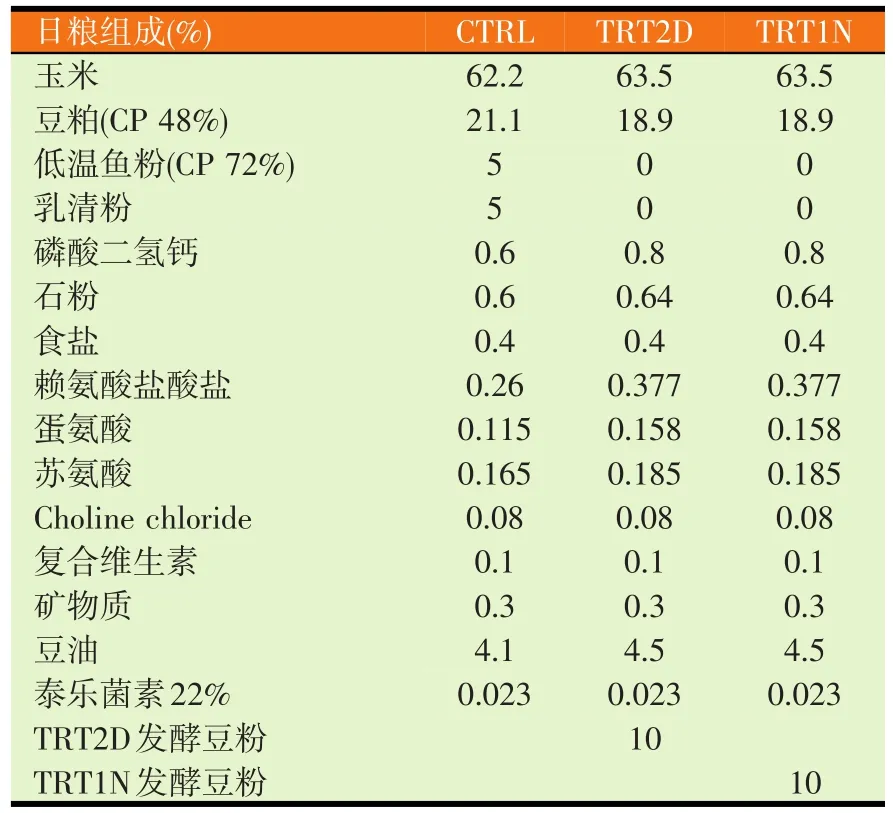
表1 饲料配方
1.4 粪便菌相分析
收集粪便保存于5~8℃,24 h内检验。取2 g检体加入20 ml稀释液,加入沸石数粒,振荡混合,作为原液,以100 μl原液+900 μl稀释液的方式,稀释至所需的稀释倍数。将培养基划分为三区,取50 μl的稀释液到对应稀释倍数的一区,以L棒涂抹,培养37℃及24~48 h后计数菌落数目。
1.5 肠道组织观察
将十二指肠、空肠和回肠各取1~2 cm于10%福尔马林中固定一周,修整厚度至2~4 mm,以95%酒精脱水1 h,脱水后再将组织浸泡于二甲苯中加以清洗,经石蜡包埋及脱蜡后以苏木精与伊红染色法染色,再以显微镜观察切片结果,测量绒毛高度和腺窝深度。
1.6 脾脏淋巴细胞增生反应
脾脏淋巴细胞离心分离并纯化后,将细胞调整至1×106个/ml。将此淋巴细胞培养于添加10%胎牛血清且不含麸酰胺成分的RPMI-1640培养液中。淋巴细胞的增生反应能力测定为利用微量盘法,每孔含1×105个细胞,每一处理为3个重复,培养于37 ℃与5%CO2培养箱中,并分别添加10 μg/ml的伴刀豆球蛋白及LPS(concanavalin A,con A;lipopolysaccharide;LPS),刺激48 h后添加10 μg/ml3H-胸腺嘧啶(specific activity 80 Ci/mmol,Amersham Pharmacia Biotech.)共同培养18 h后,测定各处理cpm值/对照组未经裂殖原刺激cpm值,以计算其增生指数(SI)。
1.7 血液免疫球蛋白分析
将血液放于添加肝素真空采血管,于4℃静置12 h,收集上清液存于-20℃保存待IgA和IgG分析。使用Pig IgA/IgG ELISA Quantitation Set套组(Level Biotechnology Inc.BTLE100-102/104),首先将第一抗体(coating antibody)固定于96-well盘,培养1 h后以ELISA wash solution清洗3次,再加入blocking solution培养30 min,再清洗3次后每well加入标准品和样品,于室温培养1 h,再清洗3次后加入第二抗体(HRP detection antibody)培养1 h,清洗后加入第二抗体呈色剂(TMB substrate solution),于室温避光下反应8~10 min,再加入stop solution以停止反应,于450 nm测定吸光值。
1.8 猪瘟(Hog Cholera,HC)抗体分析
血液收集于真空采血管,于4℃静置12 h,以1 200×g离心10 min,收集上清液使用猪瘟(Hog Cholera,HC)ELISA分析法,利用HC酵素结合体与检体中HC抗体同时竞争固定在微孔盘上的HC抗原原理,因此检体中HC抗体含量愈高,酵素反应呈色将降低,若是检体中无HC抗体,则酵素反应呈色将变深。方法为取50 μl Sample Diluent依所需的样本数加入IDEXX ELISA KIT CSFV测试盘,分别取50 μl阴性对照、阳性对照和血清样本依序加入测试盘,于室温下静置反应120 min。倒掉测试盘中的液体,以350 μl的10×稀释wash buffer洗涤测试盘3~5次。除去孔中残留的清洗液,在每一个测试孔中加入100 μl Anti-CSFV:HRPO Conjugate,于室温下静置反应30 min。再清洗3~5次后于每一个测试孔中加入100 μl TMB Substrate Solution反应10 min,再加入stop solution以停止反应,于450 nm测定吸光值。
1.9 数据处理
先经一般线性模式GLM(general linear models)行变方分析,再以邓肯氏新多次变域测定法(Duncan‘s new multiple range test)比较各处理组的差异显著性。
2 试验结果与分析
2.1 发酵豆粉对仔猪生长性能的影响(见表2)
由表2可见,试验组之间在各周的饲养下对猪只体平均日增重和平均日采食量无显著的差异,不过 TRT1N组在饲养第三周较其它两试验组有较大的增重幅度。饲料效率方面,试验组之间在饲养的第一周和第二周对猪只饲料效率无显著差异,不过TRT1N组在饲养第二周比其它两组有较佳饲料效率的趋势。在饲养的第三周,TRT1N组显著低于对照组有较佳的饲料效率表现。
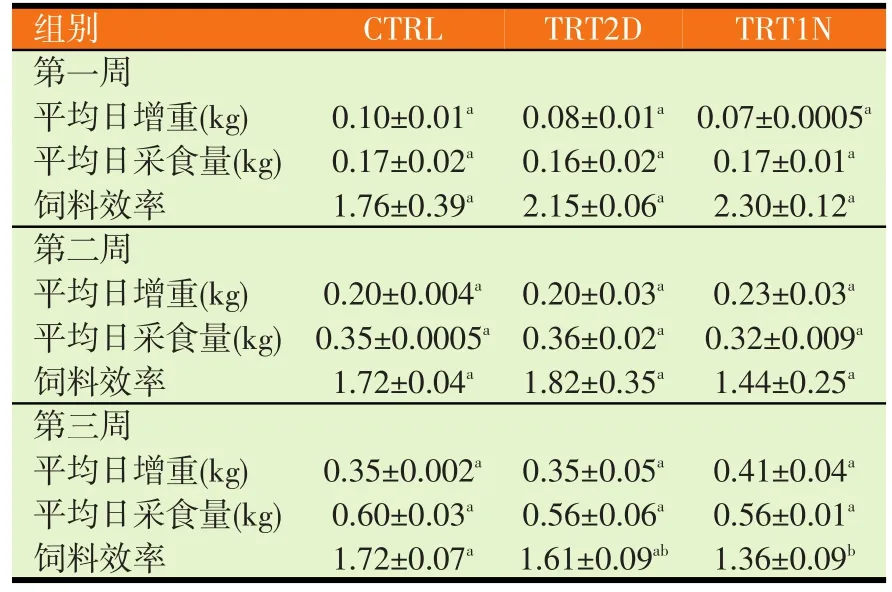
表2 发酵豆粉对断奶仔猪生长性能的影响
2.2 肠道食糜分析
探讨发酵豆粉对离乳仔猪胃到结肠的消化道食糜的pH值和菌相的影响。表3为仔猪测量消化道pH值结果。胃的部分在TRT2D组处理下,pH值显著高于对照组,而TRT1N组与其他两试验组比较无显著差异。十二指肠至结肠的食糜pH值在三个试验组之间无显著差异。

表3 发酵豆粉对离乳仔猪消化道pH值的影响
表4为检测肠内大肠杆菌、沙门氏杆菌、梭菌和乳酸菌的结果。大肠杆菌量在两组发酵豆粉处理下,可在盲肠之外的肠腔发现,而在结肠部位,TRT2D组的大肠杆菌量显著多于TRT1N组。盲肠和结肠内的沙门氏杆菌量在各试验组处理下无显著差异。梭菌部分只在TRT1N组的胃至结肠内检测到含量。盲肠内的乳酸菌量在两组发酵豆粉影响下显著减少,而回肠和结肠的乳酸菌量在三个试验组之间无显著差异。
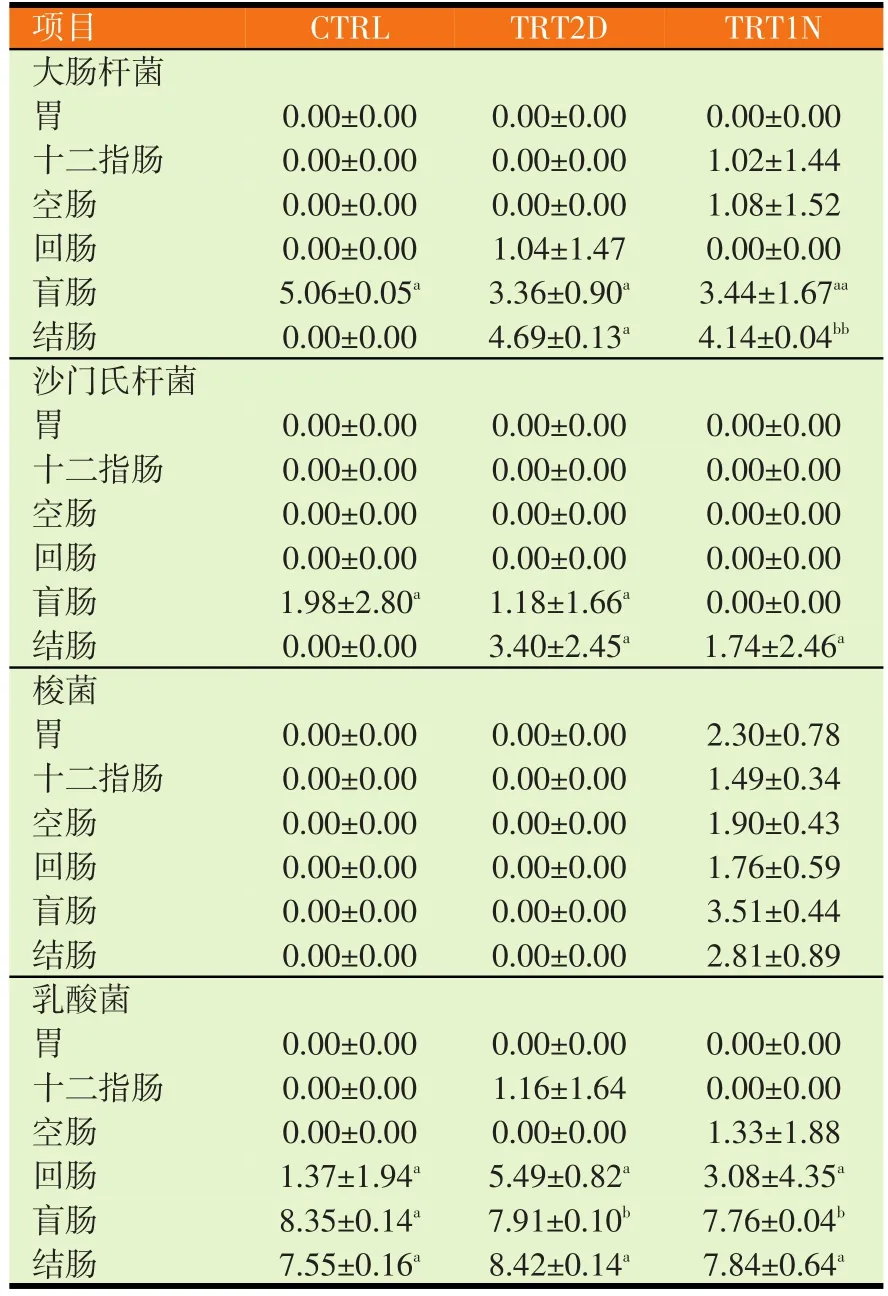
表4 发酵豆粉对离乳仔猪消化道菌相的影响(log10)
2.3 粪便菌相
分析仔猪粪便内的大肠杆菌、沙门氏杆菌、梭菌和乳酸菌的菌数(见表5)。大肠杆菌量在发酵豆粉两组处理下显著低于对照组,而两组发酵豆粉之间无显著的差异。沙门氏杆菌和乳酸菌在三个试验组之间无显著差异。梭菌均无检测。

表5 发酵豆粉对断奶仔猪粪便菌相的影响(log10)
2.4 肠道形态
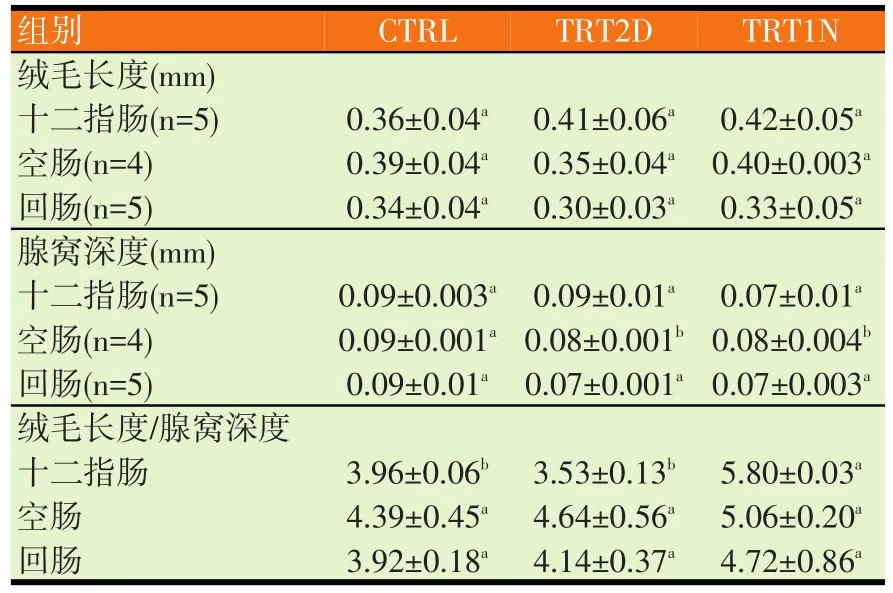
表6 发酵豆粉对断奶仔猪小肠绒毛的影响
由表6可见,十二指肠和回肠三个试验组对绒毛长度和腺窝深度无显著差异,然而空肠部分,TRT2D组和TRT1N组显著降低腺窝深度。另外空肠和回肠三个试验组对绒毛和腺窝比值无显著差异,而TRT1N组比其它两组显著增加十二指脂绒毛和腺窝比值。
2.5 脾脏淋巴细胞增生反应
以ConA和LPS分别诱导T细胞和B细胞,如表7所示,经由ConA刺激,TRT2D组比对照组显著降低T淋巴细胞增生反应,而TRT1N组与其他两试验组比较无显著差异。以LPS刺激则两个发酵豆粉组比对照组显著降低B淋巴细胞增生反应。

表7 发酵豆粉对断奶仔猪脾脏淋巴细胞增生的影响
2.6 血液免疫球蛋白及猪瘟抗体力价分析
由表8可见,三个试验组对IgA和IgG浓度呈现无显著差异,不过TRT2D组对IgG浓度有增加的趋势。

表8 发酵豆粉对断奶仔猪血液免疫球蛋白浓度与HC抗体力价的影响
猪瘟抗体力价范围在45以下为不具保护能力,46~89为具保护能力,90以上则抗体偏高。本试验测试结果如表8所示,三个试验组对仔猪HC抗体力价无显著差异,且已不具保护能力。另外分析C-reactive protein结果均无法侦测到。
3 讨论
过去的研究指出豆粉内的抗营养因子(ANFs)如胰蛋白酶抑制因子(TI)、大豆球蛋白等,影响仔猪肠道形态和养分消化,利用微生物发酵过程中可降低ANFs以改善豆粉营养价值,利于动物消化利用(Matsuo,2006)。本试验结果表2所示,发酵豆粉显著改善仔猪生长性能,而其中TRT1N组则有较佳的饲料效率表现,与Kim等(2005)报告指出具有相似的生长促进效果,他们发现饲料内使用5%发酵豆粉(Aspergillus oryzae发酵)比对照组有显著的提升猪只平均日增重和饲料转换率。Zamora和Veum(1979)也指出大豆经由Aspergillus oryzae发酵可改善猪只生长性能。
营养物质要在胃和前端肠道大量被消化和吸收,后段及大肠内的细菌数量就会在有限的数量范围内繁殖,若不能被有效的消化吸收,将导致后段和大肠内细菌滋生,且仔猪离乳易受到Escherichia coli感染而致生长不良和腹泻,过去报告指出发酵大豆喂饲兔子可抑制E.coli感染和减少仔猪感染E.coli造成肠道液体的流失(Karyadi等,1990)。所以限制离乳仔猪腹泻的最好办法为提高营养物质的消化率,特别是含蛋白质类,豆粉可经由发酵增加小胜肽片段含量,减少大分子的抗营养因子,促进动物消化与利用(Hong等,2004),减少营养物质在后端肠道内的总量。本试验测定仔猪消化道内食糜pH值,文献指出发酵过程抑制豆粉内胰蛋白酶抑制因子,改善离乳仔猪肠道的消化酶活性(Feng等,2007),而肠道消化酶需要胃中盐酸的激活,本试验结果在TRT2D组处理下,胃中pH值显著高于对照组,而TRT1N组与其他两试验组比较胃的pH值无显著差异(见表3)。两种发酵豆粉对胃的pH值影响不同,推测TRT1N组对肠内消化酶活性有增加促进的可能。
而肠内与粪便菌相检测结果如表4和表5所示,在结肠部位,TRT2D组的大肠杆菌量显著多于TRT1N组,盲肠和结肠内的沙门氏杆菌量在各试验组处理下无显著差异,盲肠内的乳酸菌量在两组发酵豆粉影响下显著减少,梭菌部分只在TRT1N组的胃至结肠内检测到含量。分析仔猪粪便内大肠杆菌量在发酵豆粉两组处理下显著低于对照组。沙门氏杆菌和乳酸菌在三个试验组之间无显著差异。梭菌部分三组全无检测结果。从上述食糜与粪便菌相检测结果推测发酵豆粉对肠内坏菌抑制效果不佳,也对乳酸菌群无生长促进效果。
胰蛋白酶抑制因子会干扰胰蛋白酶和胰凝乳酶作用,导致异常的肠道形态(Liener等,1980)。Zarkadas和Wiseman(2007a、b)提出豆粉内的TI与仔猪肠道绒毛长度呈负相关。仔猪离乳后会受到饲料内豆粉的抗原成分造成短暂性过敏反应,影响仔猪肠道形态的变化(Miller等,1994),与绒毛萎缩、腺窝细胞分裂、腺窝增生有关,产生吸收不良症状(Kenworthy等,1996)。本试验的三个试验组对十二指肠和回肠的绒毛长度和腺窝深度无显著差异,然而空肠部分,TRT2D组和TRT1N组显著降低腺窝深度。另外空肠和回肠于三个试验组对绒毛和腺窝比值图无显著差异,而TRT1N组比其它两组显著增加十二指肠的绒毛和腺窝比值(见表6)。十二指肠主要功能是分泌黏液、刺激胰消化酶和胆汁的分泌,为蛋白质的重要消化场所;空肠、回肠的主要功能是吸收,因此绒毛健全是很重要的。绒毛的肠细胞是由未分化的腺窝细胞所生成的。在腺窝(crypt),肠细胞主分泌功能,当其渐渐的往绒毛前端移动时,可发育成熟而成为吸收性绒毛细胞(absorptive villus cell),即微绒毛会变得长、薄且多,以及消化酵素的生成。因此,如果绒毛尖端受损。则其成熟的吸收细胞会流失,最后结果则只有分泌作用而已。若腺窝细胞过度分裂则腺窝深度增加,造成黏液分泌增加,使得仔猪发生腹泻情形。
Liu等(2007)进行仔猪喂饲发酵豆粉的试验,显示经由ConA和LPS诱导,能显著降低脾脏淋巴细胞增生反应。结果和本试验相符,如表7所示,经由ConA刺激,TRT2D组比对照组显著降低T淋巴细胞增生反应,而TRT1N组与其他两试验组比较无显著差异。以LPS刺激则两个发酵豆粉组比对照组显著降低B淋巴细胞增生反应。过去报告指出,提供仔猪豆粉则诱发较大的周边淋巴细胞反应(Li等,1990)。淋巴细胞增生反应降低可能与大豆抗原球蛋白因发酵而降解有关,以减少抗原物质过度刺激免疫系统。Hong等(2004)提到使用Aspergillus oryzae发酵的豆粉可减少大分子胜肽含量(>60 kD),而显著增加小分子胜肽量(<20 kD)。
Li等(1990)试验结果为喂饲猪只豆粉则会提高IgG抗体浓度。原因为食糜中的大豆抗原蛋白(glycinin和β-conglycinin)会经由肠内肠细胞间隙进入血液,刺激全身免疫系统而增加IgG抗体表现。本试验免疫球蛋白检测结果为在三个试验组对IgA和IgG浓度呈现无显著差异,不过TRT1N组较对照组有减少的可能,而TRT2D组对IgG浓度有增加的趋势(见表8)。推测TRT1N组的发酵豆粉经过较佳的发酵作用以减少抗原成分。
C-reactive protein(CRP)由肝脏分泌,伤口或病原感染时会迅速上升,与白血球吞噬作用、免疫系统的启动有关,测定结果得知猪只未受病原感染。另外检测猪瘟抗体力价,本试验测试结果如表8所示,三个试验组对仔猪HC抗体力价无显著差异,且已不具保护能力。
4 小结
本试验目的为豆粉与发酵豆粉作比较,也探讨两种发酵豆粉产品对离乳仔猪的生长性能、肠道形态和免疫特性的影响。TRT1N组则有较佳的饲料效率表现。两种发酵豆粉降低胃的pH值影响不显著,且发酵豆粉对肠内坏菌抑制效果不明显,对乳酸菌群无较佳的促进效果。TRT2D组和TRT1N组均可显著降低空肠腺窝深度,而TRT1N组可显著增加十二指肠的绒毛和腺窝比值。两种发酵豆粉能降低脾脏淋巴细胞增生反应和免疫球蛋白浓度,综合本试验结果显示发酵豆粉对猪只生长性能、绒毛形态和免疫特性具有正向的效果。
