不同种植方式对苗期大豆、玉米根际土壤酶活性及微生物量碳、氮的影响
2013-02-20戴建军宋朋慧闫暮春徐婷婷
戴建军,宋朋慧,闫暮春,徐婷婷
(东北农业大学资源与环境学院,哈尔滨 150030)
土壤酶活性不仅与土壤自身的各种条件因素有关,也与所种作物种类以及不同种植方式等农业措施有关。不同茬口所引起的土壤性状改变,也可能通过土壤酶活性有所反映。Hiltner提出根际(Rhizosphere)概念[1],根际微域环境的研究日益受到重视,已成为土壤学最活跃、最敏感的研究领域。随着相关学科的发展和检测手段的改进,根际研究不断向土壤养分有效性、土壤酶、物质循环等领域拓展,并在研究方法上进行积极探索。这些研究为土壤生态系统的人工调节与优化提供了理论支撑和实践依据。但是,受根际环境复杂性和研究方法的制约,已有成果基本以单作群体和间作群体为研究对象,基于轮作和混作群体根际微生态系统的研究还十分薄弱。
众多研究结果表明,禾本科和豆科作物配合种植不仅能够提高土壤酶活性,也能提高土壤微生物数量和多样性。有研究者比较大豆连作、大豆-玉米轮作和大豆-高粱轮作三种种植制度下,大豆-玉米轮作制度对酶活性的提高作用较大[2]。张淑香等研究结果表明,大豆连作条件下土壤多酚氧化酶活性高于正茬土壤,这是由于土壤中酚酸物质经过诱导作用而使土壤中多酚氧化酶的活性增强,从而引起作物体内生长素氧化酶的活性随之增强,生长素因此分解,影响作物的生长发育[3]。苏嘉欣等研究表明,大豆/黑麦草间作体系中土壤磷酸酶和蛋白酶的活性显著提高[4]。柴强等研究表明,与单作玉米相比,玉米鹰咀豆间作后根际土壤脲酶和酸性磷酸酶活性显著降低,间作根际微生物多样性指数显著高于单作[5]。王旭等以燕麦与箭筈豌豆不同种植模式的根际土壤为对象,说明禾本科和豆科作物间作混播种植方式能起到提高根际土壤微生物数量的作用[6]。刘均霞等研究表明,与单作相比,间作体系中的玉米、大豆根际土壤养分有效性、根际土壤微生物数量、根际土壤酶活性均显著高于相应单作根际土壤[7]。微生物是直接影响土壤酶活性的主要因子,Plaza等在4年的研究中发现,微生物量碳与脱氢酶、过氧化氢酶、BAA-蛋白酶及β-葡萄糖苷酶之间呈正相关,但与磷酸酶呈负相关[8]。
禾本科、豆科间的配合种植是我国普遍采用的农业生产形式。根际是受植物根系活动影响最强烈的动态微域,其在物理、化学和生物学特性等方面均不同于一般土体,是植物、土壤、微生物与环境交互作用的场所。因此,研究根际土壤的酶活性和微生物量碳氮的变化能反映两种作物在生长期的相互作用。选择在我国北方普遍种植的两种作物—大豆和玉米为研究对象,通过盆栽试验,研究在前茬作物是大豆、玉米和大豆-玉米混作的土壤上分别种植大豆、玉米以及大豆-玉米混作对其根际土壤酶活性和微生物量碳氮的影响,为探明不同种植方式下的大豆、玉米的根际微生态效应提供了理论依据。
1 材料与方法
本试验采用盆栽试验,供试土壤为黑土,前茬作物分别为大豆,玉米和大豆-玉米混作。于2011年采自东北农业大学香坊实验实习基地,采集0~15 cm耕层土壤。实习基地位于东经125°42'~130°10',北纬 44°04'~46°40',地处中国东北北部地区,黑龙江省南部,海拔116~180 m。年平均气温在5℃,年降雨量480 mm,年日照时数2 500 h,年有效积温2 300~2 700℃。三种土壤基本理化性状见表1。
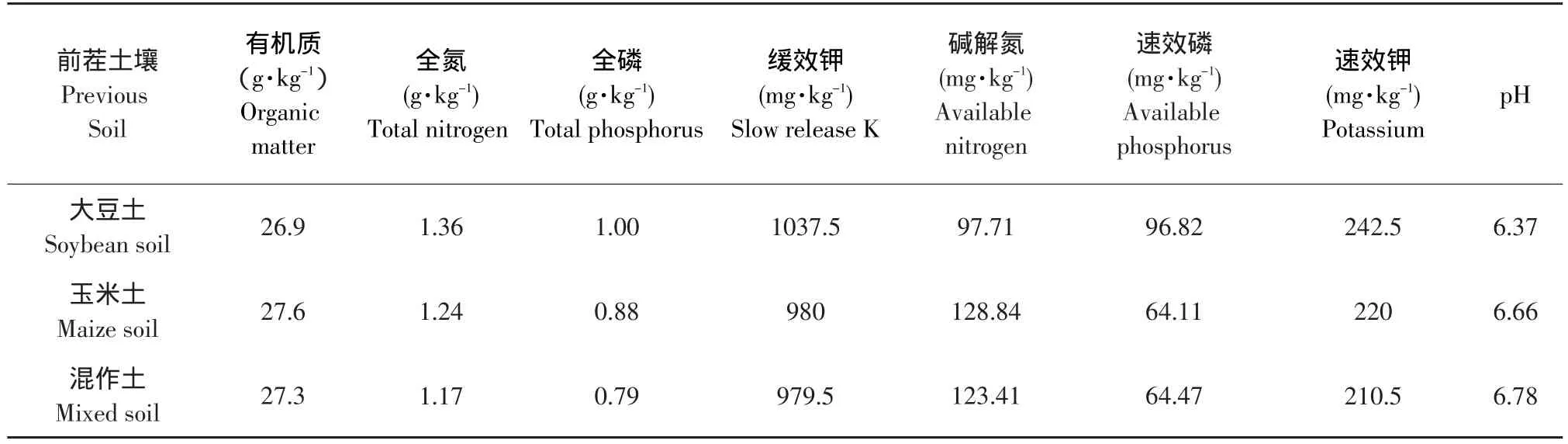
表1 供试土壤的基础肥力Table 1 Basis of soil fertility
盆栽试验:将前茬分别为大豆、玉米和大豆-玉米混作的3种土壤取回风干,过2 mm筛,分别装入直径8 cm、高8 cm的盆钵中,每个盆钵装土250 g,浇水至田间持水量的60%~70%。用普通尿素(N∶46%),重过磷酸钙(P2O5∶46%)和硫酸钾(K2O∶50%)作基肥,用量分别为:N 60 kg·hm-2,P2O590 kg·hm-2和K2O 90 kg hm-2。供试作物品种为玉米(丰田6号),大豆(绥农14)。单作每盆播种两粒,混作每盆播种大豆1粒,玉米1粒。试验共设9个处理,每个处理5次重复。为大土豆、玉米土和混作土种植方式都为单作大豆、单作玉米、大豆-玉米混作。
盆栽于2011年5月13日播种,在室内进行,光照通风良好,温度为20~25℃,每天称重,浇水补足含水量,保证每盆土壤的含水量一致,作物生长21 d(大豆4叶期,玉米5叶期)后,待植株根系布满整个盆钵,把植株连同土壤从盆中取出,再轻轻抖动植物根系使附在根系上的土壤散落,剔除残根,将其混匀即为根际土壤。
测定项目及方法:土壤酶活性的测定参照关松荫和许光辉的方法[9-10]。脲酶活性(NH4+-N mg·g-1,37℃,24 h)采用苯酚-次氯酸钠比色法;过氧化氢酶活性(0.1 mL·g-1NKMnO4)采用高锰酸钾滴定法;多酚氧化酶活性(0.01mL·g-1N I2,30℃,2 min)采用邻苯二酚滴定法;蔗糖酶活性(葡萄糖mg·g-1,37℃,24 h)采用3,5-二硝基水杨酸比色滴定法;土壤微生物量碳、氮采用氯仿熏蒸—0.5 mol·L-1硫酸钾浸提法,过滤后滤液中有机碳采用重铬酸钾常规法测定,全氮用半微量凯氏法测定。土壤微生物生物量碳、氮含量以熏蒸和未熏蒸的有机碳、全氮含量之差分别除以KEC和KEN得到,其中KEC=0.38,KEN=0.54[11-12]。
数据的分析处理采用DPS统计软件和Excel软件完成。
2 结果与分析
2.1 不同处理根际土壤酶的活性
2.1.1 不同处理根际土壤脲酶的活性
从图1可以看出,在前茬为大豆的土壤处理中,单作玉米和大豆-玉米混作的处理要比单作大豆处理的根际土壤脲酶活性略有提高,但差异不显著。在前茬为玉米的土壤处理中,单作大豆处理的根际土壤脲酶活性略高于单作玉米和大豆-玉米混作的处理。而前茬是大豆-玉米混作的土壤处理中,单作大豆处理的根际土壤脲酶活性显著低于其他两种处理,而单作玉米的处理和混作的处理间差异不显著。说明大豆-玉米轮作处理的根际土壤脲酶的活性分别高于两种作物连作的处理,大豆-玉米混作处理的根际土壤脲酶活性也高于连作的处理,但未达显著水平。
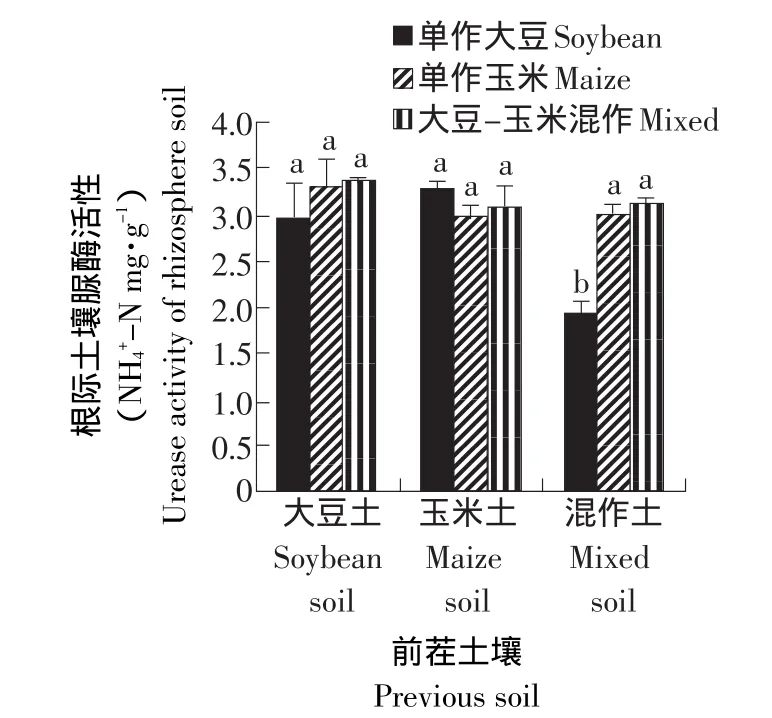
图1 不同处理对根际土壤脲酶活性的影响Fig.1 Effect of different treatments on the activity of urease in rhizosphere soil
2.1.2 不同处理根际土壤过氧化氢酶的活性
由图2可知,前茬为大豆的土壤处理的根际土壤过氧化氢酶活性较前茬为玉米和混作的土壤处理要低。在前茬为玉米的土壤处理中,各处理的根际土壤过氧化氢酶活性由大到小的顺序为:单作玉米>单作大豆>大豆-玉米混作。而其他两种土壤的各处理间没有明显差异。说明玉米连作处理的根际土壤过氧化氢酶活性高于大豆-玉米轮作和大豆-玉米混作的处理。
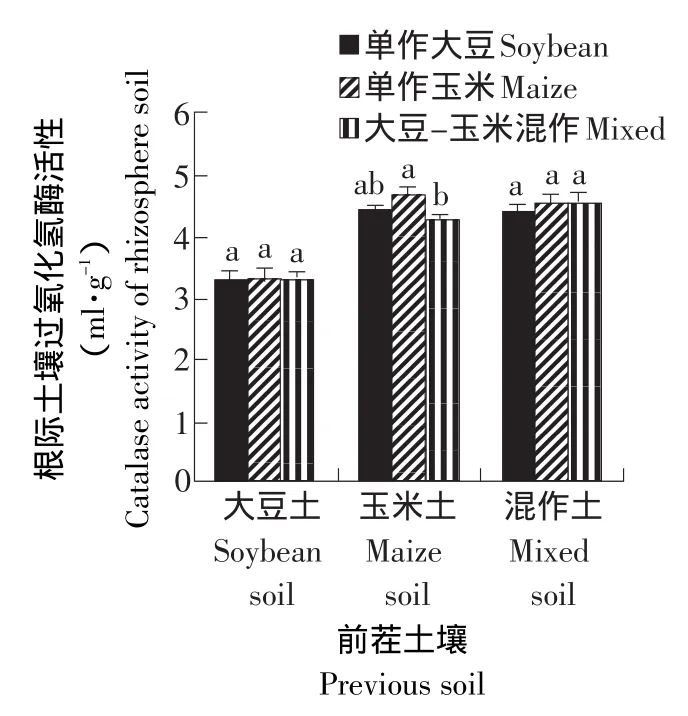
图2 不同处理对根际土壤过氧化氢酶活性的影响Fig.2 Effect of different treatments on the activity of catalase in rhizosphere soil
2.1.3 不同处理根际土壤多酚氧化酶的活性
结果见图3。
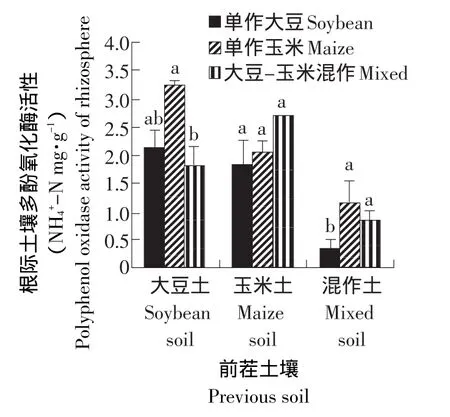
图3 不同处理对根际土壤多酚氧化酶活性的影响Fig.3 Effect of different treatments on the activity of polyphenol oxidase in rhizosphere soil
由图3可知,前茬是大豆-玉米混作的处理根际土壤多酚氧化酶活性最低。在前茬为大豆的土壤处理中,单作玉米处理的根际土壤多酚氧化酶活性显著高于其他处理。在前茬为玉米的土壤处理中,各处理的根际土壤多酚氧化酶活性差异不显著。而在前茬大豆-玉米混作的土壤上,单作大豆处理的根际土壤多酚氧化酶活性显著低于其他处理,单作玉米和大豆-玉米混作处理间差异不显著。说明大豆-玉米轮作处理的根际土壤多酚氧化酶活性高于大豆连作和大豆-玉米混作处理。
2.1.4 不同处理根际土壤蔗糖酶的活性
由图4可知,前茬为玉米的土壤处理较其他两种土壤处理的根际土壤蔗糖酶活性要高。在前茬为大豆的土壤处理中,大豆-玉米混作处理的根际土壤蔗糖酶的活性要显著低于单作大豆和单作玉米的处理。在前茬为玉米的土壤处理中,依然呈现此规律。而在前茬是大豆-玉米混作的土壤处理中,单作玉米处理的根际土壤蔗糖酶活性显著高于单作大豆和大豆-玉米混作的处理。说明大豆-玉米混作处理的根际土壤蔗糖酶的活性低于单作大豆和单作玉米的处理,而大豆-玉米轮作处理的根际土壤蔗糖酶活性分别与两种作物连作的处理间没有明显的差异。
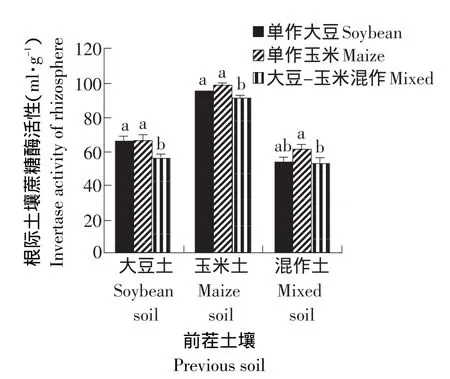
图4 不同处理对根际土壤蔗糖酶活性的影响Fig.4 Effect of different treatments on the activity of invertase in rhizosphere soil
2.2 不同处理土壤微生物量碳、氮的变化
由图5可知,前茬为大豆的土壤处理土壤微生物量碳显著低于其他两种土壤处理,其中单作大豆的处理明显高于单作玉米和大豆-玉米混作的处理。在前茬为玉米的土壤处理中,单作玉米处理的土壤微生物量碳显著高于其他两种处理,单作大豆处理的土壤微生物量碳最低。在前茬是大豆-玉米混作的土壤上,单作大豆处理的土壤微生物量碳显著低于其他两种处理,单作玉米和大豆-玉米混作的处理之间差异不显著。说明两种作物连作较大豆-玉米轮作处理的土壤微生物量碳要高。
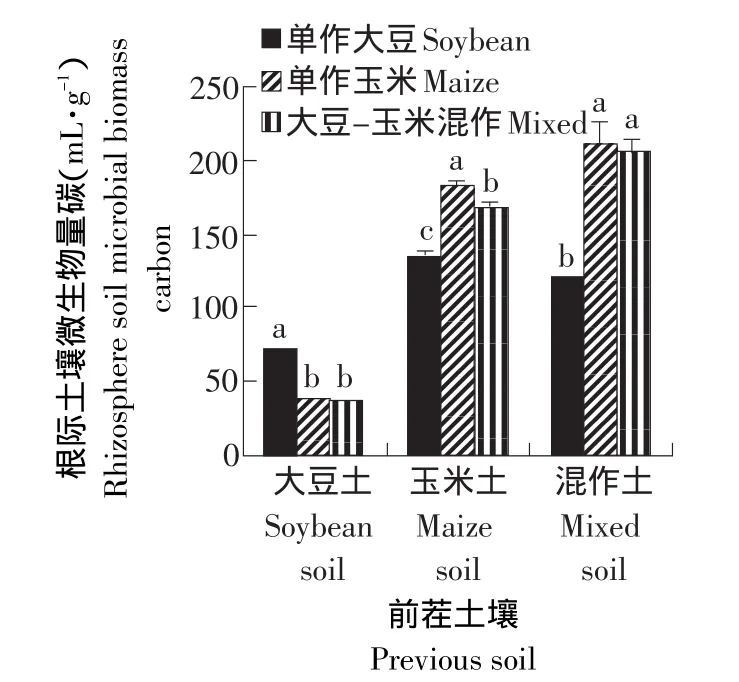
图5 不同处理土壤微生物量碳的变化Fig.5 Changes of the soil microbial biomass carbon in different treatments
由图6可知,在前茬为大豆的土壤处理中,单作大豆处理的土壤微生物量氮较其他两种处理高,但未达显著水平。而在前茬为玉米的土壤处理中,大豆-玉米混作处理的土壤微生物量氮显著高于单作大豆和单作玉米的处理,单作玉米处理的土壤微生物量氮比单作大豆的处理略高,但差异不显著。在前茬是大豆-玉米混作的土壤上,各处理间差异不显著。说明大豆连作和玉米连作都比大豆-玉米轮作的土壤微生物量氮要高,这与各处理间的土壤微生物量碳的变化规律相同,在前茬为玉米的土壤上进行大豆-玉米混作的种植能够提高土壤微生物量氮。

图6 不同处理土壤微生物量氮的变化Fig.6 Changes of the soil microbial biomass nitrogen in different treatments
2.3 土壤酶与土壤微生物量碳、氮的相关性分析
从表3中可见,土壤微生物量碳与微生物量氮及其碳氮比都与土壤过氧化氢酶活性和多酚氧化酶活性呈显著相关或极显著相关,而与其他土壤酶活性的相关性均未达显著水平。由此可见,土壤微生物量碳、氮与根际土壤过氧化氢酶活性和多酚氧化酶活性存在着显著相关关系,因此,不同的种植方式影响根际土壤过氧化氢酶和多酚氧化酶活性的同时,也影响根际土壤微生物量碳、氮的高低,从而影响土壤碳氮的转化。
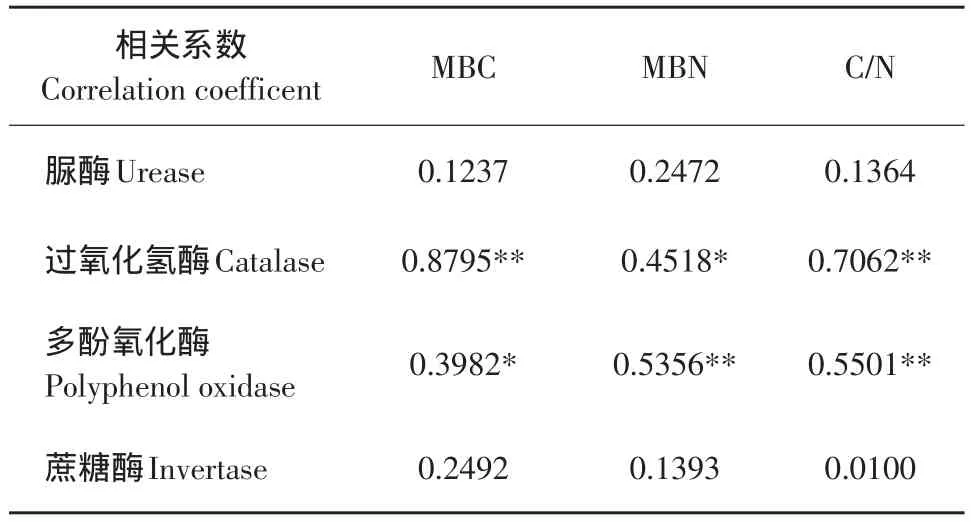
表3 土壤酶活性与微生物量碳氮的相关性分析Table 3 Correlation analysis between soil enzyme activities and microbial biomass carbon and nitrogen
3 讨论与结论
多种作物连作会产生连作障碍[13],连作大豆根际土壤中的多种元素和有机质等养分含量均低于正茬土壤[14],且大豆连作也能使土壤的根际微生物群落产生明显变化[15]。而禾本科和豆科轮作制度能使有益细菌数量提高[16-17],缓解连作障碍,作物产量和品质提高。轮作能有效调节土壤微生物区系,有利于微生物群落的多样性和稳定性提高,最终改善土壤微生态环境[18]。
土壤酶是由植物根系及其残体、土壤动物及其遗骸和微生物所分泌,能催化土壤中复杂有机物质向简单无机化合物的转化,参与包括土壤生物化学过程在内的自然物质循环[19-23]。土壤微生物量碳是土壤有机碳的灵敏指示因子,土壤微生物量氮是土壤氮素矿化的重要组成部分[24]。近年来越来越多的研究用土壤微生物生物量碳、氮来评价某些指标对土壤的影响。但是影响土壤微生物生物量碳氮转化的因素很多,仍需进一步研究。
植物的根系分泌物是土壤酶的重要来源[25],多种植物会不断自我改善根际的营养状况,产生特定的土壤酶[26],所以根际土壤酶在物质交换过程中占据重要地位。李文革等人研究认为,脲酶、磷酸酶、转化酶从本质上反映了土壤中氮、碳、磷、钾的转化强度[27],因而研究不同种植方式下的作物根际土壤酶活性对于探索不同作物间的根系分泌物的相互作用过程和机理具有重要意义。
①大豆-玉米轮作与大豆连作和玉米连作相比有明显的优势,能够不同程度上提高根际土壤多酚氧化酶、脲酶和过氧化氢酶活性。②与大豆-玉米混作相比,大豆连作和玉米连作都降低了根际土壤脲酶活性,提高了根际土壤蔗糖酶的活性,根际土壤多酚氧化酶的活性变化不明显。③大豆连作和玉米连作都比大豆-玉米轮作的土壤微生物量碳、氮要高。在前茬为玉米的土壤处理中,大豆-玉米混作的土壤微生物量氮显著高于单作大豆和单作玉米的处理。④土壤微生物量碳与微生物量氮及其碳氮比都与土壤过氧化氢酶活性和多酚氧化酶活性呈显著相关或极显著相关。
[1]刘芷宇.根际微域环境的研究[J].土壤,1993,25(5):225-230.
[2]张广娜,陈利军,陈振华,等.大豆轮作与连作对黑钙土酶活性和动力学特性的影响[J].大豆科学,2008,27(5):795-800.
[3]张淑香,高子勤,刘海玲.连作障碍与根际微生态研究-土壤酚酸物质及其生物学效应[J].应用生态学报,2000,11(5):741-744.
[4]苏嘉欣,卓胜,黎华寿,等.植物间作下根际微生物和土壤酶与土壤多氯联苯(PCB)降解的关系[J].农业环境科学学报,2010,29(11):2114-2120.
[5]柴强,黄鹏,黄高宝.间作对根际土壤微生物和酶活性的影响研究[J].草业学报,2005,14(5):105-110.
[6]王旭,曾昭海,朱波,等.燕麦与箭筈豌豆不同混作模式对根际土壤微生物数量的影响[J].草业学报,2009,18(6):151-157.
[7]刘均霞,陆引罡,远红伟,等.玉米、大豆间作对根际土壤微生物数量和酶活性的影响[J].贵州农业科学,2007,35(2):60-61.
[8]Plaza C,Hernández D,C.García-Gil J,et al.Microbial activity in pig slurry-amended soils under semiarid conditions[J].Soil Biology and Biochemistry,2004,36(10):1577-1585.
[9]关松荫,张德生.土壤酶及其研究法[M].北京:农业出版社,1986.
[10]许光辉,郑洪元.土壤微生物分析方法手册[M].北京:农业出版社,1986.
[11]Ajit Varma,Ralf Oelmüller.Soil biology advanced techniques[J].Soil Microbiology,2007(11):202-207.
[12]姚槐应,黄昌勇.土壤微生物生态学及其实验技术[M].北京:科学出版社,2005.
[13]刘金波,许艳丽.我国连作大豆土壤微生物研究现状[J].中国油料作物学报,2008,30(1):132-136.
[14]孙磊.不同连作年限对大豆根际土壤养分的影响[J].中国农学通报,2008,24(12):266-269.
[15]李春格,李晓鸣,王敬国.大豆连作对土体和根际微生物群落功能的影响[J].生态学报,2006,26(4):1144-1150.
[16]刘新晶,许艳丽,李春杰,等.大豆轮作系统对土壤细菌生理菌群的影响[J].大豆科学,2007,26(5):723-727.
[17]刘金波,许艳丽,吕国忠,等.黑土区不同轮作系统大豆根际镰孢菌种群结构和数量[J].大豆科学,2009,28(1):97-102.
[18]董艳,鲁耀,董坤,等.轮作模式对设施土壤微生物区系和酶活性的影响[J].土壤通报,2010,41(1):53-55.
[19]潘学军,张文娥,罗国华,等.不同土壤管理方式下幼龄柑橘根际土壤酶活性动态变化[J].土壤通报,2011,42(5):1116-1119.
[20]姚建华,牛德奎,李兆君,等.抗生素土霉素对小麦根际土壤酶活性和微生物生物量的影响[J].中国农业科学,2010,43(4):721-728.
[21]万忠梅,宋长春.土壤酶活性对生态环境的响应研究进展[J].土壤通报,2009,40(4):951-956.
[22]Lei Tian,Emily Dell,Wei Shi Chemical composition of dissolved organic matter in agroecosystems:Correlations with soil enzyme activity and carbon and nitrogen mineralization[J].Applied Soil Ecology,2010,46:426-435.
[23]张昱,程智慧,徐强,等.玉米/蒜苗套作系统中土壤微生物和土壤酶状况分析[J].土壤通报,2007,38(6):1136-1140.
[24]沈宏,曹志洪,徐本生.玉米生长期间土壤微生物量与土壤酶变化及其相关性研究[J].应用生态学报,1999,10(4):471-474.
[25]张咏梅,周国逸,吴宁.土壤酶学的研究进展[J].热带亚热带植物学报,2004,12(1):83-90.
[26]Radersma S,Grierson P F.Phosphorusm obilization in agroforestry:Organic anions,phosphatase activity and phosphorus fractions in the rhizosphere[J].Plant and Soil,2004,259(1):209-219.
[27]李文革,刘志坚,谭周进.土壤酶功能的研究进展[J].湖南农业科学,2006,(6):34-36.
