纤维素分解复合菌系W S C-9中厌氧细菌的分离
2013-02-20付博锐王彦杰高亚梅王伟东
温 雪,付博锐,王彦杰,高亚梅,刘 权,晏 磊,王伟东
(黑龙江八一农垦大学生命科学技术学院,黑龙江 大庆 163319)
木质纤维素大部分存在于作物秸秆、园林废弃物和畜禽粪便等各种有机固体废弃物中,这些有机废弃物大部分被随意废弃,导致严重的资源浪费和环境污染[1-2]。因此,将这些有机废弃资源循环利用,如生产乙醇、甲烷或其他生物质基础材料[3],对于缓解世界资源短缺、治理环境污染意义重大。
近年来,研究利用自然条件下微生物之间的协同关系,富集获得稳定高效分解木质纤维素的复合菌系,均表现出强大的纤维素分解能力。崔宗均等筛选获得复合菌系MC1,在3 d内,对滤纸和麦秆的分解率分别为94%和38%[4]。Igarashi等构建的复合菌系在培养4 d后,滤纸的失重率为79%,可降解60%的稻秆[5];王伟东等构建的复合菌系WSC-6,培养3 d内,滤纸和稻秆的分解率可达到97%和82.2%[6-7];刘长莉经驯化筛选出复合菌系NSC-7,培养5 d,降解稻秆总干重的44.7%[8]。高效分解纤维素复合菌系的成功构建,为加速天然木质纤维素资源的利用研究开辟了新路。
Bell等研究表明菌株之间的协同作用和群落组成在决定系统功能上发挥重要作用[9]。在自然条件下,纤维素分解是在众多微生物的协同作用下完成,而利用天然原料富集获得的复合菌系中微生物组成尚不明确,因此要研究复合菌系组成成份之间协同分解纤维素的机理,必须获得纯培养菌株。已有研究表明,目前能分离培养的微生物不到世界微生物总量的1%,一些分解木质纤维素的菌株是甚至不可培养微生物,必须改良现有方法或者发明新的分离方法才能得到这些难培养微生物。Madden等采用纤维素滤纸球磨处理72 h,然后将球磨浆滚管的方法分离1株高温厌氧可降解纤维素的梭菌属Clostridium[10];Leschine等利用双层平板法分离获得嗜热厌氧纤维素降解细菌Clostridium thermocellum可在高温厌氧条件下直接转化纤维素为乙醇[11];Kato等利用Hungate技术从复合菌系中分离获得1株具有分解纤维素能力的新梭杆菌,被命名为Clostridium straminisolvens sp.nov.,其生长条件不是严格厌氧,在氧浓度高至4%时还能分解纤维素[12]。本实验室富集1组具有高效稳定分解纤维素能力的复合菌系WSC-9,能够在50℃静止培养条件下7 d分解80%以上的水稻秸秆。本研究为了分离复合菌系中的纯培养菌株,明确复合菌系的微生物组成,为研究复合菌系分解纤维素的机理奠定基础,获得新的能够分解和转化纤维素的微生物资源,为木质纤维素资源的生物利用提供科学依据。
1 材料和方法
1.1 试验用复合菌系
本试验用复合菌系WSC-9为从高温期堆肥原料中富集获得,复合菌系培养采用PCS培养基(NaCl 5.0 g,CaCO32.0 g,蛋白胨5.0 g,酵母粉1.0 g,溶于1 000 mL蒸馏水中,1.0%水稻秸秆和1.0%滤纸(Advantec quantitative filter paper no.5A)条为碳源,1.0×105Pa灭菌30 min。
1.2 复合菌系中厌氧细菌纯培养的分离
1.2.1 相关溶液配制
生长培养基与分离培养基:KCl 0.2 g,K2HPO33.5 g,KH2PO31.5 g,NaCl 1.0 g,NH4Cl 1.0 g,MgCl20.5 g,酵母粉2.0 g,蛋白胨2.0 g,半胱氨酸0.5 g,微量元素5.0 mL[12],维生素1.0 mL[13],刃天青1 mL,固体为加入琼脂20.0 g,溶于1 000 mL蒸馏水中。除半胱氨酸、微量元素、维生素、刃天青(0.1%)以外的药品于电磁炉上煮开,依次加入微量元素、维生素、半胱氨酸、刃天青,煮数分钟至培养基颜色浅黄色,在吹氮气的情况下,将培养基分装至自制的Hungate氏厌氧瓶中,瓶中提前放入相应的碳源(滤纸1%V/W、水稻秸秆、纤维二糖Sigma0.5%V/W等),1.0×105Pa灭菌30 min待用。
PBS中加入1%L-盐酸半胱氨酸(V/W)[12],厌氧细菌缓冲液,用于稀释厌氧菌液。
1.2.2 分离过程及方法
首先将复合菌系接入分离培养基(以滤纸为碳源)中,待滤纸完全降解,取出菌液利用PBS进行梯度稀释,选择合适的稀释梯度(稀释倍数为10-6)菌液涂平板,将涂好的平板置于厌氧培养罐中(英国Oxoid AnaeroJar 2.5 L)培养5~8 d。待平板上长出菌落,将菌落挑出于Hungate厌氧管(培养基为液体,纤维二糖为碳源)中培养,等待滤纸降解。将可使滤纸降解的厌氧管中的菌液取出接入Hungate厌氧管(培养基为固体,纤维二糖为碳源)中,经多次滚管得到具有降解能力的单菌落。
1.3 菌株的形态观察
将1.2中获得的菌株进行以下试验:菌株的革兰氏染色;利用扫描电镜(型号:FEI QUANTA 200)观察菌体的形态、大小等。
1.4 细菌16S rDNA基因序列的系统发育分析
采用细菌16S rDNA通用引物27F(5'AGAGTTTGATCCTGGCTCAG 3')和 1 492R(5'GGT TACCTTGTTACGACTT 3'),扩增菌株的16S rDNA基因片段。PCR试剂购自宝生物工程(大连)有限公司。PCR反应体系为50 μL体系:10×buffer 5 μL,10 mmol·L-1dNTP 1 μL,primer 27F(50 μmol·L-1)0.5 μL,primer1492R(50 μmol·L-1)0.5 μL,模板DNA 1 μL,rTaq DNA聚合酶(5 U·μL-1)0.5 μL,加ddH2O补足至50 μL。反应条件:94℃变性5 min;94℃1 min;55℃1 min;72℃2 min,30个循环;72℃延伸10 min。以保证PCR产物的稳定,将产物纯化后送交测序公司测序。
将菌株的序列在NCBI的GenBank数据库中进行比对,选择覆盖率和相似率较高的序列,运用Mega 4软件构建系统发育树。
2 结果与分析
2.1 厌氧纯培养菌株的获得
生长稳定期的WSC-9对于纤维素降解率最高,此时培养液的pH处于7.0左右。利用1.2.2的分离方法,在自行设计的Hungate厌氧装置中经过6代的分离培养,获得了1株具有纤维素分解能力的纯培养菌株,命名为WSC-9-7(见图1、2)。

图1 Hungate厌氧管中培养的菌株WSC-9-7Fig.1 Degradation of filter paper inoculated with anaerobic bacterial WSC-9-7 using Hungate screw-capped test tubes(160mm×10mm)

图2 菌株WSC-9-7降解滤纸、稻秆Fig.2 Degradation of filter paper and rice straw inoculated with anaerobic bacterial isolation WSC-9-7
2.2 厌氧菌株纯培养及纤维素降解能力的测定
在50℃静置培养条件下,复合菌系WSC-9在培养到第3天时,滤纸(培养基1.0%含量,重量比)可以降解95%以上,培养到第5天时稻秆(培养基1.0%含量,重量比)可降解80%以上,而纯培养菌株WSC-9-7在第10天时可以降解47.0%的稻秆。表1是复合系WSC-9和菌株WSC-9-7在50℃下培养10 d后稻秆中木质纤维素的降解情况。就纤维素的分解能力来看,菌株WSC-9-7对于木质纤维素的降解能力要小于复合菌系WSC-9。WSC-9-7在降解滤纸及稻秆时可将培养液的pH降至5.4左右,最低至5.0,这与复合菌系WSC-9在降解木质纤维素时的趋势不同(见图3)。

表1 WSC-9和WSC-9-7对稻秆中木质纤维素降解率Table 1 Degradation ratio of lignocellulose of rice straw by WSC-9 and WSC-9-7(%)
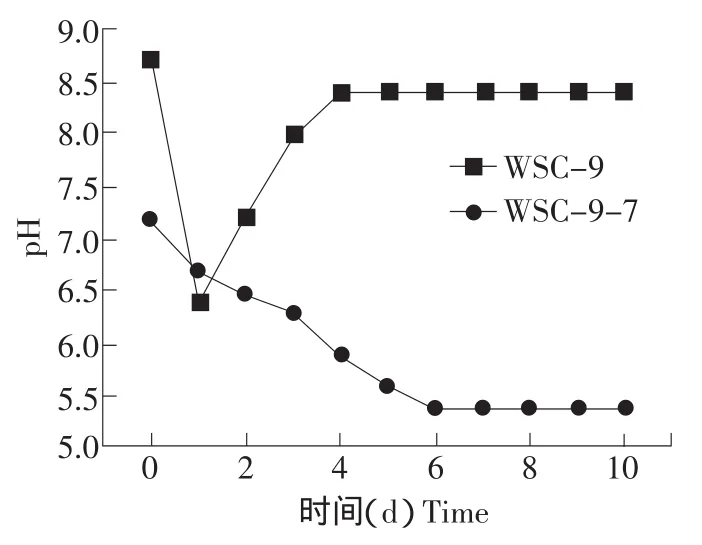
图3 WSC-9和WSC-9-7在培养过程中的培养基pH的变化Fig.3 Medium pH of WSC-9 and WSC-9-7 during the cultivation process
2.3 WSC-9-7形态特征
将WSC-9-7在分离培养基的琼脂平板上培养5 d,形成的菌落为边缘不光滑的圆形菌落,白色不透明。为革兰氏阳性。挑取分离培养基上的菌株,对菌体进行适当处理,在扫描电镜下观察菌体的形态及大小。菌体形态的扫描电镜图片,菌株为短杆状,产孢子(见图4)。
2.4 菌株WSC-9-7的16S rRNA序列的测定及系统发育树构建
测序得到菌株WSC-9-7的16S rDNA基因序列,含有1 407 bp,GenBank登录号JQ 404436。将菌株WSC-9-7的16S rDNA基因序列与GenBank中的序列进行比对,发现与Clostridium属具有较高相似性,构建系统发育树表明与FN563295亲缘关系密切,序列相似性达到99%,通过查找相关文献,FN563295为未培养的微生物(见图5)。

图4 菌株WSC-9-7的扫描电镜图片Fig.4 SEM photo of WSC-9-7

图5 厌氧菌株WSC-9-7的系统发育树Fig.5 Phylogenetic tree derived from partial 16S rDNA sequence

表2 与WSC-9遗传相似率相近的菌株信息Table 2 Information of close phylogenetic bacteria with WSC-9(%)
3 讨论与结论
a.WSC-9是1组以高温期牛粪堆肥为原料富集获得的具有高效稳定分解纤维素能力的细菌复合群体,本试验以复合菌系WSC-9为基础试验对象,为了研究其微生物组成,明确复合菌系间的微生物协同作用,分离获得复合菌系中的可有效降解纤维度的纯培养菌株。将Hungate厌氧操作技术进行适当改进,分离获得厌氧细菌WSC-9-7,可稳定高效降解纤维素。WSC-9-7在50℃下静止培养10 d,稻秆的总干重减少47%,纤维素减少57%,半纤维素减少31%,木质素减少12%。在以纤维二糖为碳源的分离培养基上,菌落为圆形,边缘不光滑,白色不透明,革兰氏染色阳性,能够利用纤维二糖、纤维素、滤纸、稻秆。经序列对比,与FJ907163和FN563295的相似性均达到99%,仅仅从系统发育学上判断,WSC-9-7属于Clostridium属。
b.自然界有很多可以分解纤维素的细菌,尤其是可以产生纤维小体[14]的厌氧细菌,对于纤维素的分解效率很高。经报道,这些厌氧细菌多分布于Clostridium属,而目前的手段和技术方法不能够完全分离这些厌氧生物。已经报道具有纤维素分解能力的细菌有Clostridium Thermocellum、C.Sterecorarium、 C.Thermopapyrolyticum、 C.Acetobutylicum、C.Cellulovorans、C.Cellulosi、C.Cellulolyticum、 C.Herbivorans、 Ruminococcus flavefaciens、Methanobacterium、Methanosarcina、Thermoanaerobium等[6]。从中,可以看出大部分为梭菌属、瘤胃球菌属和一些产乙醇的菌属。从系统进化树上,主要有三种:梭菌属、产乙醇的菌属和一些未获得纯培养的菌属。梭菌属的细菌多数为革兰氏染色阳性杆菌,能形成芽孢,厌氧条件下生长,部分嗜高温。细菌WSC-9-7的16S rDNA基因序列在NCBI的GenBank数据库中进行比对,发现WSC-9-7与登录号为FN563295的未培养菌株编号1相似率高达99%,用甜菜青贮和粪便进行中温厌氧发酵时,改变水力停留时间、有机负荷率、底物三个参数,分析发酵体系中微生物菌群的变化。在克隆结果中发现,Clostridium属一直存在于发酵中,编号1菌株就是其中一个。系统发育树上其它两株未培养的菌株均是在发酵中被检测到,它们分别是表中编号4、5的细菌,与WSC-9-7的相似率分别为93%、95%。将1、4、5均归为Clostridium属。WSC-9-7与编号2和3菌株的相似率较1号菌株次之,分别为99%和98%,均属于Clostridium属,但相关介绍尚未公开发表,无法获得具体数据。只有来源可供参考:2号菌株从中国大港油田的地下岩层中获得,3号菌株获得于冰岛的热泉中,均嗜高温厌氧条件下生长。6号细菌的具体数据也尚未公开发表,只知其来源于湿地,厌氧条件下生长。7号菌株是Rees等[15]在厌氧发酵中获得一株Clostridium属的专性厌氧细菌,可降解纤维素产乙醇、乙酸等。8号菌株是Collins等[16]和Stackebrandt[17]分别提到其属于Clostridium属中的第IV簇,可以降解纤维素类物质。9号菌株是Nanqi Ren等通过Hungate技术分离获得,其可在22~44℃下利用木质纤维素、葡萄糖等产乙醇、乙酸、氢气、二氧化碳等[18]。Kato等从纤维素降解复合系CSK1中分离获得1株梭杆菌即10号菌株,它在50~55℃下可以分解纤维素,被命名为Clostridium stramini-solvens sp.nov.,在氧浓度高至4%时还能分解纤维素,所以认为其生长条件不严格厌氧[12]。
通过系统发育树,WCS-9-7与1、2、3的相似率最高为99%、99%、98%,就理化性质而言,它们还是有差别的:1是28~35℃的中温发酵中存在,WCS-9-7与2、3均嗜高温50~60℃。相似率在95%以下的菌株,7、8、9、10均可利用纤维素类物质产乙醇、乙酸等物质,这与WCS-9-7的理化性质相近。综述以上,初步判定WSC-9-7可能属于Clostridium属中的一个新种。但是其确切的分类地位还有待用DNA分子杂交的技术手段配以菌种生理生化性质鉴定作进一步鉴定。
c.WCS-9-7对纤维素的降解效果明显低于复合系WSC-9,推测在复合系中厌氧菌负责降解纤维素,好氧细菌为厌氧菌维持生长环境,并可能利用纤维素分解菌的产物解除反馈抑制,好氧菌的存在可以帮助厌氧细菌更完全地降解纤维素。另外,复合菌系降解木质纤维素时可以保持发酵体系的pH处于偏碱性,而纯菌株则是5.0,本试验为研究复合菌系分解纤维素的机理奠定基础。
[1]Malherbe S,Cloete T E.Lingocellulose biodegradation:Fundaments and applications[J].RV/Views in Environmental Science and Bio/Technology,2002(1):105-114.
[2]Zeng Guangming,Zhang Jiachao,Chen Yaoning,et al.Relative contributions of archaea and bacteria to microbial ammonia oxidation differ under different conditions during agricultural waste composting[J].Bioresource Technology,2011,102:9026-9032.
[3]王伟东,王小芬,李玉花,等.复合系WSC-6的菌种组成特性及其木质纤维素分解能力[J].农业工程学报,2007,23(10):210-215.
[4]崔宗均,李美丹,朴哲,等.一组高效稳定纤维素分解复合系MC1的筛选及功能[J].环境科学,2002,23(3):36-39.
[5]Haruta S,Cui Z,Igarashi Y,et al.Construction of a stable microbial community with high cellulose-degradation ability[J].Appl Microbiol Biotechnol,2002,59:529-534.
[6]王伟东.木质纤维素快速分解菌复合系及有机肥微好氧工艺[D].北京:中国农业大学,2005.
[7]Weidong Wang,Lei Yan,Zongjun Cui,et al.Characterization of a microbialconsortium capableofdegradinglignocellulose[J].Bioresource Technology,2011,102:9321-9324.
[8]刘长莉.木质纤维素分解复合菌群NSC-7菌种组成及种间协作机理[D].哈尔滨:东北林业大学,2008.
[9]Thomas Bell,Jonathan A Newman,Bernard W Silverman,et al.The contribution of species richness and composition to bacterial services[J].Nature,2005,8(25):1157-1160.
[10]Robert H Madden.Isolation and characterization of Clostridium stercorarium sp.Nov.,cellulolytic thermophile[J].International Journal of Systematic Bacteriology,1983(11):837-840.
[11]Susan B Leschine.Cellulose degradation in anaerobic environments[J].Annu Rev,Microbiol,1995.49:399-426.
[12]Kato S,Haruta S,Igarashi Y,et al.Clostridium straminisolvens sp.nov.,a moderately thermophilic,aerotolerant and cellulolytic bacterium isolated from a cellulose-degrading bacterial community[J].International Journal of Systematic and Evolutionary Microbiology,2004,54:2043-2047.
[13]Heijthuijsen J H F G,Hansen T A.Interspecies hydrogen transfer in co-cultures of methanol-utilizing acidogens and sulfatereducing or methanogenic bacteria[J].FEMS Microbiology Ecology,1986,38:57-64.
[14]Lamed R,Kenig R,Setter E,et al.Major charac-teristics of the cellulolytic system of Clostridium thermocellum coincide with those of the purified cellulosome[J].Enzyme Microb Technol,1985,7(1):37-41.
[15]Gavin N Rees,Fred A Rainey,Christopher G Harfoot.Characterization of a novel obligate anaerobe that ferments agar[J].Arch Microbiol,1994,162:395-400.
[16]Collins M D,Lawson P A,Willems A,et al.The phylogeny of the genus Clostridium:Proposal of five new genera and eleven new species Combinations[J].International Journal of Systematic Bacteriology,1994(11):812-826.
[17]Strackebrandt E,Kramer I,Swiderski J,et al.Phylogenetic basis for a taxonomic dissection of the genus Clostridium[J].FEMS Immunology and Medical Microbiology,1999,24:253-258.
[18]Xing Defeng,Ren Nanqi,Li Qiubo,et al.Ethanoligenens harbinense gen.nov.,sp.nov.,isolated from molasses wastewater[J].International Journal of Systematic and Evolutionary Microbiology,2006,56:755-760.
