酶解水提法从胡萝卜中提取水溶性β-胡萝卜素
2013-02-19张玮玮武彦文欧阳杰
张玮玮 , 武彦文 , 欧阳杰 *
(1.北京林业大学 生物科学与技术学院,北京100083;2.林业食品加工与安全北京市重点实验室,北京林业大学,北京100083;3.北京市理化分析测试中心,北京100089)
类胡萝卜素是广泛存在于植物中的一大类天然色素,其可用作药品、膳食补充剂或食品添加剂。作为天然食用色素,类胡萝卜色素被广泛用于饮料、焙烤食品、人造黄油、奶酪、和肉制品等。类胡萝卜素新的生物学功能包括激活编码蛋白质产物信息的基因以及调节脂氧和酶活力、降低心血管疾病风险以及加强艾滋病患者的免疫标志等[1]。类胡萝卜素由八个异戊二烯单位相连而成,当吸收了光能的时候,相连双碳键的电子容易被激活而使其结构受到破坏[2]。自然界的类胡萝卜素常以共价键或者微弱的关系与蛋白质结合而形成稳定的复合物,从而保护它免受氧化或其它因素的降解并且影响着其颜色[3]。已经确定了类胡萝卜素复合体存在于无脊椎动物[4-6],水藻[7]和蓝细菌[8-10]中。目前对于类胡萝卜素-蛋白质复合物研究较多的是植物细胞叶绿素内类胡萝卜素以及动物细胞内虾青素,包括复合物的存在形式和作用机制等。Bryant等人通过对胡萝卜中的色素细胞进行溶解、分离以及凝胶过滤,最后得到了一种包含α-和β-类胡萝卜素的胡萝卜素蛋白,并证明其色素蛋白复合物相对分子质量超过两百万,同时证明了由于色素和蛋白质结合,使得其吸收谱图和其在水中的溶解性发生了变化[11]。Britton等人证明了虾青素蛋白的亚单位由两个虾青素分子和两个β-甲壳蓝蛋白结合而成,结合后的色素蛋白呈现其特有的青色[12]。
胡萝卜肉质根中含有多种类胡萝卜素,不同颜色品种含有的类胡萝卜素不同。白色类型不含色素,黄色类型主要含有黄色色素,特别是叶黄素,橘色类型主要含有α-和β-胡萝卜素,红色类型主要含有番茄红素和β-胡萝卜素,紫色类型含有多种花青素,α-和β-胡萝卜素[13]。从植物原料中提取类胡萝卜素的方法主要采用有机溶剂提取的方法,提取出来的油溶性类胡萝卜素在生物体外非常不稳定,在光、热、碱等条件下容易降解。因此如何能从植物细胞中提取稳定性较好、呈自然状态的类胡萝卜素-蛋白质复合物值得关注。迄今为止,利用纤维素酶和果胶酶破坏植物细胞壁提取类胡萝卜素的研究较少。Barzana等人向金盏花中加入果胶酶、中性蛋白酶以及H-蛋白水解酶的方法,得到了得率高于85%的类胡萝卜素[14];Mannel等人利用非商业酶从红辣椒中提取辣椒素和类胡萝卜素,得率分别为96%和85%[15];Navarrete-Bolanos等人利用非商业酶制剂从金盏花中提取叶黄素,得率为29.3 g/kg[15]。同时超声波也能起到帮助破碎细胞壁的作用,并且超声波辅助提取技术具有节省成本、提取速度快、工艺可行等特点[17],因此在提取过程中可以考虑通过超声辅助破壁的方法提高提取率。赵锡兰在利用超声波浸取法提取枸杞中类胡萝卜素方法优化中证明了超声波浸取法简单、提取、提取收益高的特点,适用于植物中类胡萝卜素的提取[18]。本研究通过对纤维素酶用量、果胶酶用量、酶解时间、酶解pH、酶解温度以及超声波辅助破碎细胞的时间等因素进行单因素实验和响应面分析,从而得出酶解水提法从胡萝卜中提取水溶性β-胡萝卜素-蛋白质复合物的较优工艺条件。
1 材料与方法
1.1 材料、试剂与仪器
鲜胡萝卜:购自北京农贸市场。
β-胡萝卜素标准品:购自Sigma公司;纤维素酶(1 059 U)、果胶酶(100 U):购自北京奥博星生物技术有限责任公司;正己烷、吐温-80:均为分析纯,北京化学试剂公司。
752 SPECTROPHOTO METER:上海美谱达仪器有限公司;雷磁 PHS-3C pH计:上海精密科学仪器有限公司;JAC-IV型超声波细胞破碎仪:济宁市奥波超声波电气有限公司。
1.2 实验方法
1.2.1 β-胡萝卜素标准曲线 称取0.013 g β-胡萝卜素标准品,溶于正己烷,定容至500 mL容量瓶中,制得26 μg/mL的β-胡萝卜素标准溶液,分别吸取 4、7、9、12、14 mL 标准液, 用正己烷定容至 50 mL,于450 nm处测吸光值,以正己烷为空白,得出标准曲线为 OD450nm=0.135 6c+0.004,R2=0.999,其中c为β-胡萝卜素质量浓度,单位是μg/mL。本实验在计算水溶性β-胡萝卜素提取率时,以油溶β-胡萝卜素计算,所计算结果为β-胡萝卜素-蛋白质复合物中的色素部分,见图1。
1.2.2 从胡萝卜中提取水溶性β-胡萝卜素的方法每组实验取鲜胡萝卜50 g,切碎、打浆,再加入100 mL 0.2 g/100 mL的吐温-80溶液,加入适量纤维素酶和果胶酶,经超声波破碎后,调节pH值,于一定温度下搅拌一定时间,加入2 g硅藻土,抽滤,测定滤液在450 nm下的吸光度,根据标准曲线计算出提取率。
提取率 (μg/g)=(OD450nm-0.004)×滤液体积/0.135 6×50

图1 β-胡萝卜素标准曲线Fig.1 Standard curve of β-carotene
1.2.3 单因素实验 进行单因素实验,其中果胶酶的用量分别为 0.1、0.2、0.4、0.5、1.0、1.5、2.0 g, 纤维素酶的用量分别为 0.1、0.2、0.3、0.4、1.0、1.5、2.0 g,酶解时间分别为 1、2、3、4、6、8、10 h,超声波辅助破碎时间分别为 0、10、20、30、40、50、60 min,酶解 pH分别为 4.0、4.3(未调)、5.0、6.0、7.0,酶解温度分别为 30、35、40、45、50 ℃。
1.2.4 响应面分析因素水平的选取 采用三因素三水平设计,因素A为果胶酶用量,3个水平分别为0.3、0.4、0.5 g; 因素 B为酶解 pH,3个水平分别为5.5、6.0、6.5;因素C为超声波时间,3个水平分别为30、40、50 min,见表 1。

表1 响应面分析因素及水平Table 1 Factors and levels of response surface quadratic model
2 结果与分析
2.1 果胶酶用量对提取率的影响
取50 g萝卜直接打浆,加入100 mL 0.2 g/dL的吐温-80溶液,再加入1 g纤维素酶和不同量果胶酶,搅拌24 h,加入2 g硅藻土后抽滤,计算提取率。
由图2可知,当果胶酶添加量较低时,色素提取率随着果胶酶用量而增强,超过0.4 g后,提取曲线基本趋于平缓,因此,为节约提取成本,在实际提取时,应控制果胶酶用量在0.4 g。

图2 果胶酶用量对提取率的影响Fig.2 Effect of pectinase quantity on extraction yield
2.2 纤维素酶用量对提取率的影响
取50 g萝卜直接打浆,加入100 mL 0.2 g/dL的吐温-80溶液,再加入0.4 g果胶酶和不同量纤维素酶,搅拌24 h,加入2 g硅藻土抽滤,计算提取率。
由图3可知,当纤维素酶添加量较低时,色素提取率随着纤维素酶用量而增强,超过1.5 g后,提取曲线基本趋于平缓,因此,为节约提取成本,在实际提取时,应控制纤维素酶用量在1.5 g。

图3 纤维素酶用量对提取率的影响Fig.3 Effect of cellulase quantity on extraction yield
2.3 酶解时间的影响
取50 g萝卜直接打浆,加入100 mL 0.2 g/dL的吐温-80溶液,再加入1.5 g纤维素酶和0.4 g果胶酶,搅拌不同时间,加入2 g硅藻土抽滤,计算提取率。
由图4可知,酶解2 h相对于1 h提取率提高了8.95%,但是在2 h之后,提取率没有明显变化,因此在实际提取中,为了节省时间,将提取时间控制在2 h。

图4 酶解时间对提取率的影响Fig.4 Effect of hydrolysation time on extraction yield
2.4 超声波时间的影响
取50 g萝卜直接打浆,加入100 mL 0.2 g/dL的吐温-80溶液,再加入1.5 g纤维素酶和0.4 g果胶酶,以70 W的超声功率超声破碎不同时间后,搅拌提取2 h,加入2 g硅藻土抽滤,计算出提取率。
由图5可知,在40 min以内,提取率随着超声波时间的延长而增大,超过40 min之后,提取率不再增加,因此在实际的提取操作中,应将超声波时间控制在40 min。
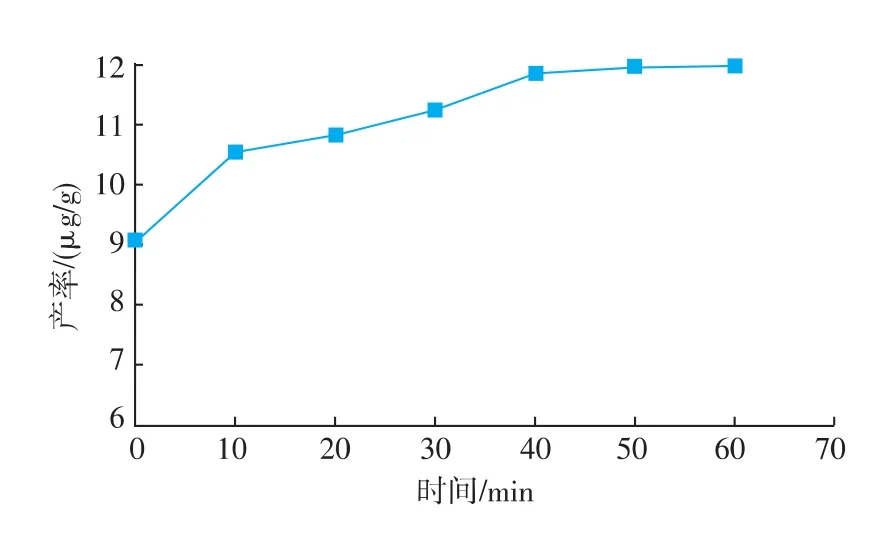
图5 超声波时间对提取率的影响Fig.5 Effect of ultrasonic time on extraction yield
2.5 酶解pH的影响
取50 g萝卜直接打浆,加入100 mL 0.2 g/dL的吐温-80溶液,再加入1.5 g纤维素酶和0.4 g果胶酶,分别将溶液调至不同pH,以70 W的超声功率超声40 min后,再搅拌提取2 h,加入2 g硅藻土抽滤,计算提取率。
由图6可知,当pH<6时,提取率随着pH增加而逐渐增加,pH为6时达到最大值,之后随着pH的降低而降低。从现象上看,当pH=8时,酶解后溶液中存在较多胡萝卜颗粒,无法进行充分的水解破壁以及有效的抽滤提取,因此在实际的提取操作中,应将酶解pH控制为6.0。

图6 酶解pH对提取率的影响Fig.6 Effect of pH on extraction yield
2.6 酶解温度的影响
取50 g萝卜直接打浆,加入100 mL 0.2 g/dL的吐温-80溶液,再加入1.5 g纤维素酶和0.4 g果胶酶,将溶液pH调至6.0,以70 W的超声功率超声40 min后,将样品至于不同温度的水浴锅中,电动搅拌提取充分时间,加入2 g硅藻土抽滤,计算出提取率。
由图7可知,酶解的最适温度为40℃,提取率随着温度呈抛物线状变化,当温度达到40℃时提取率最大,因此在实际的提取操作中,将提取温度控制在40℃。

图7 酶解温度对提取率的影响Fig.7 Effect of hydrolysation temperature on extraction yield
2.7 响应面法优化酶解条件
由单因素实验发现,果胶酶用量、超声波时间和酶水解pH对β-胡萝卜素的提取率影响较大,因此对这三个因子进行响应面分析。
2.7.1 模型方程与显著性检验 对果胶酶用量A、超声波时间B、和酶水解pH做变换如下:X1=(A-0.4)/0.1,X2=(B-6)/0.5,X3=(C-40)/10, 以 X1,X2,X3为自变量,以β-胡萝卜素提取率为响应值(Y),实验方案及结果见表2,回归方程分析结果见表3。
17个实验分为析因实验和中心实验,其中1-12组为析因实验,13-17组为中心实验,其中析因点为自变量取值在X1,X2,X3所构成的三维定点,零点区域为中心点,零点试验重复5次,以估计试验误差。采用通过Design-Expert软件对表2试验数据进行二次多项回归拟合,获得回归方程为:Y=12.60+1.09X1+0.47X2+0.44X3+0.11X1X2-0.065X1X3+0.11X2X3-2.04X12-1.94X22-1.28X32。

表2 响应面分析方案及实验结果Table 2 Experiment project and outcome for response surface quadratic model

表3 回归方程系数及显著性实验Table3 Analysisofvariance forresponse surface quadratic model
表3的回归方差分析显著性检验表明,该回归模型显著,失拟项不显著,并且该模型的R2=0.970 8,Adj R2=0.933 3,说明该模型与实际试验拟合较好,自变量与响应值之间线性关系显著,可以用于胡萝卜中β-胡萝卜素提取的理论预测。
2.7.2 响应面分析 固定回归方程的不同因素,做出相应的曲面图,由图8~10可以看出,果胶酶含量(A)对β-胡萝卜素的影响最显著,表现为曲线较陡,而超声波时间和水解pH次之,表现为曲线较平缓,随其数值的增加或减少,响应面数值变化较小。果胶酶用量和超声波时间的增加能提高β-胡萝卜素提取率,并且其影响在一定值后达到饱和,而随着pH值的增加,β-胡萝卜素的提取率呈现先增加后降低的趋势,这是因为酶水解需要最适的酸碱环境。
由响应面分析的结果可知,该模型的最大值点为:果胶酶用量为0.49 g,酶解pH 6.08,超声波时间为 41.58 min,β-胡萝卜素的最大提取率为 12.23 μg/g。

图8 A-B相互影响的响应面Fig.8 Response surface of A-B

图9 A-C相互影响的响应面Fig.9 Response surface of A-C

图10 B-C相互影响的响应面Fig.10 Response surface of B-C
2.7.3 响应面分析验证实验 按照响应面分析得出的较优提取条件,做了四组平行验证实验。结果表明,在稳定点上四组实验得到的β-胡萝卜素提取率分别是 12.01、11.89、11.97、11.63 μg/g,平均值为11.87 μg/g,与模型的理论值相差2.94%,可见该模型能较好地反映胡萝卜中β-胡萝卜素提取的条件。
3 结语
利用酶解水提法从胡萝卜中提取水溶性β-胡萝卜素的较优工艺条件为:果胶酶量0.4 g,纤维素酶量1.5 g,酶解时间2 h,超声波时间40 min,酶解pH 6,酶解温度40℃。利用Design Expert 7.0软件,采用Box-Behnken建立酶法水解从胡萝卜中提取β-胡萝卜素的回归模型,方程拟合良好。在酶法水解从胡萝卜中提取类胡萝卜素的过程中,果胶酶量是影响类胡萝卜素提取率的最关键因素,各提取因素对类胡萝卜素提取率的影响顺序为果胶酶量>超声波时间>酶解pH。较优提取工艺为:果胶酶量0.49 g,酶解 pH 6.08,超声波时间 41.58 min,在此条件下预期的类胡萝卜素得率是12.23 μg/g。以酶解水提的方法从胡萝卜中提取的是水溶性的β-胡萝卜素-蛋白质复合物,与其在细胞内的存在状态一致,因此下一步的研究可以比较其和油溶性β-胡萝卜素对光、热、金属离子、pH变化等的稳定性差别,并且研究该复合物的生化性质,如相对分子质量、等电点、β-胡萝卜素和蛋白质的摩尔比、蛋白质部分的分子结构等等。
[1]Canfield L,Krinsky N,Olson J.Carotenoids in human health[J].Ann NY Acad Sci,1993,691.
[2]Thomas R L,Deibler K D,Barmore C R,et al.Extraction of pigment from plant material[P].US Patent:5830783,1998-11-03.
[3]Bassi R,Pineau B,Dainese P,et al.Carotenoid-binding proteins of photosystem II[J].Eur J Biochem,1993,212:297-303.
[4]Zagalsky P F.Carotenoid-protein complexes[J].Pure Appl Chem,1976,47:103-120.
[5]Rivas J D L,Milicua J C,Gomez R.Further studies on the blue carotenoprotein from Astacusleptodactylus[J].Comp Biochem Phys B,1988,89:65-68.
[6]Zagalsky P F,Haxo F,Hertaberg S,et al.Studies on a blue carotenoprotein,Linchiacyanin,isolated from the starfish Linckia laeuigata(Echinodermatai asteriodea)[J].Comp Biochem Phys B,1989,93B:339-342.
[7]Powls R,Britton G.A carotenoprotein-containing violaxanthin isolated from Scenedesmus obliquus Ds[J].Biochim Biophys Acta,1976,453:270-273.
[8]Bullerjahn G S,Sherman L A.Identification of a carotenoidbinding protein in the cytoplasmic membrane from the heterotrophic cyanobacterium Synechocystis Sp strain PCC6714[J].Bacteriol,1986,167:396-399.
[9]Russo V E A.Are carotenoids the blue-light photoreceptor in the photo-induction of protoperithecia in Neurophora crassa?[J].Planta,1986,168:56-60.
[10]Masamato K,Riethman H C,Sherman L A.Isolation and characterization of a carotenoid-associated thylakoid protein from the Cyanobacterium anacystis nudulans R2[J].Plant Physiol,1987,84:633-639.
[11]Bryant J D,Jeff D,Mccord L K U,et al.Isolation and partial characterization of α-and β-carotene-containing carotenoprotein from carrot(Daucus carota L.) root chromoplasts[J].J Agr Food Chem,1992,40:545-549.
[12]Britton G, Weesie R J,Askin D,et al.Carotenoid blues:Structural studies on carotenoproteins[J].Pure Appl Chem,1997,69(10):2075-2084.
[13]邱杨,庄云飞.萝卜胡萝卜100问[J].北京:中国农业出版社,2009:40-41.
[14]Barzana E,Rubio D,Santamria R I,et al.Enzyme-mediated solvent extraction of carotenoids rrom marigold flower(Tagetes erecta) [J].J Agr Food Chem,2002,50:4491-4496.
[15]Salgado-Roman M,Botello-Alvarez E,Rico-Martine R,et al.Enzymatic treatment to improve extraction of capsaicinoids and carotenoids from chili(Capsicum annuum) fruits[J].J Agr Food Chem,2008,56:10012-10018.
[16]Navarrete-Bolanos J L,Nezislas H J,Botello-Alvarez E,et al.Improving xanthophyll extraction from marigold flower using cellulolytic enzymes[J].J Agr Food Chem,2004,52:3394-3398.
[17]刘春辉,周亚平,祝军,等.苹果果肉中原花青素超声波的辅助浸提[J].食品与生物技术学报,2008,27(1):80-83.LIU Chun-hui,ZHOU Ya-ping,ZHU Jun,et al.Ultrasonic-assisted extraction of proanthocyanidin form apple flesh[J].Journal of Food Science and Biotechnology,2008,27(1):80-83.(in Chinese)
[18]赵锡兰.超声浸取法提取枸杞中类胡萝卜素方法优化[J].宁夏医学杂志,2010,32(5):424-425.Optimize the methods of leaching and extracting the carotenoids in Fructus lycium barbatum L.with ultrasound[J].Ningxia Med,2010,32(5):424-425.(in Chinese)
