易错PCR技术提高中性内切葡聚糖酶活性
2013-02-19唐自钟韩学易姚友旭刘默洋晋海军
唐自钟, 刘 姗, 韩学易, 姚友旭, 刘默洋,陈 惠,晋海军, 吴 琦, 单 志
(四川农业大学 生命科学与理学院,四川 雅安625014)
近年来,随着纤维素在生产糖、工业酒精、生物质能源替代等应用领域的飞速发展,纤维素酶的市场前景和应用价值更加广阔了。虽然天然纤维素酶种类较多,但由于其催化活性低、生产成本高以及催化条件苛刻等因素,真正能够用于工业生产的却很少。几十年来通过传统的诱变育种技术已获得许多纤维素酶高产菌株,已用于大规模生产,但它们的产酶能力还远远满足不了日益增大的市场需求[1]。高成本、低酶活已成为制约纤维素酶广泛应用的两大瓶颈,通过基因工程及蛋白质工程在分子水平上对纤维素酶基因进行改造,构建高效表达高活性纤维素酶的基因工程菌,降低纤维素酶生产成本和实用性,成为国内外研究的热点之一。
天然中性或碱性纤维素酶虽然种类较多,但是真正能够用于工业生产的却很少,很多纤维素酶虽然最适pH为碱性,但是酶活太低,远远达不到工业应用的要求。近年来一些学者通过分子生物学和蛋白质工程等手段对其进行定向进化,并达到了一定预期效果,为在分子水平和蛋白水平上解释纤维素酶的作用机理以及进一步改良纤维素酶的催化特性奠定了理论基础和技术指导。定向进化技术是通过人为创造特殊的进化条件,模拟天然进化机制,在体外对基因进行广泛的突变,从一个或多个人工突变酶库中通过一定筛选或选择方法最终获得预先期望的具有某些特性的进化酶[2]。易错PCR以其操作简便、有效等优点成为目前应用最为广泛的进化手段之一[3]。近几年来,有关内切葡聚糖酶定向进化的研究报道较多,主要集中在最适pH和热稳定性等酶学性质改造方面[4-6],酶活性提高方面也有报道[7-9]。作者通过定向进化策略对来自枯草芽胞杆菌C-36的中性内切葡聚糖酶基因(GenBank Accession No:DQ782954)进行定向进化,通过高通量筛选手段获得了高酶活的的突变体,并对获得的突变体酶的三级结构进行模建,分析了酶三级结构变化与酶活之间的关系以及最佳突变株的蛋白表达情况和酶的酶学性质。同时,获得的内切葡聚糖酶基因可进一步在酵母,芽胞杆菌等高表达系统表达,获得可以应用于工业生产的菌株。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 菌株与载体列于表1。
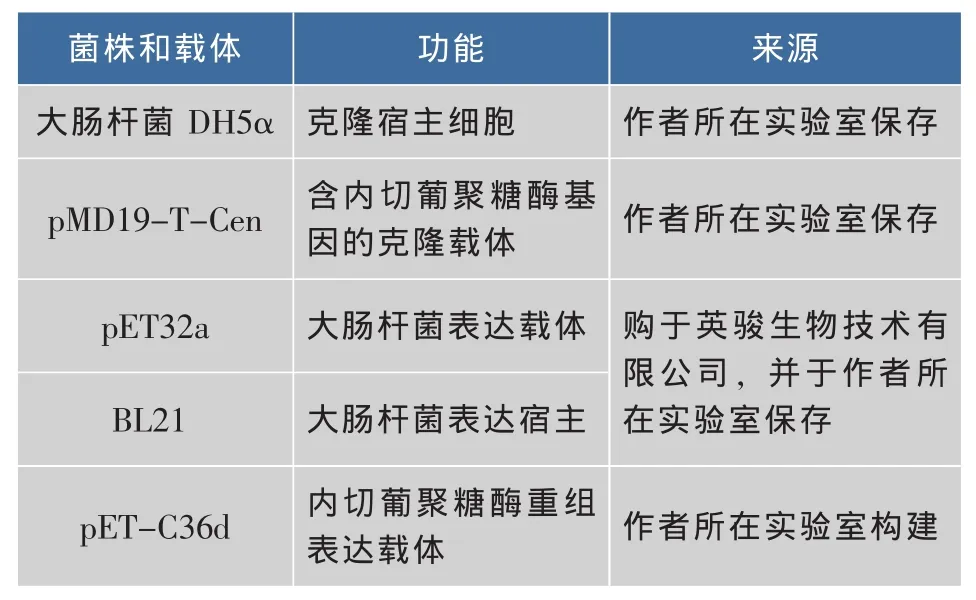
表1 菌株与载体Table 1 Strains and vectors
1.1.2 酶和试剂 限制性内切酶、T4 DNA连接酶、Taq DNA聚合酶:购自大连宝生物公司;DNA marker:购自天根生化科技有限公司;PCR纯化试剂盒及质粒纯化试剂盒:购自美国OMEGA公司;MnCl2:购自美国Sigma公司;其他试剂均为进口试剂或国产分析纯。
1.2 方法
1.2.1 易错PCR扩增及突变体库的构建 根据已知的枯草胞芽杆菌(B.subtilis)C-36的内切葡聚糖酶基因(GenBank Accession No:DQ782954)去除信号肽的部分设计引物:Upstream primer:(5’-TAATCCAACCCGGAATTCGCAGAGACAAAAACGC CAGTAGC-3’) Downstream primer:(5’TAGGAAAG GAAAAAAGCGGCCGCCTAATTTGGTTCTGTTCCCC AAA-3’),由上海英骏公司合成,扩增的片段大小为1 413 bp。
以质粒pMD19-T-Cen为模板,反应体系为:14 μL 25 mmol/L MgCl2;5 μL 10xTaq PCR buffer;5 μL 10 X易错 dNTP混合物 (2 mmo/L dGTP,2 mmol/L dATP ,10 mmol/L dCTP和 10 mmol/L dTTP); 引物各 30 pmol;0.5 μL 的 10 mmol/L MnCl2; 模 板 20 pmol;Taq DNA聚合酶为2.5 U,超纯水至总体积为50 μL。PCR程序为:95℃预变性4 min;94℃变性1 min,51 ℃退火 1 min,72℃延伸 2 min,30个循环后,72℃ 延伸10 min,16℃保存。
PCR产物经质量分数1%琼脂糖凝胶电泳后,纯化回收目的条带。纯化后的产物和pET32a载体经EcoR I和 Not I双酶切过夜后回收,载体回收5.9 kb片段,目的基因回收1.4 kb片段,回收后的产物按比例混合后加入T4 DNA连接酶连接过夜,转化大肠杆菌BL21(DE3)感受态细胞,涂布固体LB(含100 μg/mL的Amp)平板,抗性筛选阳性转化子,此即构建好的内切葡聚糖酶基因突变体库。
1.2.2 阳性克隆的初筛及鉴定 将阳性转化子转移到另一个划线的LB固体培养基 (含100 μg/mL氨苄青霉素)上面(P1),并同时复制到另一个含有CMC-Na并加入IPTG终浓度为1 mmol/L诱导固体培养基(P2)上面,P1平板37℃培养过夜,挑取P1平板上面的菌株用pET32a的通用引物T7进行菌落PCR鉴定。将P2平板37℃培养3 d进行刚果红染色筛选。用刚果红染色法筛选出水解圈较大的转化子,初步鉴定为阳性转化子。挑取水解圈较大的阳性转化子接种到10 mL LB液体培养基 (含100 μg/mL氨苄青霉素)37℃,170 r/min培养过夜,按体积分数1%接种量接种至25 mL培养基中,37℃培养至A值为0.6~0.8,为加入IPTG使其终浓度1 mmol/L诱导培养3 h。酶活的测定,将25 mL菌液,4℃,4 000 r/min离心10 min,磷酸盐缓冲液1 mL(1/15 mol/L pH 6.81)重悬菌体,超声破碎裂解细胞,裂解液8 000 r/min离心10 min,取上清液一定比例稀释后作为粗酶液测定酶活力。并在相同条件下测定原始菌和突变株,重复测定3次,每次2个平行,统计数据。
酶活测定参照农业部标准略做改进[10]。以1 mL 0.8%的羧甲基纤维素钠 (用1/15 mol/L pH 6.8磷酸盐缓冲液配制)为底物,加入1 mL粗酶液,50℃水浴反应30 min后,加入2.5 mL DNS显色液,沸水浴煮5 min,取出后在流水下迅速冷却后定容至25 mL摇匀,在540 nm处测定吸光值。在此实验条件下,1 mL酶液每分钟产生1 μmol还原糖的酶量作为1个酶活单位,用U/mL表示。
1.2.3 突变基因序列分析及结构预测和突变位点分析 高酶活力突变株PCR及酶切验证正确后送上海英骏公司进行序列测定。测序结果进行BLAST序列比对,找出突变碱基位点和氨基酸突变。通过在线分子建模系统SWISS-MODEL(http://swissmode1.expasy.org/)预测内切葡聚糖酶成熟蛋白的三维结构[11]根据预测的结构信息,运用DeepView (Swiss-PdbViewer Version 4.0)软件分析突变位点的突变效应。
1.2.4 突变株内切葡聚糖酶的SDS-PAGE分析取诱导表达后的菌悬液及不含有内切葡聚糖酶基因的空载体菌悬液,按测酶活的方法处理获得粗酶液,取粗酶液加入2×SDS-PAGE电泳上样缓冲液混匀,沸水浴处理3~5 min,冷却,离心后用于 SDSPAGE凝胶进行凝胶电泳分析,操作过程见文献[12]。
1.2.5 突变株F-10内切葡聚糖酶酶学性质分析
1)突变株F-10内切葡聚糖酶的最适反应pH和pH稳定性 以1 mL不同pH值的羧甲基纤维素钠(CMC-Na)溶液为底物,测定酶活,确定酶的最适反应pH。将原酶液置于不同pH值的缓冲液于50℃保温30 min,在最适pH值条件下测定残余酶活力从而测定pH稳定性[13]。
2)突变株F-10内切葡聚糖酶的最适反应温度及热稳定性 在最适反应pH环境下,将适当稀释的酶液分别在不同温度梯度下测定酶活,确定酶的最适反应温度。将适当稀释的酶液置于相对稳定的pH值,分别在不同温度梯度下保温30 min,再在50℃测定残余酶活力[13]。
2 结果与分析
2.1 易错PCR扩增及突变体库的构建
一般易错PCR的过程中都要提高Mg2+浓度,并加入Mn2+,以提高PCR过程中的突变率。通过调整两种离子的浓度,可以获得合适突变频率的多样性文库。经过条件的初步摸索,最终确定加入终浓度为 7 mmol/L Mg2+和0.5 mmol/L Mn2+为最适的突变条件。终浓度为7 mmol/L Mg2+和0.5 mmol/L Mn2+为最适的突变条件。扩增得到中性内切葡聚糖酶基因片段为1 400 bp的条带,如图1
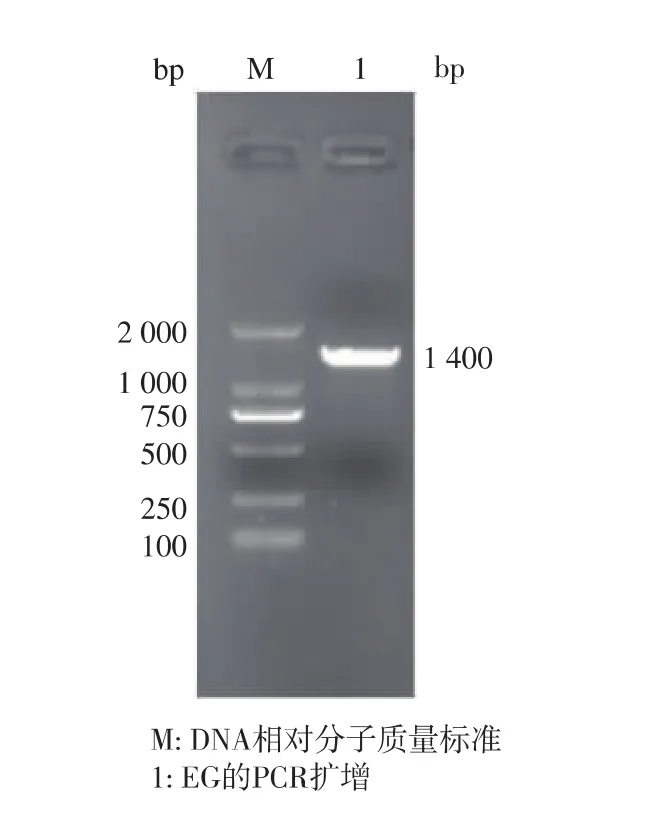
图1 易错PCR的电泳图Fig.1 Patterns of error-prone PCR
PCR纯化产物和pET32a(+)载体分别经EcoR I和Not I双酶切过夜纯化回收后16℃连接过夜,转入大肠杆菌BL21 (DE3), 含100 μg/mL的Amp平板抗性筛选后获得易错PCR转化子2 000~3 000株,所有转化子构成内切葡聚糖酶基因突变体库。
2.2 阳性克隆的初筛及鉴定
利用通用引物T7进行菌落PCR结果显示每一个阳性转化子均扩增出1 400 bp的条带,说明其中性内切葡聚糖酶基因已成功导入到BL21菌株中,对P2平板诱导3 d后进行1 mg/mL的刚果红溶液,染色30 min,再用1 mol/L的NaCl溶液洗涤多次。若转化子具有酶活性,则菌落周围会出现清晰的淡黄色透明圈,透明圈直径与菌落直径的比值越大说明转化子酶活越高[14],如图2。筛选得到一株高酶活的阳性转化子,命名为F-10。
挑取F-10突变体,进行扩大培养后,并将原始菌进行同时诱导培养,经超声波破碎后利用上清测酶活,结果见表2。其羧甲基纤维素钠水解活力分别为(4.2±0.13)U/mL,该突变株平均酶活相比野生型内切葡聚糖酶的 (0.98±0.10)U/mL分别提高了4.2倍(表 2)。
2.3 突变基因序列分析及结构预测和突变位点分析
突变基因的序列分析见表3,F-10基因共有5个碱基发生了突变,其中有3个是转换,只有2个是颠换,3个转换也均发生在A、T之间,2个颠换也均发生在A、G之间。
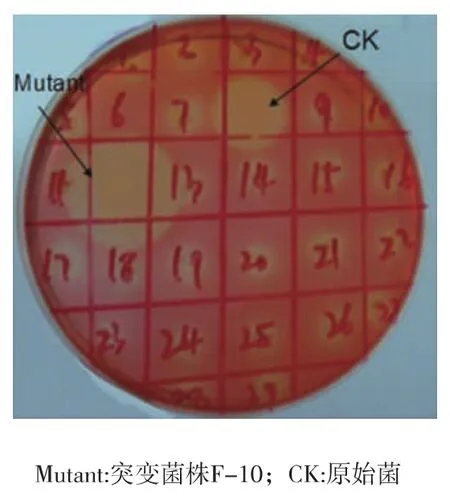
图2 刚果红平板筛选结果Fig.2 Screening result in Congo red staining plates
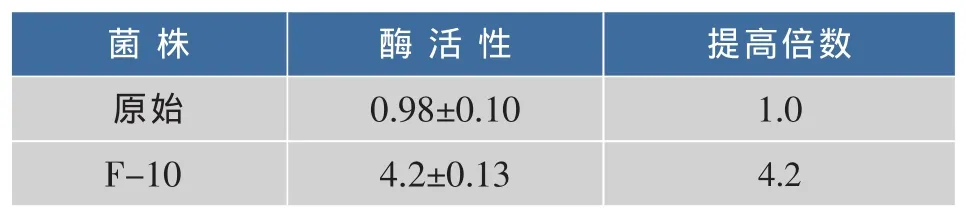
表2 相对酶活性Table 2 Relative enzymatic activity

表3 突变体的测序结果Table 3 Sequencing results of the mutants
运用并Swiss-model模拟内切葡聚糖酶的三维空间模型,分别以蛋白质结构数据库中的Bacillus agaradhaerens纤 维 素 催 化 结 构 域 (7a3h)和Clostridium cellulolyticum的纤维素结合结构域(1G43)为模型,模拟出内切葡聚糖酶的催化结构域(cellulase domain,CD)和结合结构域(carbohydratebinding domain,CBD)的三维结构图,预测结果显示枯草芽胞杆菌内切葡聚糖酶的催化结构域包含294个氨基酸残基(aa36-329),属于糖基水解酶第五家族,具有典型的 (β/α)8桶状结构;结合结构域含146个氨基酸残基(aa354-499),具有碳水化合物结合域第三家族的特征,为数条β折叠片形成的三明治结构。
用 DeepView (Swiss-PdbViewer Version 4.0)软件分析模拟的三维结构信息,可知F-10突变酶的突变位点位于成熟蛋白的催化结构域(CD)212位。对催化结构域三级结构的分析表明在212位D212V的突变使酶三级结构氢键改变,从而使酶蛋白刚性降低,引起该部位相关氨基酸残基侧链柔性增加,从而更加有助于底物向活性部位靠近,促成酶催化效率的提高。T307S突变发生在连接区,此变化有可能增加连接区蛋白的柔性,使酶的结合结构域和催化结构域更容易靠近,使酶的催化效率提高,见图3和图4。
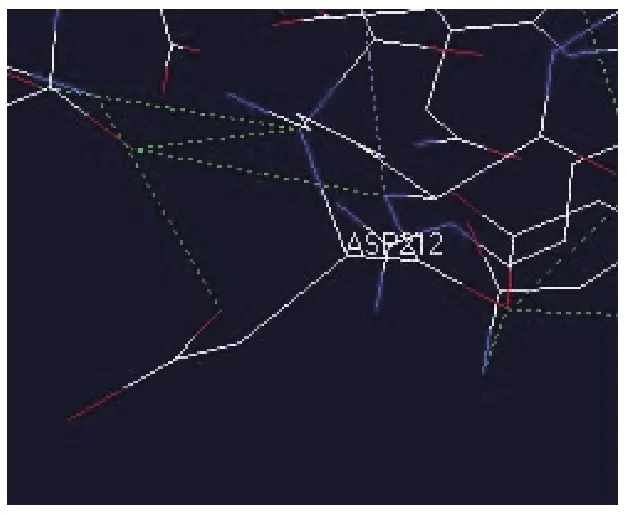
图3 原始酶212位天冬氨酸化学结构图Fig.3 Endoglucanase 212ASP chemical structure
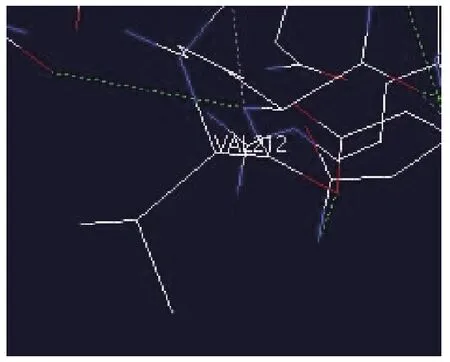
图4 突变株f-10酶212位缬氨酸化学结构Fig.4 Mutated 212VAL chemical structure
2.4 突变株内切葡聚糖酶的SDS-PAGE分析
图 5中泳道 1,2,3,4依次为: 转入 pET32a空质粒的BL21菌株,原始菌株,突变株F-10 1,2破壁产物依照超声波破碎方法分别对重组大肠杆菌pET-C36的细胞裂解物进行SDS-PAGE凝胶电泳分析,如图5所示,其相对分子量为73 000,与理论计算大小相符(载体pET-32α中硫氧还原蛋白的大小约为20 000)。另外,在含空载体大肠杆菌的细胞裂解物中,不存在大小约73 000的条带,与预期结果相符。而且F-10表达量明显多于原始酶。
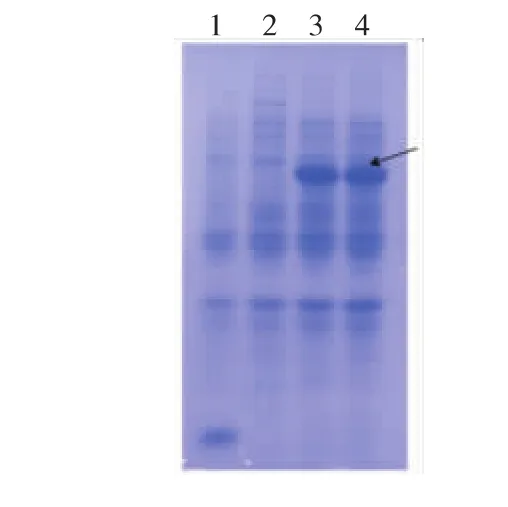
图5 酶表达产物的SDS-PAGE分析Fig.5 SDS-PAGE analysis of expression of endoglucanase gene in E.coil BL21
2.5 突变株F-10酶学性质分析
2.5.1 突变株F-10酶的最适反应pH 以不同pH值的缓冲液配置底物(CMC-Na),取不同pH值的底物与适当稀释的酶液50℃条件下反应30 min,测得不同pH值下的酶活力。重复测定3次结果表明:该突变体的最适反应pH值为5.6。而在pH 4~4.6时酶活力迅速降低,在pH 8.4~10时酶活可维持最高酶活的60%。该酶反应的pH值具有较宽范围,即在pH 4.6~8.0范围内酶活可达最高酶活的70%以上,结果见图6。
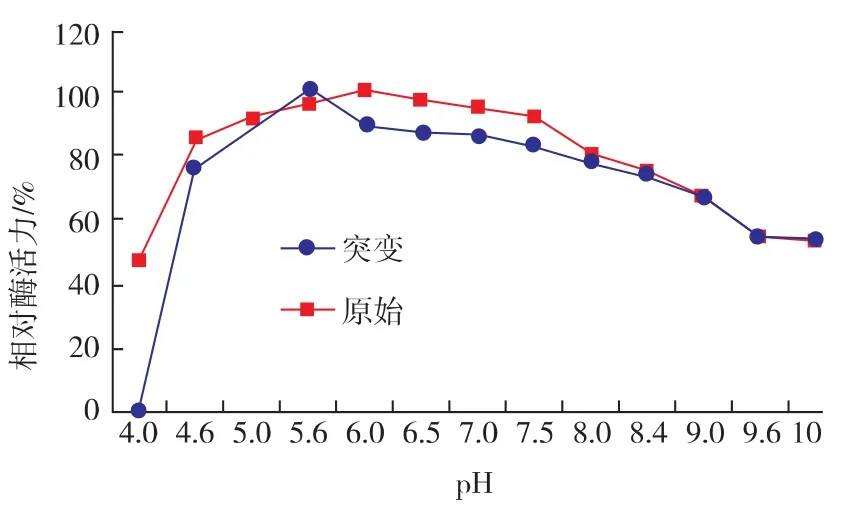
图6 突变酶的最适反应pH值Fig.6 Optimal reaction pH of mutation endoglucanase
2.5.2 突变株F-10酶的pH稳定性 将酶液置于不同pH值的缓冲液于50℃保温30 min,测定剩余酶活力,以最高酶活作为100%,重复测定3次,测得不同pH处理下的酶活力(图7)。结果表明:内切葡聚糖酶在pH 4~5的缓冲溶液中50℃处理30 min后相对酶活力迅速降低,而当pH 5~10时,酶活力相对稳定,可保持在最高酶活的80%以上。
2.5.3 突变株F-10酶的最适反应温度 在pH 6.8条件下, 将酶液分别在 40、45、50、55、60、65、70、75℃环境下与底物反应30 min后测定酶活力(图8)。结果表明:该酶反应温度有45℃和65℃两个峰值,最适反应温度为45℃,在40~70℃范围内酶活可维持在最高酶活的60%以上,当温度大于75℃时,酶迅速失活。
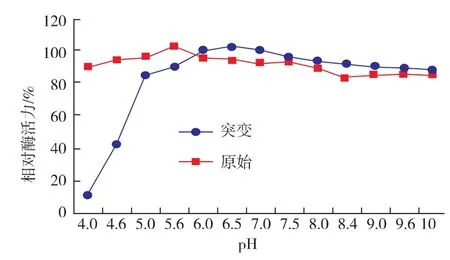
图7 突变酶的pH稳定性Fig.7 EffectofpH on the stability ofmutation endoglucanase
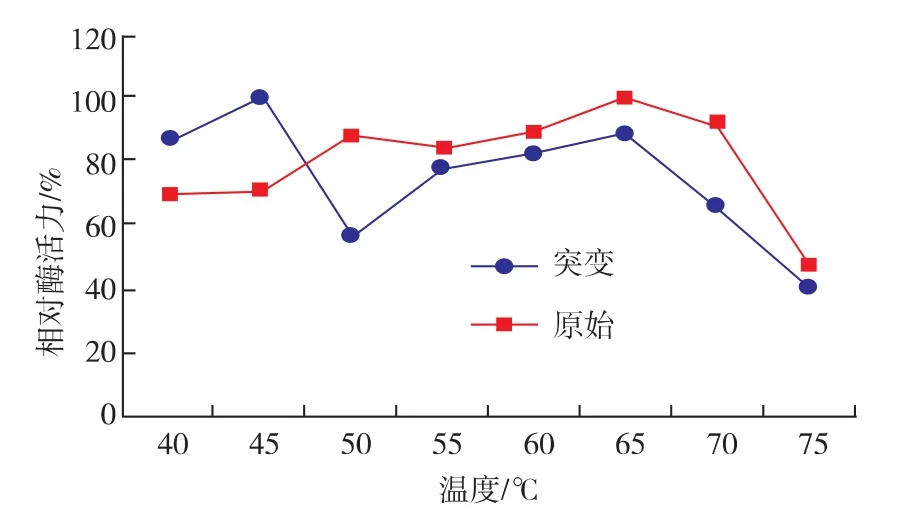
图8 突变酶的最适反应温度Fig.8 Optimal reaction temperature of endoglucanase
2.5.4 突变株F-10酶的热稳定性 将酶液分别置于 60、65、70、75、80、85、90 ℃环境下保温 5 min,再于50℃测定残余酶活力,以最高酶活作为100%(图9)。结果表明:内切葡聚糖酶在70℃处理5 min后酶活力最高,当温度高于75℃时,酶开始变性失活,酶活力迅速下降。在60~75℃酶活力相对稳定,可保持在最高酶活的80%以上。
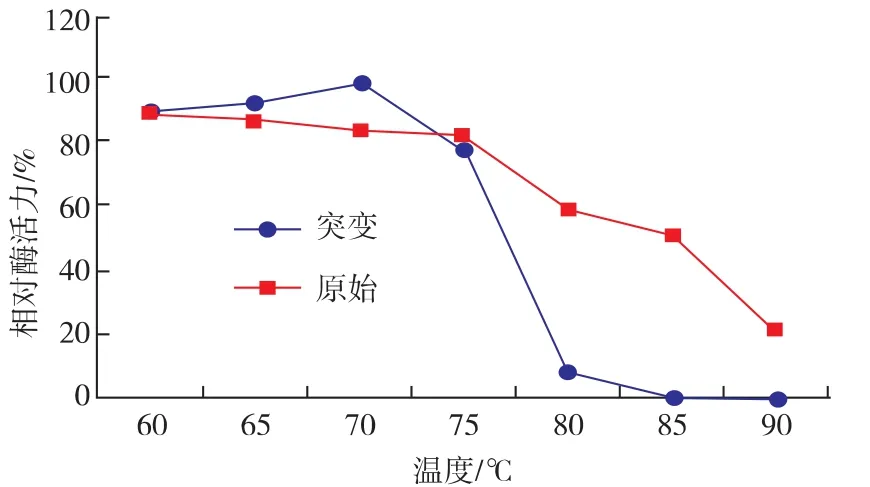
图9 突变酶的热稳定性Fig.9 Effectoftemperatureonthestabilityofendoglucanase
比较原始酶 (最适温度为65℃,最适pH为6.0),突变酶的最适温度和最适pH都发生了变化,酶反应温度有45℃和65℃两个峰值,最适反应温度为45℃这有利于突变酶在实际中的应用,突变酶能在低温下更好的发挥作用;节约能源。突变酶的最适pH偏向于酸性,增大了酶的作用范围。突变酶的热稳定性及pH稳定性,没发生太大的变化。而在碱性范围内广泛的pH稳定性和高酶活有利于该酶在工业中的实际应用。
3 讨论
作者自主筛选到一株高产内切葡聚糖酶的枯草芽胞杆菌,并克隆出该基因,但原始酶存在酶活性不高等问题。采用易错PCR技术对此基因进行定向进化,在分子水平上改造了该酶,筛选得到酶活性提高的突变株。本研究结果发现,突变大多发生在A、T、G核苷酸之间,而且突变中转换多于颠换,表明易错PCR方法介导的突变具有一定的偏向性,与文献报道相符[15]。
定向进化中,往往有益突变只占所有突变子的一小部分,从有大量突变株的突变体库中筛选有益克隆是一项非常繁琐的工作,这需要高通量、高灵敏度方法的建立。作者采用的刚果红平板染色法[16]简单可行,而且灵敏度、准确性及可重复性都较好,不需要昂贵的仪器设备,是内切葡聚糖酶体外定向进化高通量的筛选的有效方法。通过实验发现:此筛选方法中,平板形成的水解圈大小和酶活性高低成一定的正相关。合适的诱导剂浓度和合理的培养时间是高通量筛选的关键,诱导剂浓度过大或培养时间过长会使产生的水解圈重合,给筛选带来不便,浓度过小或培养时间太短会导致酶未充分表达,水解圈不明显。 内切葡聚糖酶成熟蛋白由一个长82aa的底物结合结构域CBM和一个长253aa的催化结构域CD组成,中间有55aa连接肽(Linker)的连接区。枯草芽胞杆菌内切葡聚糖酶属于糖基水解酶第五家族,第五家族糖基水解酶含有一些非常保守且空间位置相近的氨基酸残基位点,其中169位谷氨酸和257位谷氨酸是酶催化过程的主要活性残基[17-19]。突变酶F-10的两个氨基酸突变位点分别位于催化结构域和连接区。其中D212V突变导致结构域此位点形成的氢键减少,氢键的变化可能有利于酶的柔性,增加酶的催化效率。此外由酸性的天冬氨酸突变为中性的缬氨酸,导致催化结构域此位点电荷性质发生变化,使酶活发生变化。T307S突变发生在连接区,此突变氨基酸侧链并未发生太大变化,减少一个甲基,此变化有可能增加连接区蛋白的柔性,使酶的结合结构域和催化结构域更容易靠近,使酶的催化效率提高。目前关于第五家族内切葡聚糖酶基因结合结构域的报道较少,主要在其与催化域的活性和稳定性的关系[20-21],作者获得一株结合结构域突变而酶活性提高的菌株,说明结合结构域与内切葡聚糖酶酶活性有关系,对其深入的研究将有助于对纤维素酶催化原理的进一步阐明,为纤维素酶的分子改造提供理论指导。
SDS-PAGE分析表明,同等培养条件下,突变酶的表达量明显地提高,表现为条带增粗,这可从密码子优化来阐明:枯草芽孢杆菌编码甘氨酸时GGA为偏爱密码子,而大肠杆菌中GGA则为稀有密码子。测序结果显示,两个无义突变(277 GGAGGG甘氨酸 、417GGA–GGT甘氨酸)优化了大肠杆菌的稀有密码子,所以导致在大肠杆菌中表达量的变化,表现为酶活的提高。
内切葡聚糖酶的改造国内外近年来研究报道较多,Wang等对里氏木霉的内切葡聚糖酶进行定向进化,获得了一株最适pH提高了0.6的突变体[4],Liu等对来自 Clostridium phytofermentans的内切葡聚糖酶Cel5A进行了定向进化,筛选得到CMC酶活在60℃半衰期分别提高92%、36% 和46%的突变株[6]。Kim等人通过LB-Amp-IPTG平板方法筛选纤维素酶的突变库,获得提高5.0倍和2.2倍的突变株[9]。林凌等通过易错PCR和DNA Shfulling技术对来自枯草芽胞杆菌的内切葡聚糖酶进行了定向进化,获得了酶活性分别提高2.68和2.03倍的突变体,并对内切葡聚糖酶的三维结构与酶活性关系做了分析[18]。作者通过体外定向进化技术,通过一轮易错PCR,获得了内切葡聚糖酶催化活性分别提高4.2倍的突变株,更重要的是,关于内切葡聚糖酶结合结构域的研究为进一步阐明纤维素酶的催化机理积累了实验数据,同时也为构建高效表达基因工程菌用于中性内切葡聚糖酶酶工业化生产提供了基础材料。
[1]刘杰凤,薛栋升,何可可,等.一株耐盐纤维素酶海洋曲霉的筛选及产酶条件研究[J].食品与生物技术学报,2012,31(7)711-718.LIU Jie-feng,XUE Dong-sheng,HE Ke-ke,et al.Screening of a cellulase producing halotolerant strain marine As pergillu sp and its fermentation conditions[J].Journal of Food Science and Biotechnology,2012,31(7)711-718.(in Chinese)
[2]Li H M,Mei L H,Urlacher V B,et al.Cytochrome P450 BM-3 evolved by random and saturation mutagenesis as an effective indole-hydroxylating catalyst[J].Appl Biochem Biotechnol,2008,144(1):27-36.
[3]Huang Y,Cai Y,Yang J,et al.Directed evolution of lipase of Bacillus pumilus YZ02 by error-prone PCR[J].Sheng Wu Gong Cheng Xue Bao,2008,24(3):445-51.
[4]Wang T,Liu X,Yu Q,et al.Directed evolution for engineering pH profile of endoglucanase III from Trichoderma reesei[J].Biomol Eng,2005,22(1-3):89-94.
[5]Qin Y,Wei X,Song X,et al.Engineering endoglucanase II from Trichoderma reesei to improve the catalytic efficiency at a higher pH optimum[J].J Biotechnol,2008,135(2):190-5.
[6]Liu W,Zhang X Z,Zhang Z,et al.Engineering of Clostridium phytofermentans Endoglucanase Cel5A for improved thermostability[J].Appl Environ Microbiol,2010,76(14):4914-7.
[7]Nakazawa H,Okada K,Onodera T,et al.Directed evolution of endoglucanase III (Cel12A) from Trichoderma reesei[J].Appl Microbiol Biotechnol,2009,83(4):649-57.
[8]Lin L,Meng X,Liu P,et al.Improved catalytic efficiency of endo-beta-1,4-glucanase from Bacillus subtilis BME-15 by directed evolution[J].Appl Microbiol Biotechnol,2009,82(4):671-9.
[9]Kim Y S,Jung H C,Pan J G.Bacterial cell surface display of an enzyme library for selective screening of improved cellulase variants[J].Appl Environ Microbiol,2000,66(2):788-93.
[10]谯仕彦,陆文清,刘兴海.饲料添加剂纤维素酶活力的测定(分光光度法)[S].NY/T 912-2004.
[11]Kiefer F,Arnold K,Kunzli M,et al.The SWISS-MODEL Repository and associated resources[J].Nucleic Acids Res,2009,37(Database issue):D387-92.
[12]张龙翔.生物化学实验方法和技术[M].北京:高等教育出版社,1982.
[13]胥兵,陈惠,韩学易.枯草芽胞杆菌C-36纤维素酶的纯化及酶学性质[J].四川农业大学学报,2006,24(4):398-401.XU Bing,CHEN Hui,HAN Xue-yi.Purification and properties of cellulase from Bacillus subtilis C-36[J].Journal of Sichuan Agricultural University,2006,24(4):398-401.(in Chinese)
[14]吴振芳,陈曾民.内切葡聚糖酶基因在毕赤酵母中高效表达研究[J].农业生物技术学报,2009,17(3):529-35.WU Zhen-fang,CHEN Hui,ZENG Min.Over-expression of endoglucanase gene in pichia pastoris[J].Journal of Agricultural Biotechnology,2009,17(3):529-35.(in Chinese)
[15]张秀艳.β-葡聚糖酶的定向进化及热稳定性研究[J].浙江大学学报,2006:7-17.ZHANG Xiu-yan.Studies on the directed evolution and thermostability of β-glucanase[J].Journal of Zhejiang University,2006:7-17.(in Chinese)
[16]高凤菊,陈惠,吴琦.产纤维素酶芽胞杆菌C-36的分离筛选及其鉴定[J].四川农业大学学报,2006,24(2):175-7.GAO Feng-ju,CHEN Hui,WU Qi.Selection and Identification of Cellulase-producing Bacillus C-36[J].Journal of Sichuan Agricultural University,2006,24(2):175-7.(in Chinese)
[17]Zhang Y Z,Liu J,Gao P J,et al.Structure investigation of Cellobiohydrolase I from Trichoderma pseudokoningii S38 with a scanning tunneling microscope[J].Appl Phys A,1998,67(4):483-5.
[18]Liu G,Tang X,Tian S-L,et al.Improvement of the cellulolytic activity of trichoderma reesei endoglucanase IV with an additional catalytic domain[J].World J Microbiol Biotechnol,2006,22(12):1301-5.
[19]曾炳佳,陈曹杜.同源建模在纤维素酶分子改造中的应用[J].生物物理学报,2008,2:85-92.ZENG Bin-kun,CHEN Cao-du.The Application of homology modeling in the cellulase molecule evolution[J].Acta Biophysica Sinica,2008,2:85-92.(in Chinese)
[20]Zhang S,Yin Q Y,Li Y H,et al.Molecular and biochemical characterization of Ba-EGA,a cellulase secreted by Bacillus sp.AC-1 from Ampullaria crosseans[J].Appl Microbiol Biotechnol,2007,75(6):1327-34.
[21]Fukuda T,Ishikawa T,Ogawa M,et al.Enhancement of cellulase activity by clones selected from the combinatorial library of the cellulose-binding domain by cell surface engineering[J].Biotechnol Prog,2006,22(4):933-8.
