刺参Y-box基因的克隆与表达分析
2013-02-08田燚张丙龙常亚青董萍萍陈百尧伏光辉安建
田燚,张丙龙,常亚青,董萍萍,陈百尧,伏光辉,安建
(1.大连海洋大学农业部北方海水增养殖重点开放实验室,辽宁大连116023;2.连云港市海洋与水产科学研究所,江苏连云港222044;3.连云港市海珍品增养殖试验场,江苏连云港 222044)
刺参Y-box基因的克隆与表达分析
田燚1,张丙龙1,常亚青1,董萍萍1,陈百尧2、3,伏光辉2、3,安建2、3
(1.大连海洋大学农业部北方海水增养殖重点开放实验室,辽宁大连116023;2.连云港市海洋与水产科学研究所,江苏连云港222044;3.连云港市海珍品增养殖试验场,江苏连云港 222044)
为了探究Y-box基因在刺参Apostichopus japonicus胚胎发育及性别分化中的作用,根据已有的EST序列,通过RACE技术克隆了刺参Y-box基因的cDNA全长序列,并利用实时定量PCR技术进行了表达模式分析。结果表明:刺参Y-box基因cDNA全长为1 142 bp,5'端UTR为102 bp,3'端UTR为215 bp,开放阅读框 (ORF)为825 bp;Y-box基因cDNA全长编码274个氨基酸的前体蛋白,预测蛋白的相对分子质量为31 100,理论等电点为9.46,是亲水性蛋白;刺参Y-box氨基酸序列包含氨基酸N末端结构域、C末端结构域和冷休克结构域 (CSD),其中CSD区在Y-box结合蛋白家族中非常保守;刺参Y-box结合蛋白质的二级结构没有α-螺旋和β-折叠,无规则卷曲占87.23%,延伸链占12.77%;刺参与其他物种的Y-box氨基酸的相似度为27%~41%,在冷休克区相似度很高,达到75%以上;构建的系统进化树表明,刺参与加州海兔Aplysia californica、栉孔扇贝Chlamys farreri、玻璃海鞘Ciona intestinalis聚为一支,为海洋无脊椎动物;经实时定量PCR检测,Y-box基因在小耳幼体中表达水平最高,且显著高于其他各发育阶段(P<0.05),在雄性性腺中的表达量显著高于雌性性腺 (P<0.05)。研究表明,Y-box基因在刺参的胚胎发育及性别分化中发挥重要作用。
刺参;Y-box基因克隆;序列分析;基因表达
Y-box结合蛋白是从细菌到人类都高度保守的多功能蛋白家族,在转录调节、选择性剪接、DNA修复、翻译调控、细胞增殖和再生等多方面具有重要作用[1-5]。关于Y-box结合蛋白家族生物学功能的研究很多,其中包括冷适应功能、转录调节功能和蛋白质翻译调控功能等。真核生物中Y-box结合蛋白在转录激活和抑制两个方面发挥其转录调节功能。低温下,Y-box基因mRNA能够成功合成冷休克蛋白,而其他蛋白质的翻译过程则被阻止[6]。有研究表明,在多数动物组织中均能检测到Y-box基因的表达,高表达量出现在肝脏、卵巢和睾丸组织中[7]。
刺参Apostichopus japonicus又名仿刺参,在中国主要分布于黄渤海海域,属典型的温带种,是经济价值很高的海产品,现已成为中国北方沿海重要的养殖品种之一[8-9]。目前,关于刺参性别分化及决定相关功能基因的研究相对较少。庞振国等[10]研究了二硫苏糖醇对刺参卵母细胞体外成熟的影响;田燚等[11]克隆了刺参性别相关基因P450c17并进行了序列分析;臧云鹏[12]进行了刺参性别差异的研究;隋娟等[13]研究了刺参vasa-1ike基因在组织中的表达。为了进一步了解刺参的性别决定和分化的分子机制,本研究中克隆了刺参Y-box基因,分析其氨基酸序列,预测蛋白质的性质及结构,探讨其在不同组织、不同发育时间和性腺中的表达情况,旨在为刺参的性别决定机制提供一定的理论基础。
1 材料与方法
1.1 材料
试验用刺参取自大连市瓦房店海区,在大连海洋大学农业部北方海水增养殖重点开放实验室暂养一周后开始试验。刺参体质量为 (24.15±0.17)g,养殖用水为沙滤海水,pH为7.98,盐度为31。
1.2 方法
1.2.1 总RNA的提取与反转录 利用Trizol法提取刺参体腔液的总RNA,RNA的浓度及完整性利用紫外分光光度计与10 g/L琼脂糖凝胶电泳进行检测,符合要求后于-80℃下保存备用,并按照BD SMARTTMRACE cDNA Amplification Kit试剂盒说明书的方法合成SMART cDNA。反转录体系:总RNA 100 ng,5×M-MLV Buffer 2 μL,RTase MMLV(200U/μL)0.25 μL,oligo(dT)1 μL,dNTP 0.5 μL,RNase Inhibitor(40 U/μL)0.25 μL,用水定容至10 μL。将RNA于65℃下变性后冰浴,在冰上迅速加入上述成分后于42℃下水浴,于70℃下保温后冰上冷却,获得cDNA第一条链。1.2.2 RACE扩增及产物的克隆和测序 根据本实验室已获得的EST序列 (GH550810.1),应用Primer Premier 5.0软件设计RACE的特异性引物F、R(表1)。利用SMARTTMRACE cDNA Amplification Kit试剂盒,进行刺参Y-box基因cDNA全长的克隆。反应体系共25 μL,包括cDNA 1 μL,引物各 0.5 μL,10×Ex Taq Buffer 2.5 μL,dNTP 2 μL,ExDNA聚合酶0.25 μL。PCR反应条件:94℃下预变性3 min;94℃下变性60 s,54℃下退火60 s,72℃下延伸10 min,共进行35个循环;最后于72℃下再延伸10 min,4℃下保存。5'RACE以oligo(dT)为引物,合成cDNA第一链,用R引物扩增基因的5'末端。PCR反应体系同上。将cDNA片段回收后,将与载体连接好的质粒转化至感受态DH5α中,通过蓝白斑筛选和菌落PCR鉴定,为阳性的克隆送宝生物工程 (大连)有限公司进行测序。

表1 基因克隆及表达所用引物序列Tab.1 Sequences of the primers used in the gene clone and expression
1.2.3 序列分析 采用Blast软件进行序列同源性比对和相似性搜索;用DNAman软件进行序列拼接,用NCBI上的 ORF Finder寻找开放阅读框(ORF);利用Tmhmm软件预测跨膜域;用Target P 1.1 Server程序进行信号肽查找;用Bioedit软件分析Y-box结合蛋白的氨基酸组成,采用Smart软件查找蛋白特征模体;用ExPASy server软件分析蛋白质性质;用 DNAman开展多序列比对,用Psipred预测蛋白的二级结构,用I-TASSER Server预测蛋白的3D结构;用Mega 4.0软件的邻接法构建系统进化树,1 000次重复计算自展分析值。
1.2.4 实时定量PCR检测刺参Y-box基因的时空表达 采用RT-PCR方法,检测Y-box基因在不同发育阶段的定量表达情况。利用Trizol法分别提取刺参的受精卵、囊胚、原肠胚、小耳幼体、中耳幼体、大耳幼体、樽形幼体、五触手幼体、稚参、雌性性腺和雄性性腺的RNA,并反转录成cDNA。每组样品均设3个平行,利用引物Y-box-R和Y-box-F对样品进行扩增,以cytb为内参基因,设计的引物为cytb-F和cytb-R(表1)。PCR反应条件:94℃下预变性5 min;94℃下变性30 s,60℃下退火30 s,72℃下延伸30 s,共进行28个循环;最后在72℃下再延伸5 min,4℃下保存。
2 结果
2.1 RACE扩增
利用设计的特异性引物,以总RNA反转录获得的cDNA为模板,经RACE扩增获得了与预期大小一致的目的片段 (图 1),其中 Marker为DL2000。
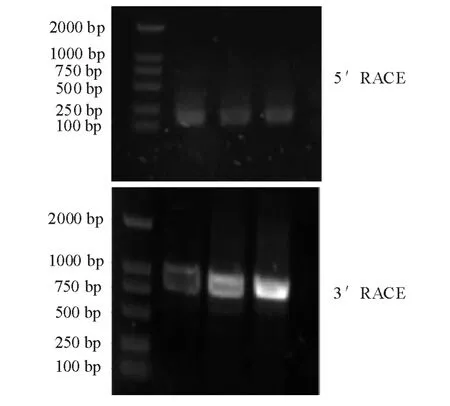
图15'RACE和3'RACE的扩增产物Fig.1 Amplification product of 5'RACE and 3'RACE
2.2 刺参Y-box基因cDNA全长序列
将刺参Y-box基因的EST(GH550810.1)片段与 RACE获得的cDNA序列进行拼接,获得1 142 bp的基因cDNA全长 (图2)。在起始密码子ATG的-3位为 A,符合Kozak规律。cDNA的5'端 UTR 为102 bp,3'端 UTR 为215 bp,ORF为825 bp。碱基A、T、C、G的偏好性分析表明,Y-box基因cDNA全长序列的碱基A占33.3%,碱基G占28.7%,碱基T占16.4%,碱基C占21.6%。将刺参Y-box基因cDNA全长与斑马鱼Danio rerio、玻璃海鞘Ciona intestinalis、大西洋鲑Salmo salar、栉孔扇贝Chlamys farreri、虹鳟Oncorhynchus mykiss、金鱼Carassius auratu、大菱鲆Scophthalmus maximus、非洲爪蟾蜍Xenopus tropicalis等物种的序列进行比较分析,结果表明,3'和5'端的UTR在不同物种中差异较大,但是刺参Y-box基因cDNA全长序列的ORF序列长度和相似度与其他物种基本一致。

图2 刺参Y-box基因cDNA全长序列及推导的氨基酸序列Fig.2 Full-length cDNA and the deduced amino acid sequence of Y-box gene in sea cucumber Apostichopus japonicus
2.3 刺参Y-box结合蛋白的氨基酸组成特征
刺参Y-box基因cDNA全长可编码274个氨基酸的前体蛋白,理论等电点为9.46,预测蛋白的相对分子质量为31 100。其中有54个强碱性氨基酸 (K、R),47个强酸性氨基酸 (D、E),42个疏水氨基酸 (A、I、L、F、W、V),70个不带电荷的极性氨基酸 (N、C、Q、S、T、Y),分子式为C1302H2079N451O438S2。以 ProtScale程序对 Y-box cDNA编码的氨基酸进行分析,结果发现,第21~31、53~55、76~83、226~229残基为疏水性的,第5~18、32~37、39~52、56~72、84~94、96~225、230~270残基为亲水性的。Y-box结合蛋白疏水性最大值为1.922,亲水性最大值为3.822,亲水性残基比例远大于疏水性残基,因此,推测其编码蛋白是亲水性的。
将刺参与大西洋鲑、栉孔扇贝、斑马鱼、金鱼、大菱鲆、玻璃海鞘、虹鳟、鲍鱼Haliotis diversicolor、加州海兔Aplysia californi、青鳉Oryzias latipes等物种的Y-box结合蛋白进行了比较分析,等电点、蛋白质分子量基本一致,具有较高的同一性,尤其是CSD区相似度较高,进一步说明此区域的高度保守性。
采用Signal P软件预测刺参的Y-box氨基酸序列,不存在信号肽,故推测Y-box不属于分泌性蛋白。利用Tmhmm预测Y-box结合蛋白的跨膜域,Y-box无明显跨膜区,不属于跨膜蛋白类。对其糖基结合位点的分析发现,Y-box氨基酸序列存在1个糖基结合位点,推测Y-box结合蛋白可能是糖蛋白。
2.4 刺参Y-box结合蛋白的结构预测
蛋白质的拓扑结构对于保持蛋白质的功能非常重要,不同的拓扑结构将导致不同的功能。预测刺参Y-box结合蛋白质的二级结构,无规则卷曲和延伸链构成了蛋白质中较大的结构元件,其中无规则卷曲占87.23%,延伸链占12.77%,不含α-螺旋和β-折叠。刺参Y-box结合蛋白具有氨基酸C末端结构域、N末端结构域和冷休克结构域(CSD),其中CSD是高度保守的核苷酸结合域,由68个氨基酸组成,主要负责与损伤DNA和非特异性DNA结合,参与自身或异源的聚合。结构域中包含有 RNP-1(GYGFINR)和 RNP-2(EDVFVHQS)两个RNA结合基序 (图3),这两个基序与其转录调控功能密切相关。

图3 刺参与其他物种Y-box氨基酸序列比对的部分结果Fig.3 The comparison of partial amino acid sequences of Y-box in sea cucumber with other species
2.5 刺参与其他物种Y-box氨基酸序列的系统进化树
利用GenBank上已公布的Y-box氨基酸序列进行多序列的比对,使用Mega 4.0软件构建系统进化树。从图4可见:刺参与加州海兔 (NP00-1191560)、栉孔扇贝 (ACF90219.1)、玻璃海鞘(NP001072010.1)聚为一支,为海洋无脊椎动物,其聚类的结果与其进化地位一致;大西洋鲑(NP001133216.1)、虹鳟(NP001158512.1)、斑马鱼(AAI68507.1)、非洲爪蟾蜍(NP001016677.1)、原鸡 (NP989745.1)、小家鼠 (AAH27785.1)、人(NP001138898)、七鳃鳗 (ACF33226.1)、金鱼(BAA19850.1)聚为一支,为脊椎动物;摇蚊(AAN10049.1)与果蝇(XP002048507.1)聚为一支,为陆地无脊椎动物。
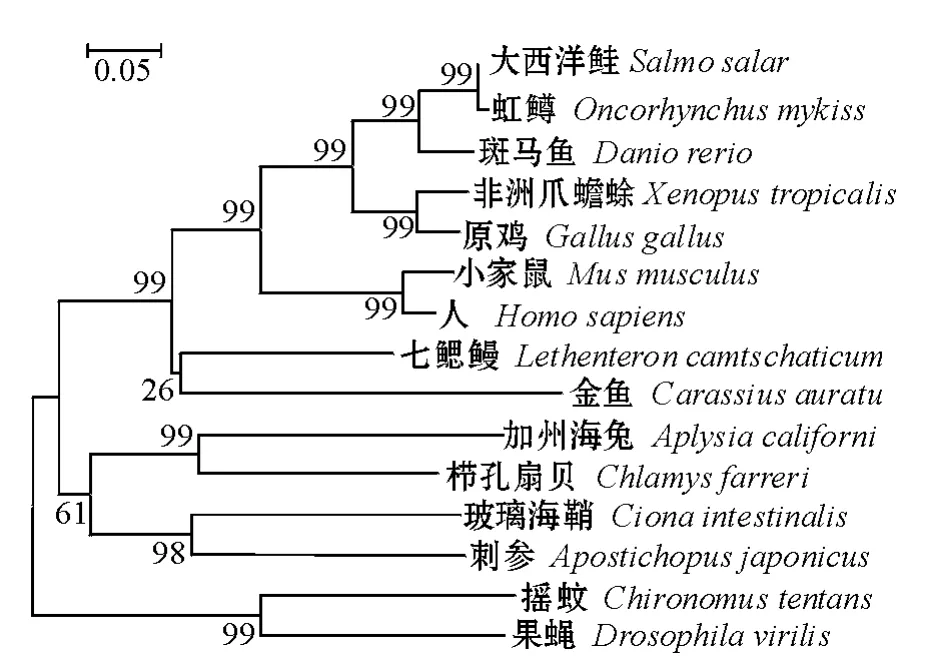
图4 刺参与其他物种Y-box氨基酸序列的系统进化树Fig.4 Phylogenetic tree of the sea cucumber and other species based on Y-box sequences
2.6 刺参与其他物种Y-box氨基酸序列的同源性
将刺参与其他物种的Y-box氨基酸序列进行同源性比对分析,结果表明,其相似度为27%~41%,在CSD区相似度很高,达到75%以上 (图3)。研究结果表明,具有重要作用的氨基酸残基在保持蛋白质功能方面是高度保守的,而维持结构的残基则是相对保守的。
2.7 刺参Y-box基因在不同发育阶段的表达
以cytb为内参基因,利用实时定量PCR方法检测Y-box基因在刺参不同发育阶段的表达。结果表明:Y-box基因在不同发育阶段均有表达,其中小耳幼体阶段表达水平最高,且显著高于其他发育阶段 (P<0.05);在雄性性腺中的表达量显著高于雌性性腺 (P<0.05)(表2)。
3 讨论
3.1 刺参Y-box基因的组成特性及结构域预测
为963 bp,编码320个氨基酸,与刺参氨基酸的相似度为66%,CSD保守结构域的相似度为75%;金鱼[14]Y-box基因家族中 Y-box1全长为1 430 bp,ORF为936 bp,编码311个氨基酸,与刺参氨基酸的相似度为66%,CSD保守结构域的相似度为75%;金鱼[14]Y-box2 全长为 1 503 bp,ORF为894 bp,编码297个氨基酸,与刺参氨基酸的相似度为60%,CSD保守结构域的相似度为75%;日本青鳉[15]Y-box1全长为1 464 bp,ORF为921 bp,编码306个氨基酸,与刺参氨基酸的相似度为75%,CSD保守结构域的相似度为76.5%。研究结果表明,高度保守的氨基酸残基在保持蛋白质功能方面是非常必要的,而维持其结构作用的残基则是相对保守的。
本研究中获得的刺参Y-box基因cDNA全长为1 142 bp,ORF为825 bp,可编码274氨基酸的前体蛋白。刺参Y-box基因cDNA含有一个保守的CSD区域,此区域与其他物种氨基酸的相似度在75%以上。到目前为止,Y-box基因已经在很多水产动物中获得,如金鱼[14]、日本青鳉[15]、加州海兔[16]、日 本 七 鳃 鳗[6]、 玻 璃 海 鞘[17]、 大 西 洋鲑[18]、栉孔扇贝[19]、斑马鱼[20]等。其中:加州海兔[16]Y-box基因 cDNA 全长为1 723 bp,ORF为762 bp,编码253个氨基酸,与刺参氨基酸的相似度为75%,CSD保守结构域的相似度为85%;玻璃海鞘[17]Y-box基因cDNA全长为1 852 bp,ORF
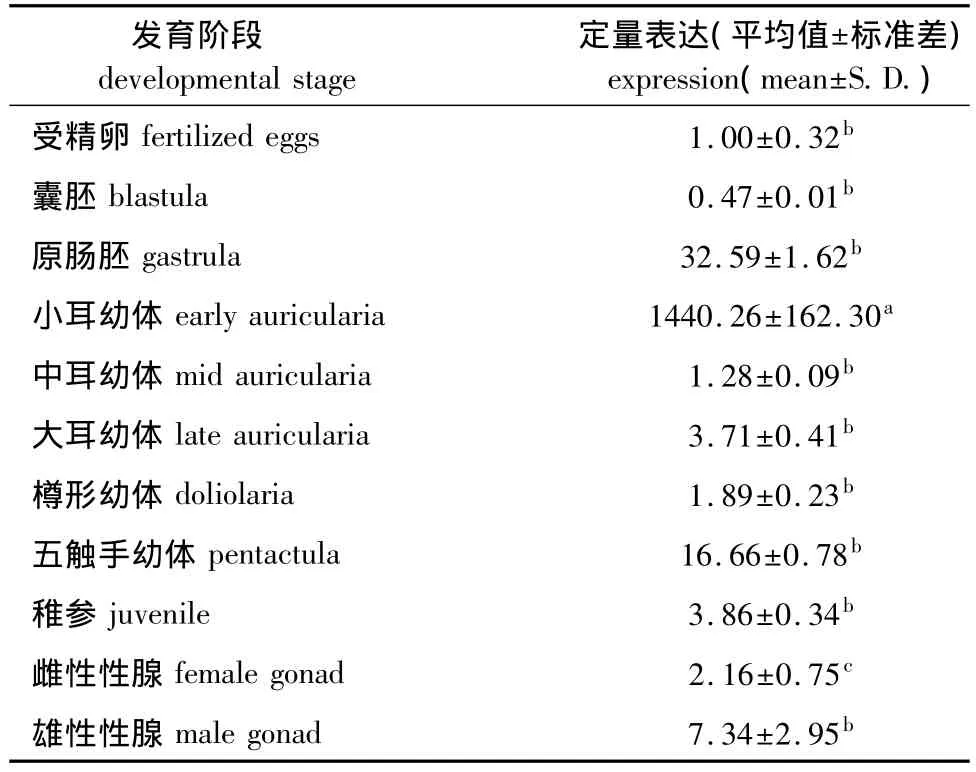
表2 刺参Y-box基因mRNA在不同发育阶段的表达Tab.2 Quantitative real-time PCR analysis of Y-box gene expression in different developmental stages in sea cucumber Apostichopus japonicus
3.2 刺参Y-box结合蛋白的结构域预测
Y-box属于多功能的DNA/RNA结合蛋白,其前体蛋白包括3个结构域[14]:富含大量的丙氨酸和脯氨酸的氨基酸N末端,负责转录的激活;冷休克结构域,一般包含大约70个氨基酸残基,高度保守,含有 RNP-1(GYGFINR)和 RNP-2(EDVFVHQT)两个RNA结合基序[1],是其蛋白质识别RNA的结合位点;C末端结构域,其氨基酸由酸性氨基酸与碱性氨基酸交替组成,负责调节蛋白与蛋白、蛋白与RNA之间的相互作用。
刺参Y-box结合蛋白具有氨基酸N末端结构域、C末端结构域和冷休克结构域,这些结构都符合Y-box前体蛋白的氨基酸序列特征。其中冷休克结构域由68个氨基酸组成,是高度保守的核苷酸结合域,保守的冷休克结构域决定了Y-box结合蛋白的重要功能[17]。刺参高度保守的结构域也进一步证明了在进化过程中,保持蛋白质功能的残基比维持蛋白质结构的残基更加保守。N末端氨基酸组成的不同是Y-box结合蛋白分子间的最大区别,但N末端具体如何行使其功能目前尚不清楚[21]。刺参N-末端氨基酸组成的不同,可能负责调控刺参Y-box结合蛋白特异结合转录过程中的其他蛋白质,进而实现其特异性的转录调控。刺参的C末端氨基酸结构域,由酸性氨基酸与碱性氨基酸交替组成,推测此区域与蛋白以及蛋白与RNA之间的相互作用有关。目前已知C末端的亲水结构域主要通过精氨酸束与邻近分子中的酸性螺旋相互作用,实现结合蛋白间的聚合[14]。
3.3 刺参Y-box基因的位点分析与同源性分析
预测的刺参Y-box结合蛋白不属于分泌性蛋白,这与人Y-box结合蛋白的功能很相似。人Y-box结合蛋白通常在细胞基质与细胞核之间穿梭,以应激颗粒的形式存在于细胞基质中,主要功能是处理加工并输出mRNA,在细胞核中Y-box结合蛋白受到应激反应以后会发生移动,包括腺病毒感染、DNA 损伤和 PI3K-Akt信号激活等[22-25]。
刺参Y-box氨基酸序列与其他物种具有相对较高的相似性,尤其是CSD区,这种高度的保守性说明Y-box基因在刺参的生命活动中具有重要作用。正是因为具有相同的保守区和功能域才决定了刺参与其他物种的Y-box结合蛋白具有功能上的相同。Y-box结合蛋白作为重要的多功能转录和翻译调控蛋白,表现为它在结构上高度的保守性。刺参Y-box氨基酸序列CSD区中保守的68个氨基酸,可能在刺参Y-box基因进化中起到稳定其功能的作用。
3.4 刺参Y-box基因的定量表达分析
Y-box基因在刺参不同发育阶段的定量表达结果表明,Y-box基因在不同发育阶段均有表达,刺参Y-box基因的这种组成型表达方式也从另一个角度说明其功能的多样性。在小耳幼体中Y-box基因的表达水平最高,且显著高于其他发育阶段,这可能是因为小耳状幼体是刺参个体发育中第一个变态时期,也是个体发育中时间最长,形态学和组织器官初步形成的时期,在这个时期表达量高可能与其在这个阶段的重要变化密切相关,同时从另一个侧面反映了Y-box基因是一个多功能的转录及翻译调控因子。
Y-box基因在刺参雄性性腺中的表达量显著高于雌性性腺,推测Y-box基因可能与刺参的性别分化及决定有一定关系,此结果还需要进一步证实。有研究发现,Y-box结合蛋白在金鱼的精细胞里表达非常高[19],是一种特别的精子RNA结合蛋白,而在非洲爪蟾蜍中Y-box基因作为精细胞的特别转录因子抑制翻译。在小鼠卵母细胞中Y-box结合蛋白占总蛋白的2%[20],而在小鼠精子细胞中占0.7%[26],且缺少Y-box结合蛋白的小鼠形态生长发育正常但不育[27]。本研究结果将有助于推进刺参的Y-box基因在胚胎发育及其性别调控分化的研究工作。
[1] Matsumoto K,Wolffe A P.Gene regulation by Y-box protein scoupling control of transcription and translation[J].Trends Cell Biol,1998,8(8):318-323.
[2] Bouvet P,Wolffe A P.A role for transcription and FRGY2 in masking maternal mRNA within Xenopus oocytes[J].Cell,1994,77(6):931-941.
[3] Chang B E,Lin C Y,Kuo C M.Molecular cloning of a cold-shock domain protein,zfY1,in zebrafish embryo[J].Biochimaica et Biophysica Acta,1999,1433:343-349.
[4] Karlson D,Nakaminami K,Toyomasu T.A cold-regulated nucleic acid-binding protein of winter wheat shares a domain with bacterial cold shock proteins[J].J Biol Chem,2002,277(38):35248-35256.
[5] Valadao A F,Fantappie M R,LoVerde P T.Y-box binding protein fromSchistosoma mansoni:interaction with DNA and RNA[J].Mol Biochem Parasitol,2002,125(1/2):47-57.
[6] Moss E G,Lee R C,Hmbros V.The cold shock domain protein LIN-28 controls developmental timing in C.elegansand is regulated by the lin-4 RNA[J].Cell,1997,88(5):637-646.
[7] Tafuri S R,Familari M,Wolffe A P.A mouse Y-box protein,MSYl,is associated with paternal mRNA in spermatocytes[J].J Biol Chem,1993,268(16):12213-12220.
[8] 田燚,莫海波,常亚青.低盐胁迫下仿刺参DD104基因的定量表达分析[J].大连海洋大学学报,2013,28(3):236-240.
[9] 王斌,袁甜,张译文,等.仿刺参肠多糖提取物对小鼠实体瘤的抑制作用[J].大连海洋大学学报,2012,27(2):195-199.
[10] 庞振国,孙慧玲,常亚青,等.二硫苏糖醇对刺参卵母细胞体外成熟的影响[J].渔业科学进展,2010,31(6):82-89.
[11] 田燚,张丙龙,常亚青.仿刺参性别相关基因P450c17的克隆与序列分析[J].中国水产科学,2012,19(1):22-32.
[12] 臧云鹏.仿刺参微卫星DNA标记的筛选与应用及性别差异研究初探[D].上海:上海海洋大学,2011.
[13] 隋娟,张志峰,邵明瑜,等.刺参vasa-1ike基因克隆及其在组织中的表达分析[J].中国水产科学,2008,15(3):407-413.
[14] Wolffe A P.Chromatin,structure and function[M].San Diego,Calif:Academic Press,1995.
[15] Yamanaka K,Fang L,Inouye M.The CspA family in Escherichia coli:multiple gene duplication for stress adaptation[J].Mol Micro Boil,1998,27(2):247-255.
[16] Sommerville J.RNA-binding proteins:masking proteins revealed[J].Bioassays,1992,14(5):33-79.
[17] Wolffe A P,Tafuri S,Ranjan M,et al.The Y-box factors:a family of nucleic acid binding proteins conserved from Escherichia coli to man[J].New Biol,1992,4(4):290-298.
[18] Ranjan M,Tafuri S R,Wolffe A P.Masking mRNA from translation in somatic cells[J].Genes Dev,1993,7(9):25-36.
[19] Yoshinao K,Masakane Y,Yoshitaka N.Isolation and characterization of goldfish Y-box protein,a germ-cell-specific RNA-binding protein[J].Eur J Biochem,1997,249:854-861.
[20] Junying Y,Norman B H,Richard M S.Expression of MSY2 in mouse oocytes and preimplantation embryos[J].Biology of Reproduction,2001,65:1260-1270.
[21] Kong W H,Gao Ch L,Zuo J K.Masking mRNA by Y-box binding protein[J].Chinese Journal of Cell Biology,2000,22:1-8.
[22] Kedersha N,Anderson P.Mammalian stress granules and processing bodies[J].Methods Enzymol,2007,431:61-81.
[23] Holm P S,Bergmann S,Jurchott K,et al.YB-1 relocates to the nucleus in adenovirus infected cells and facilitates viral replication by inducing E2 gene expression through the E2 late promoter[J].J Biol Chem,2002,277(12):10427-10434.
[24] Stein U,Jürchott K,Walther W,et al.Hyperthermia-induced nuclear translocation of transcription factor YB-1 leads to enhanced expression of multidrug resistance-related ABC transporters[J].J Biol Chem,2001,276(30):28562-28569.
[25] Kohno K,Izumi H,Uchiumi T.The pleiotropic functions of the Y-box-binding protein,YB - 1[J].Bioassays,2003,25(7):691-698.
[26] Lasham A,Moloney S,Hale T,et al.The Y-box-binding protein,YB1,is a potential negative regulator of the p53 tumor suppressor[J].J Biol Chem,2003,278(37):35516-35523.
[27] Junying Y,Manqi D,Sergey M.Transgenic RNAi-mediated reduction of MSY2 in mouse oocytes results in reduced fertility[J].Developmental Biology,2004,268:195-206.
Molecular cloning and expression analysis of Y-box gene in sea cucumberApostichopus japonicus
TIAN Yi1,ZHANG Bing-long1,CHANG Ya-qing1,DONG Ping-ping1,
CHEN Bai-yao2,3,FU Guang-hui2,3,AN Jian2,3
(1.Key Laboratory of Mariculture& Stock Enhancement in North China's Sea,Ministry of Agriculture,Dalian Ocean University,Dalian 116023,China;2.Ocean and Fishery Science Research Institute of Lianyungang City,Lianyungang 222044,China;3.Seafood Breeding Farm of Lianyungang City,Lianyungang 222044,China)
The cDNA length of Y-box gene in sea cucumberApostichopus japonicuswas clones by RACE technique based on the EST sequence in the GenBank,and the expression of Y-box gene in sea cucumber was studied by fluorescent quantitative PCR to elucidate the role of Y-box gene in embryonic development and sexual differentiation in the sea cucumber.The results showed that the Y-box has cDNA length of 1 142 bp encoding 274 amino acids constituting hydrophilic precursor protein with 31 100 protein molecular weight with an isoelectric point of 9.46 and included a 825 bp open reading frame(ORF),a 215 bp 3'UTR and a 102 bp 5'UTR.The N-glycosylation site,hydrophilic C-tail end and cold shock domain CSD were evaluated,and the Y-box protein family was very conservative in CSD domain.The secondary structure of the precursor protein consisted primarily of a 12.77%strand chain and 87.23%random coil,without β folding and alpha helix.The comparison revealed that the similarity of the Y-box precursor protein was ranged from 27%to 41%with other animals.The evolutionary tree indicated that the Y-box precursor protein of sea cucumber was clustered with sea hareAplysia californica,AscidianCiona intestinalisand Zhikong scallopChlamys farreri.The Y-box gene expression in different developmental stages and gonads showed that there was significantly higher expression of the Y-box gene in early auricularia than in other stages(P<0.05),and higher in testis than in ovary(P<0.05),indicating that the Y-box gene play an important role in embryonic development and sexual differentiation in the sea cucumber.
Apostichopus japonicus;Y-box gene cloning;sequence analysis;gene expression
S917.4
A
2095-1388(2013)06-0535-07
2013-03-04
国家自然科学基金资助项目 (41106128);国家“863”计划重大项目 (2012AA10A412);江苏省科技支撑计划项目(BE2012421)
田燚 (1979-),女,副教授。E-mail:tianyi@dlou.edu.cn
常亚青 (1967-),男,教授。E-mail:yqchang@dlou.edu.cn
