HO-1在缺血后处理抗肺缺血再灌注损伤中的作用及其对STAT-3表达的影响
2013-02-05徐波苏娃婷徐金金刘慧敏夏中元夏正远雷少青
徐波,苏娃婷,徐金金,刘慧敏,夏中元,夏正远,雷少青
(1.首都医科大学附属北京友谊医院,北京 100050;2.武汉大学人民医院麻醉科,武汉 430060;3.广东医学院附属医院,广东 湛江 524001)
肺缺血再灌注损伤(pulmonary ischemia-reperfusion injury,LIRI)可发生于肺移植、心肺移植、心肺转流、心肺复苏、肺溶栓等多种临床情况[1]。其特征是肺血管通透性增加、肺动脉高压、肺水肿、肺气管痉挛、肺通气受损[2],从而影响病人恢复,严重时导致病人手术失败而使死亡率增高。缺血后处理(ischemic postconditioning,IPO)是近年Zhao 等[3]报道的一种内源性心脏保护现象,具有良好的临床应用前景。目前证实,IPO 也可在肝、脑、肾、脊髓、平滑肌等心脏外器官中具有保护作用。然而,IPO 在肺脏中的保护作用目前较少研究,特别是IPO 在抗肺缺血再灌注损伤中的作用机制仍然不明。
近年研究显示,IPO 发挥保护作用与生存活化因子增强(survivor activating factor enhancement,SAFE)通路,特别是Janus 激酶(JAK)与信号转导及转录激活因子-3 (signal transducer and activator of transcription 3,STAT-3)途径有关[4]。在我们前期研究中,IPO 抗肺缺血再灌注损伤还与血红素加氧酶-1(hemeoxygenase-1,HO-1)的表达及活性增加有关[5,6]。新近研究显示,HO-1 可诱导STAT-3 的活化而发挥抗肝缺血再灌注损伤作用[7]。然而,IPO所诱导的HO-1 是否也通过促进STAT-3 活化而发挥抗肺缺血再灌注损伤作用目前未见相关报道。本研究通过建立肺缺血再灌注损伤模型,旨在进一步探讨HO-1 在IPO 抗LIRI 中的作用机制及其对STAT-3 蛋白表达的影响。
1 材料与方法
1.1 实验动物及手术操作
清洁级雄性SD 大鼠,6 ~7 周龄,体重250 ~280 g,由武汉大学动物实验中心提供【SCXK(鄂)2008-0004】。实验在武汉大学动物实验中心进行【SYXK(鄂)2008-0004】。戊巴比妥钠(30 mg/kg)腹腔内注射麻醉,气管切开后气管内插管连接TKR-200C型小动物呼吸机控制呼吸,呼吸频率:60 次/分,呼吸比为1∶1.5,工作压力(即潮气量):0.02 MPa。经左胸第5 肋间进入胸腔,游离左侧肺门,穿一根阻断带。
1.2 实验分组
1)假手术组(S 组):不阻断肺门,持续灌注105 min;2)缺血再灌注组(IR 组):缺血45 min 后,再灌注60 min;3)缺血后处理组(IPO 组):缺血45 min后,短暂再灌注1 min,缺血1 min,反复5 次,然后再灌注60 min ;4)缺血后处理+ HO-1 抑制剂组(IPO+ZnPP 组):实验前24 h 腹腔注射HO-1 的特异性抑制剂zinc protoporphyrin IX(ZnPP,20 mg/kg,美国Sigma 公司)。
1.3 肺水肿程度检测:肺的干/湿比(W/D)
再灌注结束时,实施胸骨正中劈开手术,通过升主动脉离断处死大鼠。从胸腔中切除肺叶,左肺称重后置于90℃烘箱中24h。干燥过程结束后再称重,计算肺的干/湿比。肺水肿程度由此比值描述。
1.4 丙二醛(MDA)含量、MPO 及HO-1 活性测定(W/D)
取组织置于液氮0.5 h 后冻存于-80℃,留待测酶活性或者蛋白表达。丙二醛(MDA)是脂质过氧化损伤的特异指标。MPO 是PMN 聚集的特征酶,是白细胞浸润肺实质的标志。分别用试剂盒(南京建成科技有限公司)检测MDA 含量、MPO 及HO-1 活性,操作方法严格按照其说明书进行。
1.5 免疫共沉淀分析HO-1 与STAT-3 蛋白的相互作用关系
具体方法如下:心肌组织于温和裂解液(含60 mmol/L N-octyl-glucopyranoside)中匀浆、冰上裂解30 min,1000 g 离心15 min,收集上层液体并进行蛋白定量。取500 μg 蛋白样品与2 μg 相应的一抗4℃下轻微震荡孵育2 h,后加入20 μL 重悬的Protein A/G Plus-Agarose(Santa Cruz Biotechnology)4℃震荡过夜。4℃下1000 g 离心收集沉淀,PBS(含蛋白酶抑制剂)洗涤4 次。1 × SDS 上样缓冲液重悬沉淀,95℃变性5 min 后用于Western blot 分析。
1.6 Western blot 检测HO-1、STAT-3 蛋白的表达
分离各组大鼠的肺组织,加入RIPA 裂解缓冲液,冰浴1 h,4℃、14 000 r/min 离心,取上清为组织总蛋白;严格按照碧云天生物蛋白提取试剂盒说明书提取蛋白。考马斯亮蓝法进行蛋白定量。总蛋白上样量为100 μg,8%十二烷基硫酸钠—聚丙烯酰胺凝胶电泳后转移至PVDF 膜;5% 脱脂奶粉封闭PVDF 膜2 h,洗膜后加入一抗,4℃过夜,再度洗膜后加辣根过氧化物酶标记的羊抗兔抗体(1∶5000稀释),37℃孵育2 h;洗膜后加ECL 试剂发光,用Quantity One 软件对条带进行统计分析。
1.7 统计学分析
所有数据用SPSS 17.0 软件进行统计学处理,实验数据以均数±标准差(±s),组间比较采用单因素方差分析,组间比较采用t 检验,P <0.05为差异具有统计学意义。
2 结果
2.1 各组实验大鼠肺干湿比(W/D)及生化检测指标
如表1 所示,IR 组大鼠W/D、MDA 及MPO 水平与S 组比较均显著增加(P <0.05 或0.01),IPO组大鼠中上述检测指标与IR 组比较均降低;经HO-1 特异性抑制剂ZnPP 处理后,IPO +ZnPP 组大鼠W/D、MDA 及MPO 与IR 组大鼠比较均无统计学差异(P >0.05),提示HO-1 抑制剂ZnPP 完全取消了IPO 对W/D、MDA 及MPO 的作用。
2.2 各组实验大鼠肺组织中HO-1 活性及蛋白表达情况
如图1 所示,IR 组HO-1 活性及蛋白表达水平与S 组比较均增加,IPO 可以促进HO-1 活性及蛋白表达水平进一步增加,经HO-1 特异性抑制剂ZnPP处理后,HO-1 的活性及蛋白表达显著降低,提示HO-1 抑制剂ZnPP 完全可以取消IPO 对HO-1 的活性及蛋白表达水平的影响。
表1 各组大鼠W/D、MDA 及MPO 比较(n = 10,±s)Tab.1 Comparison of W/D,MDA and MPO in the rats
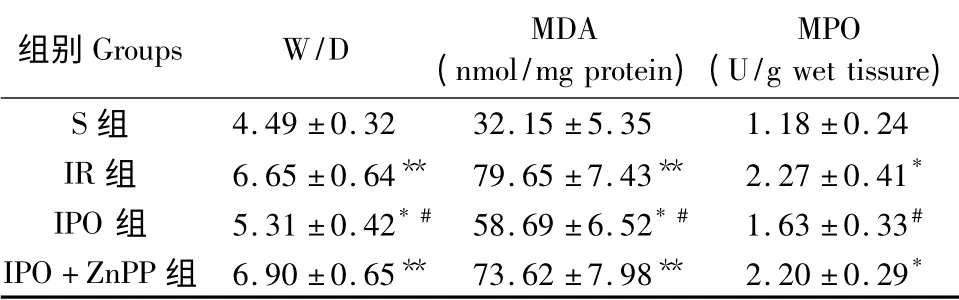
表1 各组大鼠W/D、MDA 及MPO 比较(n = 10,±s)Tab.1 Comparison of W/D,MDA and MPO in the rats
注:* P <0.05,**P <0.01 与S 组比较,#P <0.05 与IR 组比较。S:假手术组;IR:缺血再灌注组;IPO 缺血后处理组;IPO +ZnPP:缺血后处理+HO-1 抑制剂ZnPP 组。Note:* P <0.05,**P <0.01,vs.group S,#P <0.05,vs.group IR;S:Sham group;IR:Ischemia-reperfusion group;IPO:Ischemicpostconditioning group;IPO + ZnPP:Ischemia-reperfusion plus ZnPP group.
组别Groups W/D MDA(nmol/mg protein)MPO(U/g wet tissure)S 组4.49 ±0.32 32.15 ±5.35 1.18 ±0.24 IR 组 6.65 ±0.64** 79.65 ±7.43** 2.27 ±0.41*IPO 组 5.31 ±0.42* # 58.69 ±6.52* # 1.63 ±0.33#IPO+ZnPP 组 6.90 ±0.65** 73.62 ±7.98** 2.20 ±0.29*

图1 IPO 对HO-1 活性(A)及蛋白表达水平(B)的影响Fig.1 Effects of IPO on the HO-1 activity and expression of HO-1 protein in the rats.
2.3 各组实验大鼠缺血肺组织中p-STAT-3 蛋白表达及其与HO-1 蛋白的相互作用关系
在肺缺血再灌注损伤中,与S 组比较,IR 可以显著减少p-STAT-3 蛋白表达水平,而IPO 可以恢复p-STAT-3 表达水平(图2A),应用HO-1 抑制剂可以抑制STAT-3 的磷酸化(图2A);进一步免疫共沉淀结果显示,HO-1 可以与STAT-3 形成蛋白复合体(图2B)。
3 讨论
氧化应激(oxidative stress)是缺血再灌注损伤的重要机制之一。在正常状态下,大多数肺组织细胞(包括内皮细胞、肺泡上皮细胞、膈细胞、纤毛气道上皮细胞以及肺泡内巨噬细胞等)均有产生ROS的能力,并具有一定的生理作用。但在肺缺血再灌注状态下,中性粒细胞大量浸润,“呼吸爆发”产生过量氧自由基,从而导致肺组织损伤。在本实验研究中,我们结果显示缺血再灌注损伤可导致肺组织W/D、MDA 及MPO 增加,提示缺血肺组织水肿、中性粒细胞侵润及氧化损伤增加。因此,阐明肺缺血再灌注状态下氧化应激的影响因素及分子机制是降低肺缺血再灌注损伤的重要途径。

图2 各组实验大鼠肺组织p-STAT3 蛋白表达水平及HO-1 与STAT-3 的相互作用关系Fig.2 Expression of STAT3 protein in the rat lung tissues and relationship between HO-1 and STAT3.
血红素加氧酶(hemeoxygenase,HO)是催化游离血红素生成胆绿素、胆红素、一氧化碳(CO )和铁蛋白的限速酶。它具有三种同工酶:HO-1、HO-2、HO-3。其中,HO-1,也称为热休克蛋白32,是目前研究最多的一种血红素加氧酶同工酶。在多种应激状态下(如缺血再灌注损伤)HO-1 可被迅速诱导增加,从而保护细胞免受氧化应激等病理损伤,近年来被认为是防治心血管疾病重要的治疗靶点。HO-1可以减轻由免疫介导、氧化应激、炎性细胞浸润导致的组织损伤,具有抗氧化、抗炎症反应和抗细胞凋亡等保护作用[8],这种保护作用在组织缺血再灌注、器官移植排斥反应中表现犹为明显[9]。研究显示,HO-1 在IPO 所致正常大鼠心脏及肝脏[10]缺血再灌注损伤保护中均起重要作用。本研究结果显示,急性肺缺血再灌注损伤可促进HO-1 蛋白表达及活性的代偿性增加,IPO 可进一步诱导HO-1 活性及蛋白表达的增加从而抗肺缺血再灌注损伤。
以往研究认为[11],IPO 与IPC 相似,主要通过激活再灌注损伤补救激酶(RISK)通路中的磷脂酰肌醇-3 激酶(phosphatidylinositol 3-kinase,PI3K)-Akt途径而发挥抗缺血再灌注损伤作用。但近年研究显示,IPO 发挥保护作用还与生存活化因子增强通路,特别是Janus 激酶(JAK)与信号转导及转录激活因子-3 途径有关。进一步研究显示,SAFE 通路可独立于RISK 通路而发挥心肌保护作用[12]。在STAT-3 基因敲除鼠模型中,IPO 不能发挥抗心肌缺血/再灌注损伤作用[13]。STAT-3 促进eNOS 活化所生成的一氧化氮(nitric oxide,NO)是IPO 的重要调节因子[14]。这提示STAT-3 是IPO 抗组织缺血再灌注损伤的必要因子,但其具体调控机制仍然不明。新近研究显示STAT-3 在调节肺炎症反应中发挥关键作用[15]。尽管如此,STAT-3 在IPO 抗LIRI 及其诱导的炎症反应中的作用机制未见报道。新近研究显示,HO-1 可诱导STAT-3 的活化而发挥抗肝缺血再灌注损伤作用[7]。我们的结果显示,在肺缺血再灌注损伤中,IPO 可促进HO-1 蛋白表达及活性的增加,同时伴随p-STAT-3 表达水平增加;应用HO-1抑制剂可以抑制STAT-3 的磷酸化,进一步免疫共沉淀结果显示,HO-1 可以与STAT-3 形成蛋白复合体。这提示IPO 所诱导的HO-1 可通过促进STAT-3活化而发挥抗肺缺血再灌注损伤作用。
综上所述,氧化应激是肺缺血再灌注损伤的重要机制,HO-1 是抗肺缺血再灌注损伤的重要途径。缺血后处理可以通过促进HO-1 活性及蛋白表达的增加从而激活STAT-3 通路而发挥抗肺缺血再灌注损伤作用。本研究初步探讨了HO-1/STAT-3 信号通路在缺血后处理抗肺缺血再灌注损伤中的作用机制,以期为临床开发肺缺血再灌注损伤保护药物或措施提供理论依据。
[1]den Hengst WA,Gielis JF,Lin JY,et al.Lung ischemia-reperfusion injury:a molecular and clinical view on a complex pathophysiological process[J].Am J Physiol.Heart and Circ Physiol,2010.299(5):H1283 -299.
[2]de Perrot M,Liu M,Waddell TK,et al.Ischemia-reperfusioninduced lung injury[J].Am J Resp Crit Care Med,2003.167(4):490 -511.
[3]Zhao ZQ,Corvera JS,Halkos ME,et al.Inhibition of myocardial injury by ischemic postconditioning during reperfusion:comparison with ischemic preconditioning[J].Am J Physiol Heart Circ Physiol,2003.285(2):H579 -588.
[4]Lacerda L,Somers S,Opie LH,et al.Ischaemic postconditioning protects against reperfusion injury via the SAFE pathway[J].Cardiovasc Res,2009.84(2):201 -208.
[5]Xu B,Gao X,Xu J,et al.Ischemic postconditioning attenuates lung reperfusion injury and reduces systemic proinflammatory cytokine release via heme oxygenase 1[J].J Surg Res,2011.166(2):e157 -164.
[6]Wu H,Lei S,Yuan J,et al.Ischemic postconditioning downregulates Egr-1 expression and attenuates postischemic pulmonary inflammatory cytokine release and tissue injury in rats[J].J Surg Res,2012.
[7]Ke B.Shen XD,Ji H,et al.HO-1-STAT3 axis in mouse liver ischemia/reperfusion injury:regulation of TLR4 innate responses through PI3K/PTEN signaling[J].J Hepatol,2012.56(2):359 -366.
[8]Raval CM,Lee PJ.Heme oxygenase-1 in lung disease[J].Curr Drug Targets,2010.11(12):1532 -1540.
[9]张宗泽,程怡,王成夭,等.缺血后处理对心肌缺血/再灌注大鼠血红素加氧酶-1 表达的影响[J].武汉大学学报(医学版),2008(03):309 -311,345.
[10]Zeng Z,Huang HF,Chen MQ,et al.Contributions of heme oxygenase-1 in postconditioning-protected ischemia-reperfusion injury in rat liver transplantation[J].Transpl Proc,2011.43(7):2517 -2523.
[11]Tsang A,Hausenloy DJ,Mocanu MM,et al.Postconditioning:a form of "modified reperfusion" protects the myocardium by activating the phosphatidylinositol 3-kinase-Akt pathway[J].Circ Res,2004.95(3):230 -232.
[12]Suleman N.Somers S,Smith R,et al.,Dual activation of STAT-3 and Akt is required during the trigger phase of ischaemic preconditioning[J].Cardiovasc Res,2008.79(1):127 -133.
[13]Boengler K.Buechert A,Heinen Y,et al.Cardioprotection by ischemic postconditioning is lost in aged and STAT3-deficient mice[J].Circ Res,2008.102(1):131 -135.
[14]Paolocci N,Ekelund UE,Isoda T,et al.cGMP-independent inotropic effects of nitric oxide and peroxynitrite donors:potential role for nitrosylation [J].Am J Physiol Heart Circ Physiol,2000.279(4):H1982 -1988.
[15]Tang H,Yan C,Cao J,et al.An essential role for Stat3 in regulating IgG immune complex-induced pulmonary inflammation[J].FASEB J 2011.25(12):p.4292 -4300.
