不同流式抗体分选小鼠原位肝癌模型中髓系来源抑制性细胞的比较
2013-02-05赵文秀张正奇许雅苹吴端尹震宇王效民
赵文秀,张正奇,许雅苹,吴端,尹震宇,王效民
(厦门大学附属中山医院肝胆外科,福建省慢性肝病肝癌重点实验室,福建厦门 361004
髓系来源抑制性细胞(myeloid-derived suppressor cells,MDSCs)作为一种新的免疫抑制性细胞,在肿瘤的免疫逃逸过程中发挥着重要的作用,近年来备受关注[1]。因此获得纯度高、活力好的MDSCs,对其增殖、迁移、分化及免疫抑制功能等进行研究显得尤为重要。在小鼠,它的特异性标志物为CD11b+Gr-1+[2],因此决定了其可以通过流式细胞技术分选获得。本文主要通过用不同的抗体标记:CD11b 单色标记、Gr-1 单色标记以及CD11b 和Gr-1 双色标记,进行流式分选原位肝癌小鼠模型的骨髓中MDSCs 细胞,比较这三种方法获得的MDSCs细胞纯度、得率,确定一个最佳的MDSCs 流式分选方法。
1 材料与方法
1.1 实验材料和试剂
8 ~12 周龄,雄性,体重20 g 左右的BALB/c(H-2d haplotype)小鼠购于上海斯莱克实验动物有限责任公司【SCXY(沪)2007-0005】,喂养于厦门大学医学院实验动物中心【SYXK(闽)2008-0003】。小鼠肝癌细胞H22 购于由中国科学院上海生命科学研究院细胞资源中心。主要试剂:流式用的抗小鼠的APC-CD11b、PE-Gr-1 购于美国BD 公司,Alex flour 488-兔二抗购自美国Invitrogen 公司,1 型精氨酸代谢酶(arginase-1,Arg-1)和诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)抗体购于美国Cell Signaling 公司,红细胞裂解液、活性氧检测试剂盒购于中国碧云天生物科技公司。
1.2 全骨髓的细胞分离
荷瘤小鼠常规处死后,取其双股骨和胫骨,无菌纱布剥除粘附肌肉组织,眼科剪将股骨、胫骨各剪成两段。用眼科镊钳夹住骨头,2 mL 注射器吸取RPMI-1640 基础培养液冲洗骨髓腔,直至骨头变白。吹打混匀细胞悬液,放入10 mL 离心管中,离心1500 r/min,5 min。加入1 mL 红细胞裂解液破红3 min 后,全培终止,离心1500 r/min,5 min。用细胞计数仪进行计数后,2 ×107细胞用1 mL 缓冲液重悬。
1.3 流式细胞的分选
取1 ×107细胞,加入APC-CD11b 或PE-Gr-1 或者同时加入APC-CD11b 和PE-Gr-1 抗体,避光冰上孵育15 min 后,离心去上清。将细胞用500 μL 流式缓冲液重悬,通过细胞滤网后进行流式细胞分选及分析。所使用的流式细胞仪为BD FACS Influx。
1.4 Arg-1 和iNOS 的检测
取3 ×105CD11b 单色标记分选得到的细胞,用固定破膜剂4 度固定1 h 后,离心,再用破膜剂重悬细胞,离心收集;破膜剂100 μL 重悬细胞;再加入兔抗小鼠Arg-1 或iNOS 抗体各1 μL。避光孵育30 min,随后加入Alexflour 488 标记的兔二抗,避光孵育15 min,PBS 洗后上流式细胞仪进行检测。用于检测iNOS 表达的细胞在收集前需用10 μg/mL 的LPS 刺激6h。
1.5 活性氧(reactive oxygen species,ROS)检测
ROS 检测根据中国碧云天生物科技公司的活性氧检测试剂盒进行。
2 结果
2.1 CD11b 单色标记进行分选MDSCs
首先进行CD11b 单色标记分选荷瘤小鼠骨髓细胞,如图1A 所示,CD11b 阳性的细胞占总骨髓细胞的75.5%,流式分选CD11b 阳性的细胞后进行回测,发现分选的细胞CD11b 阳性率可以达到98.2%(图1B),细胞活力为96.7%;随后取出3 ×105细胞,加入0.3 μL Gr-1 抗体,检测通过CD11b 抗体分选的细胞是否是CD11b+Gr-1+MDSCs 细胞,结果显示通过CD11b 单色标记分选得到的细胞中,90.1%为CD11b+Gr-1+MDSCs(图1C)。

图1 CD11b 抗体标记分选骨髓MDSCsFig.1 Enrichment of the MDSCs in bone marrow by CD11b staining
2.2 Gr-1 单色标记进行分选MDSCs
接着进行Gr-1 单色标记分选荷瘤小鼠骨髓细胞,如图2A 所示,Gr-1 阳性的细胞占骨髓细胞的70.3%,通过流细胞仪分选后回测,显示Gr-1 阳性率可以达到97.0%(图2B),细胞活力为98.1%;随后取出3 ×105细胞,加入0.3 μL CD11b 抗体,回测结果显示Gr-1 单色标记分选得到的细胞中,CD11b+Gr-1+MDSCs 可以达到94.4%(图2C)。
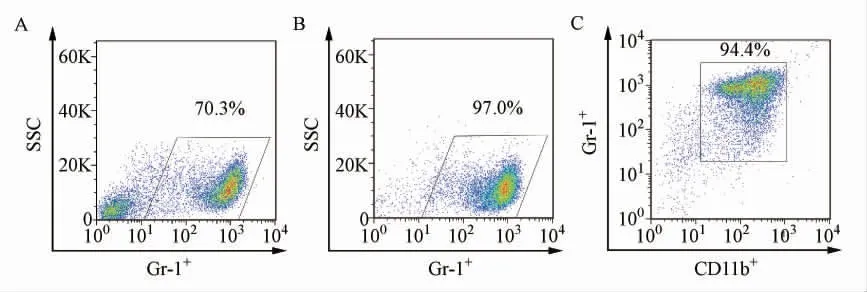
图2 Gr-1 抗体标记分选骨髓MDSCsFig.2 Enrichment of the MDSCs in bone marrow by Gr-1 staining
2.3 CD11b 和Gr-1 双色标记进行分选MDSCs
为了比较CD11b 或Gr-1 单色标记分选的细胞与双色标记分选的细胞是否存在差异,我们又进行了双色标记分选,图3A 显示CD11b 和Gr-1 双阳性的细胞占骨髓细胞的55.1%,流式分选后进行回测,发现分选得到的细胞双阳性率为96.2% (图3B),细胞活力为97.3%;以上三种分选方法的详细比较见表1,三种方法各指标两两比较,差异均无显著性(P >0.05)。
2.4 CD11b 单色标记分选的MDSCs Arg-1、iNOS和ROS 的表达
MDSCs 活化后,主要通过分泌Arg-1、iNOS 以及ROS 发挥其免疫抑制功能[3]。如图4 所示,分选得到的细胞确实高表达Arg-1(图4A)和iNOS(图4B)和ROS(图4C)。证明基于流式细胞分选得到的MDSCs 功能正常,可以用于对MDSCs 进一步的研究。
表1 比较不同的抗体分选MDSCs(±s)Tab.1 Comparison of different antibodies used for the MDSCs enrichment
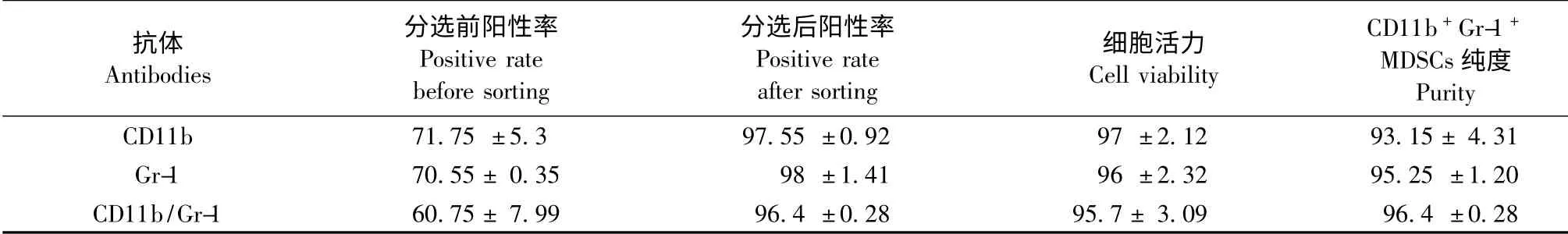
表1 比较不同的抗体分选MDSCs(±s)Tab.1 Comparison of different antibodies used for the MDSCs enrichment
抗体Antibodies分选前阳性率Positive rate before sorting分选后阳性率Positive rate after sorting细胞活力Cell viability CD11b +Gr-1 +MDSCs 纯度Purity CD11b 71.75 ±5.3 97.55 ±0.92 97 ±2.12 93.15 ± 4.31 Gr-1 70.55 ± 0.35 98 ±1.41 96 ±2.32 95.25 ±1.20 CD11b/Gr-1 60.75 ± 7.99 96.4 ±0.28 95.7 ± 3.09 9 6.4 ±0.28

图3 CD11b 和Gr-1 抗体标记分选骨髓MDSCsFig.3 Enrichment of the MDSCs in bone marrow by double stained with CD11b and Gr-1 antibodies
3 讨论
近年的研究越来越多的证实,肿瘤的免疫逃逸除了与肿瘤细胞自身抗原处理缺陷,MHC 分子、共刺激分子及Fas 表达异常外,还与肿瘤微环境中执行负向免疫调控功能的抑制性细胞亚群的浸润密切相关。他们在免疫应答的各个环节发挥着重要的作用,比如调节性T 细胞[4]。近年来,另外一个免疫抑制性细胞——髓系来源抑制性细胞在肿瘤免疫学领域倍受关注。
大量的研究表明MDSCs 具有很强的抑制T 细胞应答的能力,在荷瘤小鼠的血液、脾脏和肿瘤组织,以及肿瘤患者的外周血和肿瘤组织中存在大量的MDSCs,是机体产生肿瘤免疫无应答的主要因素之一[5,6]。最早,Hoechst 等[7]报道在临床肝癌患者体内存在一群CD14 +HLR-/low MDSCs 细胞的表达上调,并发现MDSCs 可以抑制T 细胞反应,诱导CD4+CD25+Foxp3+Treg 细胞的产生。进而研究还发现MDSCs 在体外能够抑制自体NK 细胞活性及其细胞因子的分泌,主要是通过NK 细胞上的NKp30 来介导对NK 细胞的抑制作用[8]。随着人们对肿瘤微环境研究的深入,对肿瘤的研究不再只局限于恶变的肿瘤细胞上,认为肿瘤是在肿瘤细胞与其周围所处的微环境共同作用下形成的[9,10]。因此MDSCs 作为肝癌微环境中重要的免疫抑制细胞,也成为肝癌发生发展机制的一个研究靶点、热点。
在细胞水平研究MDSCs 在肿瘤微环境中作用,首先需要分离、培养出纯度高活力好的MDSCs。首先,我们构建小鼠原位肝癌模型,通过比较三种抗体标记方法对荷瘤小鼠骨髓中的MDSCs 进行分选,发现:不论是单标CD11b 还是Gr-1 或者是进行CD11b、Gr-1 的双色标记,都能分选到活力佳,纯度较高的MDSCs,而且得率都能够达到80%以上。
根据Gr-1 分子中不同表位(Ly6G,Ly6C)的抗体结合特异性不同,MDSCs 又分为两大亚型:CD11b+LY6G+LY6Clow或者CD11b+Gr-1hi/Ly-6Cint的粒细胞型和CD11b+LY6G-LY6C+或者CD11b+Gr-1int/dul/Ly-6Chi的单核细胞型[11]。粒细胞型MDSCs 在Gr-1 的表达上,表现为Gr-1 强/高表达(Gr-1high),而单核细胞型MDSCs 在Gr-1 的表达上表现为Gr-1 中或弱表达Gr-1int/dul。从图2A 可以看到,由于Gr-1 表达上的连续性,Gr-1dim这群细胞的存在,比较难界定Gr-1 的阴性,造成分选进行设门时,门的位置不确定性。而用CD11b 进行分选时,可以看到阳性细胞群和阴性细胞群很容易区分(图1A),可以保证每次实验的重复性和一致性,即使是不同人操作也不易引起实验上的误差。同样的,在进行双色分选时,也存在Gr-1 门不好界定,另外多加一色抗体,除了增加费用外,还为后续的实验带到了更多的麻烦。流式分选得到的细胞,由于抗体和荧光素的存在,这对于后续进行MDSCs 功能及相关免疫学实验会造成一定的影响。当分选得到的细胞需要再进行流式检测分析时,会影响其他荧光抗体的选择,一般荧光素需要在体外传代培养3 到5 代后才会慢慢淬灭。因此,在进行MDSCs 分选时,可以选用CD11b 进行分选,既能满足纯度和得率的需求,又能最大程度减少抗体的使用和荧光素的干扰,同时易于操作。
MDSCs 的免疫抑制功能主要与其Arg-1 及iNOS 的表达有关[3],为此,我们将通过CD11b 分选的细胞进行了这两个指标的检测,结果提示分选的细胞确实高表达Arg-1 和iNOS。MDSCs 发挥免疫抑制活性的另一个重要途径是通过ROS 完成,MDSCs 细胞受到刺激后通过激活STAT3 转录因子,上调NAPDH 氧化酶的活性,进而产生ROS[12]。MDSCs释放的ROS 不仅能造成肿瘤微环境中其他免疫细胞DNA 损伤,而且能抑制MDSCs 向DC、巨噬细胞分化。
通过比较不同流式抗体分选MDSCs 的方法,我们发现利用单色标记CD11b 可以分选到荷瘤小鼠骨髓中纯度高、活力佳的MDSCs。该方法操作方便,易于统一,可作为分选MDSCs 的首选方法。且证实分选的MDSCs 高表达Arg-1、iNOS 和ROS,功能正常,这为后续开展MDSCs 的生物学和免疫学功能研究奠定了基础。
[1]Sevko A,Umansky V.Myeloid-derived suppressor cells interact with tumors in terms of myelopoiesis,tumorigenesis and immunosuppression:thick as thieves.[J].J Cancer.2013,4:3 -11.
[2]Marigo I,Dolcetti L,Serafini P,et al.Tumor-induced tolerance and immune suppression by myeloid derived suppressor cells.[J].Immunol Rev.2008,222:162 -179.
[3]Ostrand-Rosenberg S,Sinha P.Myeloid-derived suppressor cells:linking inflammation and cancer.[J].J Immunol.2009,182:4499 -4506.
[4]Vignali DA,Collison LW,Workman CJ.How regulatory T cells work[J].Nat Rev Immunol.2008,8:523 -532.
[5]Marigo I,Dolcetti L,Serafini P,et al.Tumor-induced tolerance and immune suppression by myeloid derived suppressor cells[J].Immunol Rev.2008,222:162 -179.
[6]Chioda M,Peranzoni E,Desantis G,et al.Myeloid cell diversification and complexity:an old concept with new turns in oncology.[J].Cancer Metastasis Rev.2011,30:27 -43.
[7]Hoechst B,Ormandy LA,Ballmaier M,et al.A new population of myeloid-derived suppressor cells in hepatocellular carcinoma patients induces CD4(+)CD25(+)Foxp3(+)T cells[J].Gastroenterology.2008,135:234 -243.
[8]Hoechst B,Voigtlaender T,Ormandy L,et al.Myeloid derived suppressor cells inhibit natural killer cells in patients with hepatocellular carcinoma via the NKp30 receptor.[J].Hepatology.2009,50:799 -807.
[9]Fidler IJ.The pathogenesis of cancer metastasis:the‘seed and soil’hypothesis revisited[J].Nat Rev Cancer.2003,3:453 -458.
[10].Allen M,Louise Jones J.Jekyll and Hyde:the role of the microenvironment on the progression of cancer.[J].J Pathol.2011,223:162 -176.
[11]Youn JI,Nagaraj S,Collazo M,et al.Subsets of myeloid-derived suppressor cells in tumor-bearing mice.[J].J Immunol.2008,181:579 -5802.
[12]Corzo CA,Cotter MJ,Cheng P,et al.Mechanism regulating reactive oxygen species in tumor-induced myeloid-derived suppressor cells.[J].J Immunol.2009,182:5693 -5701.
