肥胖犬白细胞中相关基因及血浆生化指标的变化
2013-02-05李格宾山本一郎新井敏郎陈武
李格宾,山本一郎,新井敏郎,陈武
(1.北京农学院动物科学技术学院,北京 102206;2.日本兽医生命科学大学生化研究室,东京 180-8602)
近年来随着生活水平不断提高,肥胖症在宠物犬中的发生率越来越高。而体重超标(包括超重和肥胖)是犬最常见的营养失衡之一[1],脂肪量的增加会伴随着各种代谢紊乱,如:高胰岛素血症[2]、胰岛素抵抗、高甘油三脂血症和低脂联素血症。而代谢紊乱会继发糖尿病、心脏病、呼吸系统疾病、肝脏疾病和麻醉并发症等[3]。为了避免肥胖症导致的代谢紊乱进一步恶化,对其早期诊断就显得尤为重要。
荧光定量PCR 技术使我们有机会从微观方面了解肥胖症相关基因的变化。但是对于宠物临床,获取肝脏、脂肪和肌肉等组织用于基因研究并不现实,因此我们采用外周血液,特别是其中的白细胞(PBL)作为研究来源,相对于其他组织,外周血液采集方便并可重复足量采集,且不会对宠物造成侵入性损伤[4]。PBL 游走于机体各器官组织中,其基因变化已被用于一些人类疾病分子机制的研究[5]并能预警机体的异常变化[6]。而且有数据表明外周血液单核细胞(PBMC)与其他组织的基因表达有很高的一致性(80%)[7],因PBMC 中基因变化敏感,已被应用于人类肥胖症的相关研究[8,9]。目前有很多实验已经应用PLB 进行胰岛素通路[10]、脂联素通路[11]、能量[12]和醇类[13]代谢相关的基因研究。综上,外周血液中基因的变化作为一个有价值的指标被广泛应用于能量代谢等各种的研究中。
本研究的目的是通过检测PBL 中的胰岛素相关基因,分析用其表示超重和肥胖犬的基因异常变化是否足够敏感,并检测血浆中与肥胖症相关的生化指标,探究血浆指标与其相关基因的变化规律。PBL 作为一种易于获得的来源,其基因表达也可作为犬,特别是宠物临床自然发胖犬的一种评价监测其代谢状况的指标。
1 材料和方法
1.1 实验动物和物理指标测量
2011年9 ~10月和2012年4 ~5月,59 只在日本东京3 家不同动物医院进行体检的犬。本研究中所采用的临床犬,全部进行了常规的血液生化学检查,没有明显的临床证据表明患有急性或慢性疾病(除了超重或肥胖)。采用5 分制的身体评分指数(body condition score,BCS)对每只犬进行评分[3]。3 家医院各1 名兽医师通过视诊和触诊覆盖在肋骨区的脂肪量对犬进行分类评分,其中26 只犬属于理想体型[2.5≤BCS≤3.0,16 只母犬(6 只已绝育)和10 只公犬(3 只已去势)];28 只犬属于超重体型[3.5≤BCS≤4.0,13 只母犬(7 只已绝育)和15 只公犬(11 只已去势)];5 只犬属于肥胖症体型[4.5≤BCS≤5.0,2 只母犬(1 只已绝育)和3 只公犬(2只已去势)]。
1.2 血样采集
从犬后肢外侧小隐静脉采集血样(餐后4 h)4~5 mL。3 mL 血样注入PAXgene blood RNA V.2 kit tubes (PreAnalytiX GmbH)后颠倒10 次,室温静置2 h,转移至-20℃冷冻过夜,在-80℃冰箱储存备用。剩下的血液放入肝素抗凝管,立即1200 g 离心10 min 获得血浆,转移至-80℃冰箱保存。
1.3 血浆中生化指标的检测
应用自动分析仪(AU680,Monolis Corporation)测定血浆中葡萄糖(glucose)、尿素氮(BUN)、肌氨酸酐(CRE)、总胆固醇(T-Cho)、总蛋白质(TP)、三酸甘油酯(TG)、乳酸脱氢酶(LDH)、碱性磷酸酶(ALP)、天冬氨酸转氨酶(AST)和丙氨酸转氨酶(ALT)的浓度。采用NEFA-C test 试剂盒测定非酯化脂肪酸(NEFA)浓度,分别用ELISAs 试剂盒(mouse/rat[Otsuka]和Llbis Dog[Shibayagi])测定脂联素和免疫反应胰岛素(IRI)的浓度。
1.4 外周血液中白细胞mRNA 的实时测定
应用PAXgene Blood RNA V.2 试剂盒和QIAamp RNA blood 迷你试剂盒分离并提取PBL 中总RNA。采用E-spect malcom (No.08728036)测定RNA 的浓度后应用SYBR premix ExTaq II,ROX reference dye(Takara Bio,Shiga,Japan)和0.2 μmol/L 各基因引物(引物为自主设计)进行荧光定量PCR。反应采用20 μL 体系,反应条件为95℃5 s 和60℃34 s 40 个循环。定量方法采用含有每个基因cDNA 的质粒DNA 建立一系列不同稀释度的线性扩增曲线。全部基因平行测定三次,采用β-actin 作为看家基因,使用PCR Real-Time PCR System 7300 (Applied Biosystems,Foster City,CA)进行测定。
1.5 统计分析
血浆代谢指标以中位数和最小- 最大范围表示,应用Mann-Whitney U-test 进行不同组间显著性分析,P <0.05 为差异有显著性。基因数据以相对表达量(所有目的基因拷贝数除以β-actin 的拷贝数来进行标准化)的中位数和最小/最大值来显示,采用不正常分布的Kruskall-Wallis One Way ANOVA on Ranks 进行不同组间显著性统计分析,P <0.05为显著性差异。所有数据采用Sigmaplot 进行统计分析(Version.11.2,Build 11.2.0.5,Systat Software Inc.,San Diego,CA)。
2 结果
2.1 血浆中代谢产物结果
临床基本检查和各种代谢酶的指标可见表1。超重犬血浆中胰岛素显著高于对照组(P <0.05),肥胖犬血浆中胰岛素,非酯化脂肪酸,总胆固醇和三酸甘油酯均显著高于对照组(P <0.05)。

表1 临床物理检查指标和血浆代谢指标Tab.1 Clinical characteristics and plasma metabolite concentrations
2.2 外周血液白细胞中mRNA 荧光定量PCR 测定结果
三组犬PBL 中mRNA 表达量见图1。与对照组相比,肥胖组胰岛素信号通路和葡萄糖代谢相关基
3 讨论
实验结果显示,超重组和肥胖组与对照组相比,血液循环中均有较高水平的TG,T-Cho 和NEFA,特别是肥胖组TG、T-Cho 和NEFA 分别为对照组的4倍、1.75 倍和5 倍。这个结果与以前关于肥胖动物的研究结果一致[14,15],已有实验证明血浆中TG 和T-Cho 浓度增加会导致犬胰脏代谢紊乱[16],并且还有研究怀疑血浆中NEFA 的变化可能是代偿性高胰因,IRS-2(约50%)和MDH(约80%)的表达量有显著下降(P <0.05)。脂联素信号通路和脂类代谢相关基因中,与对照组和超重组相比,肥胖组FAS(分别约50%)有显著性下降(P <0.05)。岛素血症的信号[17]。而且本实验结果也显示了随着犬体重的不断增加,其体内的脂类代谢紊乱状况越加严重。
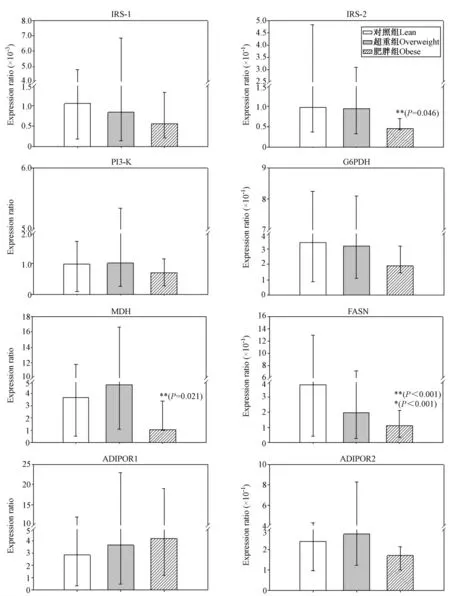
图1 对照组与超重组和肥胖组比较PBL 中的基因表达量Fig.1 Comparison of gene expression in PBL of the 3 groups
基因FAS,G6PDH 和MDH 的变化进一步说明了超重犬能量代谢异常。MDH 参与糖元异生且是柠檬酸循环的重要组成部分,肥胖犬PBL 中MDH mRNA 的表达量显著降低,间接显示了在肥胖犬中葡萄糖和脂类代谢率都显著降低,先前的大鼠研究表明在长期进行耐力训练的大鼠脂肪和肌肉中MDH 活性升高[18],且在可能伴随胰岛素抵抗的糖尿病猫中,MDH mRNA 表达量显著降低[19]。另外,G6PDH 参与磷酸戊糖途径,为组织提供NAPDH 并参与生物合成脂肪酸和/或异戊二烯化合物。与对照组相比,肥胖犬的G6PDH mRNA 表达量有下降趋势,且伴随着FAS 的显著下降。FAS 参与脂肪酸合成,在高脂肪饲喂小鼠[2]和猫[20]的实验中,FAS 均显著下降,本实验结果表明随着犬体重增加,其血浆中NEFA 显著增加,其合成脂肪酸的能力也显著下降,因肥胖犬更趋向于排出体内过多的游离脂肪酸。MDH、G6PDH 和FAS 表达变化进一步说明了体内脂肪累积会导致犬代谢紊乱。
本实验结果还显示了在超重和肥胖犬中,血液中胰岛素含量显著增高,但是葡萄糖含量并没有显著变化。这说明在慢性自然发胖的犬中,不断升高的葡萄糖导致机体分泌更多的胰岛素来代偿肥胖导致的胰岛素抵抗。而且由于IRS-1,IRS-2 和PI3-K p-85α 是胰岛素重要的下游信号通路基因且与胰岛素抵抗和糖尿病密切相关,所以我们测定了其mRNA 的表达量。实验结果表明肥胖组IRS-2 mRNA表达量显著下降,且肥胖组IRS-1 和PI3-K p-85α mRNA 表达量有下降趋势,这与患有胰岛素抵抗的病人相同基因蛋白质水平研究结果一致[21]。与IRS-1 相比,IRS-2 与胰岛素的关系更加紧密,有研究显示在IRS-2 基因缺陷的4 周大的小鼠模型表现出明显的胰岛素抵抗肥胖症[22]。本实验室以前关于肥胖症猫的实验结果也表明超重猫PBL 中IRS-2 mRNA 表达量有显著降低[10];另外,在应用胰岛素治疗患有1 型糖尿病的犬2 周后的实验中,其PBL中IRS-2 和PI3-K p-85α mRNA 表达量均有显著提高[23]。尽管肥胖犬患有严重的胰岛素抵抗,但并不会像猫和人类一样发展成为2 型糖尿病[24],关于这方面的原因和机理目前并不清楚。
胰岛素作用的分子机制是通过复杂的信号网络,最近有研究表明脂联素通过调整胰岛素信号通路并且参与葡萄糖和脂类代谢直接或间接影响组织对胰岛素的敏感性[25]。脂联素通过两个细胞膜受体AdipoR1 和AdipoR2 发挥胰岛素增敏剂的作用,且AdipoR1 与胰岛素的分泌和敏感性关系更为密切,本实验中AdipoRs 的并没有显著变化可能是因为犬类存在某些代偿机制。犬血浆中脂联素浓度随着肥胖程度增加而呈现降低趋势,与人类和猫相似,但由于目前犬类的脂联素与肥胖症的关系还存在争议,有些研究认为犬脂联素与肥胖程度成负相关[26,27],而有些研究认为成正相关[28],有些研究甚至认为在犬类脂联素与肥胖症无关联[2,29]。造成这种差异结果的原因目前并不清楚,但是可能有以下几种原因造成:绝育状况[30],品种和性别[31],饮食状况[32]。在本实验中,超重组和肥胖组大约都有60%的犬是绝育犬,这是因为绝育后的犬易发生超重或肥胖[33]。而且本实验采用的是自然发胖的犬,对其饮食状况并不了解,也没有进行品种和性别分组比较,所以不能确定脂联素与肥胖症之间像人类那样存在必然的负相关。
本研究也存在一定的局限性。首先,虽然在人类和其他物种中PBL 的基因表达与其他组织有很高的一致性(大于80%)[12],但在犬猫中还并没有被证实,所以将来的实验应该在检测PBL 的同时检测其他组织样本(如肝脏,肌肉和脂肪等)。第二,本实验只测定了基因的mRNA 表达量,没有进行蛋白表达水平的测定,所以对基因表达的趋势和结论的描述应谨慎,因为不是所有的mRNA 都会转化为蛋白。第三,本实验中肥胖症犬的数量并不多,而且没有进行同样品种,年龄和性别的分类,所以在将来的实验中应增加样本数来使统计结果更有说服力。最后,本实验并没有进行脂联素亚型的测定,所以并不清楚是哪种亚型起主要作用使超重犬脂联素的水平降低,我们计划在今后的相关实验中对脂联素进行分型测定。
4 结论
临床上自然发胖的犬随着脂肪量的不断增多出现越来越严重的脂类和能量代谢异常,表现为血浆中NEFA,TG,T-cho 显著升高,MDH、G6PDH、FAS表达量降低。肥胖犬血浆内葡萄糖不变,但是胰岛素显著升高,且伴随胰岛素下游基因(IRS-1,IRS2,PI3-K p-85α)的表达量降低,说明肥胖犬患有高胰岛素血症,且有可能造成胰岛素抵抗。PBL 作为一种方便易获取的研究来源,其中与葡萄糖和脂类代谢相关的基因可间接反映超重和肥胖症造成其对应组织中基因的异常变化,相关基因将来可作为犬肥胖症预警的生物指标。
[1]German A J.The growing problem of obesity in dogs and cats[J].J Nutr.2006,136 (7):1940 -1946.
[2]Kim S P,Ellmerer M,Van Citters,G W,et al.Primacy of hepatic insulin resistance in the development of the metabolic syndrome induced by an isocaloric moderate-fat diet in the dog[J].Diabetes.2003,52(10):2453 -2460.
[3]Burkholder WJ,Toll PW.Small Animal Clinical Nutrition[M].Fourth Ed.Topeka:Mark Morris Institute.2000,401 -425.
[4]de Mello V D,Kolehmainen M,Schwab U,et al.Effect of weight loss on cytokine messenger RNA expression in peripheral blood mononuclear cells of obese subjects with the metabolic syndrome[J].Metabolism.2008,57(2):192 -199.
[5]Eady J J,Wortley G M,Wormstone Y M,et al.Variation in gene expression profiles of peripheral blood mononuclear cells from healthy volunteers[J].Physiol Genomics.2005,22(3):402 -411.
[6]Visvikis-Siest S,Marteau J B,Samara A,et al.Peripheral blood mononuclear cells (PBMCs):a possible model for studying cardiovascular biology systems[J].Clin Chem Lab Med.2007,45(9):1154 -1168.
[7]Liew C C,Ma J,Tang H C,et al.The peripheral blood transcriptome dynamically reflects system wide biology:a potential diagnostic tool[J].J Lab Clin Med.2006,147(3):126 -132.
[8]de Mello VD,Kolehmainen M,Pulkkinen L,et al.Downregulation of genes involved in NFkappaB activation in peripheral blood mononuclear cells after weight loss is associated with the improvement of insulin sensitivity in individuals with the metabolic syndrome:the GENOBIN study[J].Diabetologia.2008,51(11):2060 -2067.
[9]Ghanim H,Aljada A,Hofmeyer D,et al.Circulating mononuclear cells in the obese are in a proinflammatory state[J].Circulation.2004,110(12):1564 -1571.
[10]Mori A,Lee P,Takemitsu H,et al.Decreased gene expression of insulin signaling genes in insulin sensitive tissues of obese cats[J].Vet Res Commun.2009,33(4):315 -329.
[11]Kollias A,Tsiotra P C,Ikonomidis I,et al.Adiponectin levels and expression of adiponectin receptors in isolated monocytes from overweight patients with coronary artery disease[J].Cardiovasc Diabetol.2011,10(14):14 -26.
[12]Caimari A,Oliver P,Keijer J,et al.Peripheral blood mononuclear cells as a model to study the response of energy homeostasisrelated genes to acute changes in feeding conditions [J].OMICS.2010,14 (2):129 -141.
[13]Caimari A,Oliver P,Rodenburg W,et al.Feeding conditions control the expression of genes involved in sterol metabolism in peripheral blood mononuclear cells of normoweight and diet-induced (cafeteria)obese rats[J].J Nutr Biochem.2010,21(11):1127 -1133.
[14]Li G B,Lee P,Mori N,et al.Supplementing 5-point body condition score with body fat percentage increases the sensitivity for assessing overweight status of small-medium size dogs[J].Vet Med:Res Rep.2012,3:71 -78.
[15]Hatano Y,Mori N,Asada M,et al.Hypertriglyceridemia with increased plasma insulin concentrations in cats [J].Res Vet Sci.2010,88(3):458 -460.
[16]Umeda T,Bauer J E,Otsuji K.et al.Weight loss effect of dietary diacylglycerol in obese dogs[J].J Anim Physiol Anim Nutr(Berl).2006,90(5):208 -215.
[17]Stefanovski D,Richey J M,Woolcott O,et al.Consistency of the disposition index in the face of diet induced insulin resistance:potential role of FFA [J].PLoS One.2011,6(3):e18134.
[18]Stallknecht B,Vinten J,Ploug T,et al.Increased activities of mitochondrial enzymes in white adipose tissue in trained rats[J].Am J Physiol.1991,261(3):410 -414.
[19]Magori E,Nakamura M,Inoue A,et al.Malate dehydrogenase activities are lower in some types of peripheral leucocytes of dogs and cats with type 1 diabetes mellitus[J].Res Vet Sci.2005,78(1):39 -44.
[20]Lee P,Mori A,Takemitsu H,et al.Lipogenic gene expression in abdominal adipose and liver tissues of diet-induced overweight cats[J].Vet J.2011,190(2):150 -153.
[21]Rondinone CM,Wang LM,Lonnroth P,et al.Insulin receptor substrate (IRS)1 is reduced and IRS-2 is the main docking protein for phosphatidylinositol 3-kinase in adipocytes from subjects with non-insulin-dependent diabetes mellitus [J].Proc Natl Acad Sci U S A.1997,94(8):4171 -4175.
[22]Hashimoto H,Arai T,Takeguchi A,et al.Ontogenetic characteristics of enzyme activities and plasma metabolites in C57BL/6J:Jcl mice deficient in insulin receptor substrate 2[J].Comp Med.2006,56(3):176 -187.
[23]Mori A,Lee P,Sako T,et al.Successful intensive insulin treatment of type 1 diabetic dogs leads to restoration of peripheral leukocyte insulin signaling gene expression and enzyme activities[J].J Vet Med Sci.2009.71(8):1017 -1026.
[24]Rand JS,Fleeman LM,Harrow HA,et al.Canine and feline diabetes mellitus:nature or nurture?[J].J Nutr.2004,134(8):2072 -2080.
[25]Kershaw EE,Flier JS.Adipose tissue as an endocrine organ[J].J Clin Endocrinol MeTab.2004,89(6):2548 -2556.
[26]Ishioka K,Omachi A,Sagawa M,et al.Canine adiponectin:cDNA structure,mRNA expression in adipose tissues and reduced plasma levels in obesity[J].Res Vet Sci.2006,80(2):127 -132.
[27]Mori N,Sakai M,Yamamoto I,et al.Alternation of physical indexes and plasma biochemical makers in overweight dogs induced by high-fat diet feeding[J].Res J Vet Sci.2011,4(1):14 -19.
[28]Wakshlag J,Struble A,Levine C,et al.Effects of weight loss on adipokines and markers of inflammation in dogs[J].Br J Nutr.2011,106(1):11 -14.
[29]Tvarijonaviciute A,Ceron J J,Holden S L,et al.Obesity-related metabolic dysfunction in dogs:a comparison with human metabolic syndrome[J].BMC Vet Res.2012,28(8):147.
[30]Verkest K R,Rose F J,Fleeman L M,et al.Adiposity and adiponectin in dogs:investigation of causes of discrepant results between two studies[J].Domest Anim Endocrinol.2011,41(1):35 -41.
[31]Grant RW,Vester Boler BM,Ridge TK,et al.Adipose tissue transcriptome changes during obesity development in female dogs[J].Physiol Genomics.2011,43(6):295 -307.
[32]Pischon T,Girman CJ,Rifai N,et al.Association between dietary factors and plasma adiponectin concentration in men[J].Am J Clin Nutr.2005,81(4):780 -786.
[33]Lund EM,Armstrong PJ,Kirk CA,et al.Prevalence and risk factors for obesity in adult dogs from private US veterinary practices[J].Intern J Appl Res Vet Med.2006,4(2):177 -186.
