钇掺杂TiO2形态结构表征及光催化活性研究
2013-01-30樊国栋郭淑清刘保健林振宇
樊国栋, 郭淑清, 刘保健, 沈 文, 林振宇
(1.陕西科技大学 化学与化工学院 教育部轻化工助剂化学与技术重点实验室, 陕西 西安 710021; 2.陕西科技大学 生命科学与工程学院, 陕西 西安 710021; 3.福州大学 食品安全分析与检测技术教育部重点实验室, 福建 福州 350002)
0 引言
半导体光催化剂因具有低温、非耗能等突出特点而在光催化氧化化学污染物领域具有非常好的发展前景[1].纳米二氧化钛因具有纳米粉体的表面效应、体积效应、小尺寸效应、久保效应等成为目前已发现的最好的光催化剂[2].因为TiO2在一定波长的光照下,可被激发而生成光生电子-空穴对,由这些光生电子-空穴转移到催化剂表面和被吸附于TiO2光催化剂表面的有机污染物发生氧化还原反应而使污染物发生降解[3].
目前,TiO2光催化剂在应用方面遇到的最大障碍是电荷转移速率低于光生电子-空穴复合的速率,导致催化剂不能高效地降解污染物[1].为了提高其量子效率,可通过对催化剂制造缺陷来捕获光生电子而使光生电子-空穴有效分离,从而降低两者的复合程度[4,5].已有研究发现了一种可以控制TiO2表面性能的有效方法,即通过对TiO2进行金属离子掺杂而使TiO2晶格产生缺陷,这些缺陷正好成为光生电子-空穴的捕获中心,以此方式来阻止光生电子-空穴复合,从而提高催化剂光催化效率.
大量研究发现,稀土离子对TiO2的掺杂改性使光催化效率得到了提高,并且化学掺杂同时还通过在TiO2带隙之间建立杂质能级[4],使激发光能量降低而拓宽了吸收光波长范围,使可见光响应活性大大提高.Y2O3具有良好的化学和光化学稳定性、高熔点、易于实现稀土掺杂等优点,是一种优良的发光材料基质[6];同时由于Y2O3具有约为430~500 cm-1的较低声子能量,是一种很好的上转换发光材料,其能够在980 nm红外光和可见光激发下发射更短波长的光[7].因此,将钇(Y)作为对TiO2的掺杂改性元素可能会使催化剂光使用率提高.
王进贤[8]等人发现掺杂钇的TiO2纳米纤维对罗丹明B和苯酚有较好的降解活性.江学良[9]等人通过研究表明掺有钇的有序多孔TiO2能很好地降解甲基橙,且钇的掺杂使TiO2吸收光红移至可见光区.滕文生[10]等人的研究结果表明Y3+掺杂能抑制TiO2的晶粒增长,提高相转变温度,扩大光响应范围.晏爽[11]等人也通过研究发现掺杂钇能提高二氧化钛的光催化活性,因为Y3+更容易进入TiO2晶格间隙,在TiO2中分布更均匀,使对甲基橙的降解效率大大提高.
本文则以钛酸丁酯为钛源,通过溶胶凝胶法制备了掺杂钇(Y)的TiO2光催化剂,并通过对甲基橙的光催化降解来研究其光催化降解性能.
1 实验部分
1.1 主要试剂和仪器
(1)主要试剂:钛酸丁酯(Ti(O-C4H9)4)(C.P),天津市福晨化学试剂厂;无水乙醇(C2H5OH)(A.R),天津市天力化学试剂有限公司;冰乙酸(CH3COOH)(A.R),天津市富宇精细化工有限公司;氧化钇(Y2O3)(高纯),国药集团化学试剂有限公司;甲基橙(AR),天津市科密欧化学试剂开发中心.
(2)主要仪器:X射线衍射(XRD)仪,日本理学D/MAX2200PC型;扫描电镜(SEM),HITACHI S-4800型; 能谱仪,美国EDAX Apollo XL型;紫外-可见分光仪,Agilent Technologies Cary100型;表面孔隙度分析仪,美国康塔Quantachrome Instruments Nova 2200E型.
1.2 光催化剂的制备
(1)在不断搅拌条件下,将钛酸丁酯加入无水乙醇中,继续加入冰醋酸形成A体系液;将去离子水和无水乙醇及冰醋酸混合形成B体系液.将B液逐滴加入A液,不断充分搅拌直至形成均一透明溶胶.室温静置30 h,形成稳定凝胶.90 ℃干燥,550 ℃煅烧4 h,得白色纯TiO2光催化剂粉末.
(2)将一定量Y2O3溶解于硝酸,形成钇的硝酸溶液,加入钛酸丁酯、无水乙醇和冰乙酸的混合液中并快速搅拌,然后边搅拌边逐滴滴入上述B液,滴完继续搅拌1 h,室温陈化30 h至形成稳定凝胶.90 ℃干燥,550 ℃煅烧4 h,得白色掺Y复合纳米TiO2光催化剂粉体.
1.3 催化剂的表征
X射线衍射仪(XRD)对样品进行物相及结构分析,测试条件为:管电压40 kV,管电流40 mA,Cu Kα辐射;扫描电镜(SEM)观察样品形貌、粒度及粒度分布情况;能谱仪(EDS)检测掺杂元素的浓度分布;紫外-可见分光仪检测样品对甲基橙的降解情况;表面孔隙度分析仪对样品的比表面积和孔隙度进行测试分析.
1.4 光催化降解活性测试
配制浓度为25 mg/L的甲基橙目标降解物.分别取2 mg制备好的纯TiO2和TiO2(Y)于目标降解物中,经超声分散15 min后,于自制光反应器中用25 W的紫外杀菌灯辐射.每15 min后将样品离心后用紫外-可见分光光度计测定最大吸收波长处的吸光度,并比较前后吸光度变化,根据Beer定律计算两种催化剂对甲基橙的降解率.
2 结果与讨论
2.1 样品形貌表征及能谱分析
图1为样品的SEM图.由SEM图看出,粒子团聚在一起形成了颗粒大小均一的小球状,由高倍SEM图可大致看出制备的催化剂纳米粒径约为10~20 nm.从图1中观察还可发现,所制备的催化剂表面分布有大量的小孔,说明制备的催化剂孔隙度较好,这对催化效率的提高起到至关重要的作用.图2为对样品进行能谱面扫描表征的结果,由图2中看出掺杂的Y在催化剂中分布均匀.
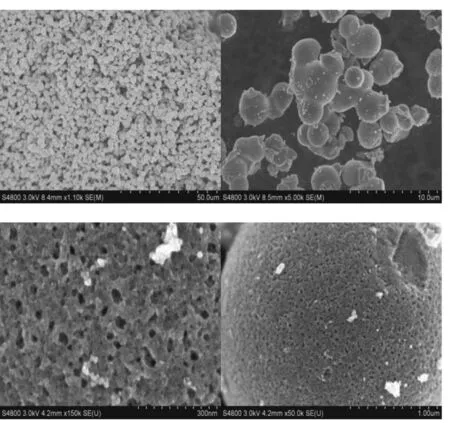
图1 掺Y样品SEM图

图2 掺Y的TiO2中元素面扫描分布图
2.2 样品比表面积和孔隙度分析
图3为样品的氮吸附-脱附等温线及样品比表面积、孔径分布图.图3(a)曲线符合Brunauer分类中的Ⅴ型等温线,其曲线带有滞后环,这是由于样品孔壁多分子层吸附和毛细管凝聚现象导致的结果.此种类型的曲线表明,样品的孔可能为两端开口的圆筒孔、平行板结构的狭缝孔或“墨水瓶”结构的孔型.根据吸附-脱附等温线、多点BET法、BJH法等计算得到的掺杂TiO2和纯TiO2的比表面积、孔容、平均孔径的数据见表1所示.
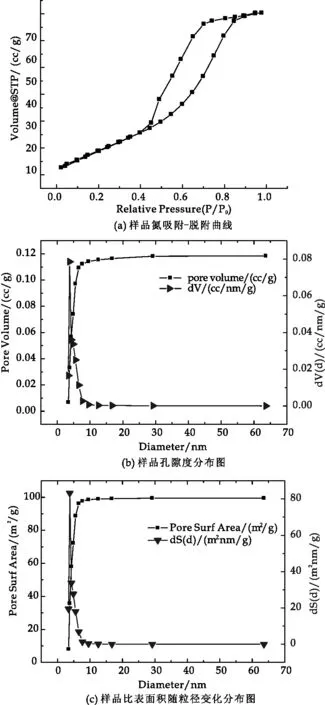
图3 掺Y样品孔隙分布图
由表1得知,Y掺杂的TiO2比表面积为99.43 m2/g,比纯TiO2比表面积49.03 m2/g要大将近一倍,孔容比纯TiO2大,这证明制备的掺Y的TiO2孔隙度较高,有利于提高对污染物的吸附,这和SEM观察到的孔隙结果是相符合的.所有这些变化都有利于催化剂催化效率的提高.
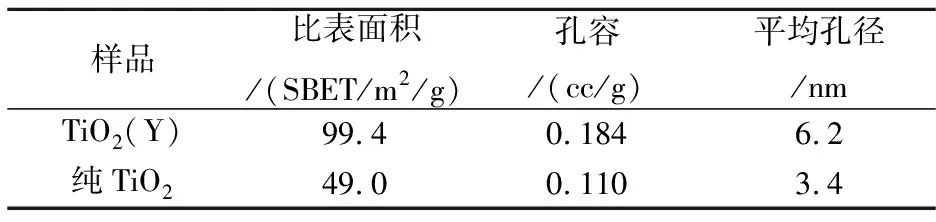
表1 样品和纯TiO2的比表面积和孔径分布
2.3 XRD分析
样品XRD图表明样品为锐钛矿型TiO2.图4中晶面(101)为锐钛矿TiO2的特征峰之一.图4中没有出现金红石相的特征峰,说明550 ℃煅烧并没有使锐钛矿向金红石相转变.图4中29.08 °处是Y2O3晶面(222)的特征吸收峰,说明样品中成功掺杂了Y.掺Y的XRD图还表明Y的掺杂并没有引起TiO2晶形改变.根据Scherrer公式:D=Kλ/βcosθ(K=0.89,λ=0.154 nm,β为衍射峰半峰宽,θ为衍射角),计算得出各物质的晶粒尺寸,结果见表2所示.
从实验结果可以看出,无论纯TiO2还是掺Y的TiO2,溶胶凝胶法制备的催化剂其晶粒尺寸较小,介于10~20 nm之间.TiO2掺杂Y后,其晶粒尺寸减小5 nm左右.

表2 纯TiO2和掺Y的TiO2的晶粒大小
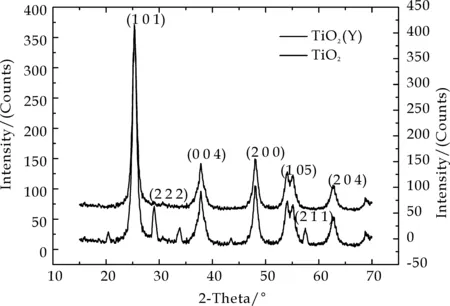
图4 纯TiO2和掺Y的TiO2的XRD图
2.4 催化剂光催化降解甲基橙
图5为纯TiO2和掺Y的TiO2在紫外光和可见光照下对甲基橙的降解率.从图5(a)中可以看出,在紫外光辐射90 min后,对甲基橙的降解率分别达到85%和50%,这说明掺Y的催化剂比纯TiO2催化活性提高很多.另外,通过六日的日光辐射发现,虽然日光对甲基橙的响应活性较低,降解率较低,但在催化剂掺杂Y后,通过日光对甲基橙的降解率还是提高了22%,这说明TiO2掺杂Y后,不仅在催化剂中形成大量缺陷用来成为光生电子-空穴的捕获中心,抑制其复合,而且可能在催化剂带隙之间形成杂质能级,降低带隙激发能量,从而引起可见光响应.另外,由于Y2O3具有约为430~500 cm-1的较低声子能量,是一种很好的上转换发光材料,其能够在980 nm红外光和可见光激发下发射更短波长的光[7],故也可以提高对甲基橙的光催化效率.
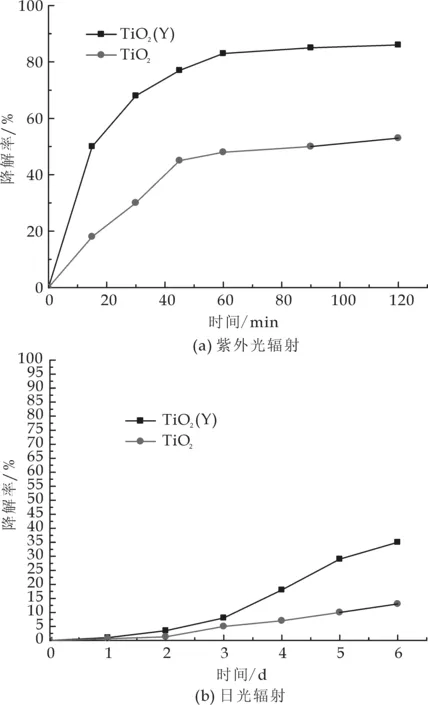
图5 纯TiO2和掺Y的TiO2对甲基橙的降解率
3 结论
通过溶胶凝胶法制备了纯纳米TiO2和掺杂Y的TiO2,对其进行能谱、SEM、孔隙度、比表面积、XRD等的表征,证明它是粒径为10~20 nm之间的纳米粒子,虽然催化剂有部分团聚现象,但整体比表面积较高,孔隙度较好.XRD的表征结果说明其为锐钛矿,而并不含有对催化不利的金红石相.对甲基橙的紫外光和日光光催化降解实验证明掺杂有Y的TiO2的催化效率比纯TiO2有很大的提高.实验还表明掺Y的TiO2对可见光的响应活性比纯TiO2有一定提高.
[1] Zhang Zhi-bo, Wang Chen-chi,Rama Zakaria,et al.Role of particle size in nanocrystalline TiO2-based photocatalysts[J].the J Phys Chem B,1998,102(52):10 871-10 878.
[2] 杨 柯,刘 阳.纳米二氧化钛的制备技术研究[J].中国陶瓷,2004,40(4):8-12.
[3] Hoffmann M R,Martin S T,Choi W,et al.Environmental applications of semiconductor photocatalysis[J].Chemical Reviews,1995,95(1):69-74.
[4] 蔡伟民,龙明策.环境光催化材料与光催化净化技术[M].上海:上海交通大学出版社,2011.
[5] 唐绍裘,周武艺.纳米TiO2的掺杂改性及光催化性能的研究[D].长沙:湖南大学,2005.
[6] 章 健,王士维,安丽琼,等.980 nm LD激发下Yb3+, Er3+:Y2O3纳米晶粉体的上转换发光[J].发光学报,2005,26(6):791-795.
[7] 叶岩溪,刘恩周,胡晓云.高比表面积Y2O3:Er3++TiO2的制备及上转换发光特性研究[J].科学通报,2011,56(22):1 797-1 803.
[8] 王进贤,郭月秋,董相廷,等.钇或钕掺杂TiO2纳米纤维的制备及光催化性能研究[J].无机材料学报,2010,25(4):379-385.
[9] 江学良,杨 帆,吉钰纯,等.钇掺杂有序大孔TiO2微球的制备与光催化性能研究[J].中国稀土学报,2011,29(3):277-283.
[10] 滕文生, 崔文国,李孝红,等.钇掺杂TiO2纤维的制备及光催化性能研究[J].化学工程与装备,2012(9):1-3.
[11] 晏 爽,江学良,蔡盛臻,等.钇掺杂改性纳米二氧化钛及其光催化性[J].武汉工程大学学报,2010,32(12):65-68.
