响应面法优化大孔吸附树脂分离苹果渣根皮苷的工艺
2013-01-29宋晓宇
刘 迪, 尚 华, 宋晓宇
(1.陕西工业职业技术学院 化工与纺织学院, 陕西 咸阳 712000; 2.陕西海升果业发展股份有限公司, 陕西 西安 710100)
0 引言
根皮苷属于多酚类物质,分子式为C21H24O10, 为多酚物质中植物黄酮类中的二氢查尔酮苷.根皮苷主要存在于苹果树的根皮、茎、嫩叶以及苹果果实中[1-5], 具有多种生物活性[6-12], 如调节血压、血糖,保护心脏、清除体内自由基及美白等,并且还具有低毒的特点.目前,从植物中提取根皮苷的主要原料为苹果植物,近年来在多穗柯植物中也发现了含量比较丰富的根皮苷[13,14].然而,在苹果榨汁过程中,大部分多酚物质随果皮和果芯而转移到果渣中,因此苹果渣中含有较多的多酚物质,其中含量较多的为根皮苷.
本研究以苹果渣为原料,以根皮苷为分离纯化对象,采用有机溶剂提取法制备粗提物,应用大孔吸附树脂进行分离纯化,通过Box-Behnken中心组合设计原理,应用响应面[15-19]试验优化方法研究最佳的分离条件,以期为苹果渣深度加工和综合利用提供参考,同时为寻找根皮苷的制备原料开辟一条新的途径.
1 材料与方法
1.1 材料与试剂
苹果渣:由陕西海升果业发展股份有限公司提供,自然风干后存放备用.
根皮苷标准品(含量>99.9%),美国Sigma公司;甲醇、甲酸,色谱纯;其它试剂均为分析纯;D101树脂,天津欧瑞生物科技有限公司.
1.2 主要仪器与设备
高效液相色谱仪,日本岛津公司;DK-98-1电热恒温水浴锅,天津泰斯特仪器有限公司;HL-2恒流泵,上海亚荣有限公司;离心机(TDL-5-A),上海安亭科学仪器厂;旋转蒸发仪(RE-5298A),上海亚荣生化仪器厂;PB-10型精密酸度计,赛多利斯科学仪器有限公司.
1.3 试验方法
1.3.1 苹果渣根皮苷粗提物的制备
将60%的乙醇溶液按照1∶10的料液比与苹果渣粉混合,70 ℃恒温水浴锅中浸提5 h,浸提2次,过滤,合并滤液,离心分离,上清液为苹果渣根皮苷粗提溶液.将粗提液减压浓缩至干,真空冷冻干燥成粉,并测定粗提物中根皮苷的含量.
1.3.2 根皮苷的测定
按照文献[20]所示方法采用高效液相色谱法检测各样品中的根皮苷.将各样品溶液浓缩,浓缩液经过孔径0.45μm滤膜过滤,进样测定根皮苷含量.
1.3.3 树脂预处理
按照D-101型大孔吸附树脂说明书所述方法,对树脂进行预处理及再生处理,待用.
1.3.4 树脂吸附试验的响应面法优化
将经过预处理后的D-101型大孔吸附树脂装入树脂柱中,湿法装柱,树脂柱高高25 cm,内径2 cm.根据单因素试验的试验结果,确定试验因素及范围,将吸附液浓度、吸附液pH和吸附流速作为动态吸附的3个考察因素,每个因素为3个水平,按照Box-Behnken中心组合设计试验以吸附率为响应值,应用响应面分析确定树脂吸附的最佳条件.测定收集后的被吸附液中根皮苷含量,按照下式计算树脂吸附率.
R1= [(C0V0-CeVe)/C0V0]× 100%
式中:R1为吸附率,%;C0为吸附液中根皮苷的浓度,mg /mL;V0为吸附液体积,mL;Ce为吸附后吸附液中根皮苷浓度,mg/mL;Ve为被吸附后的吸附液体积,mL.
1.3.5 树脂洗脱试验的响应面法优化
按照1.3.4试验确定的最优树脂吸附条件进行树脂吸附试验,然后将树脂用300 mL洗脱液按照不同的条件进行洗脱.根据单因素试验的试验结果,确定试验因素及范围,将乙醇洗脱液浓度、洗脱液pH和洗脱温度作为动态洗脱的3个考察因素,每个因素为3个水平,按照Box-Behnken中心组合设计试验以洗脱率为响应值,应用响应面分析确定树脂洗脱的最佳条件.测定收集后的洗脱液中根皮苷含量,按照下式计算树脂洗脱率.
R2=[CDVD/(C0V0-CeVe)]×100%
式中:R2为洗脱率,%;CD为洗脱液中根皮苷浓度,mg/mL;VD为收集后的洗脱液体积,mL;VA为吸附液体积,mL;C0为吸附液中根皮苷的浓度,mg/mL;V0为吸附液体积,mL;Ce为吸附后吸附液中根皮苷浓度,mg/mL;Ve为被吸附后的吸附液体积,mL.
1.3.6 数据分析与处理
采用Design-Expert 7.0软件处理和分析试验结果.
2 结果与分析
2.1 响应面法优化树脂吸附工艺的条件
按照三因素三水平的试验设计,各影响因素对吸附率影响的结果如表1所示,试验结果的方差分析如表2所示.
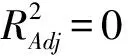
根据回归分析,得出该模型因素实际值的二次回归方程为:
R1=-11.17-129.95A+29.527 5B+98.34C+4.5AB-26.0AC-0.3BC+163.0A2-3.992 5B2-41.07C2
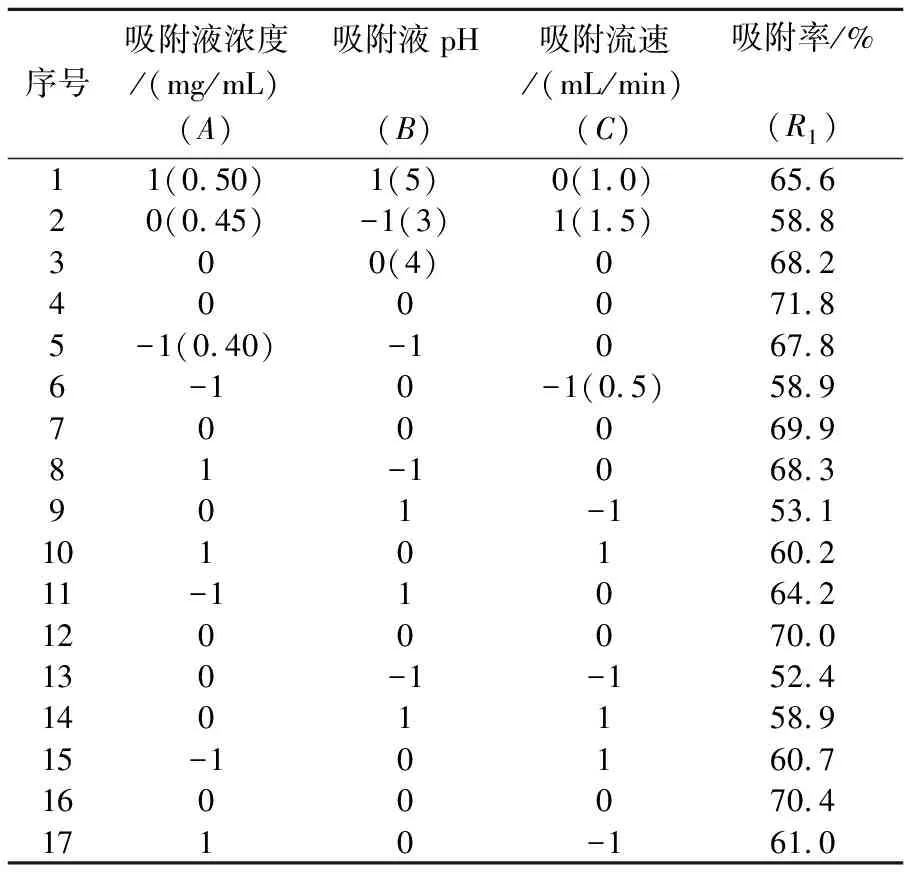
表1 树脂吸附试验优化结果
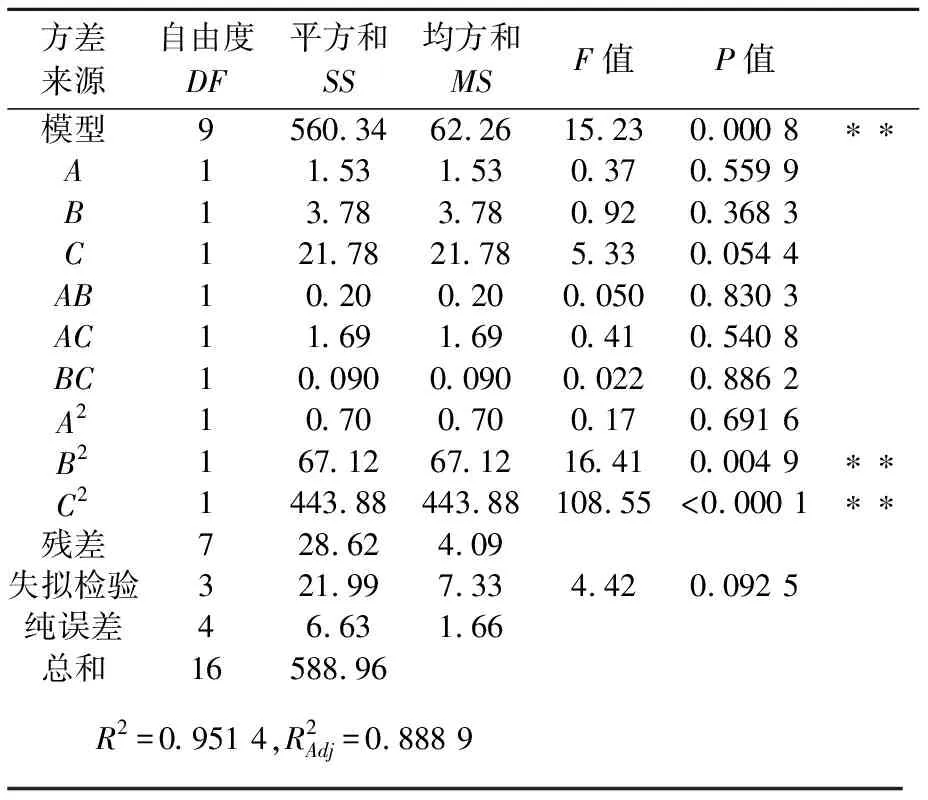
表2 树脂吸附试验结果方差分析表
注:**表示极显著水平(P<0.01)
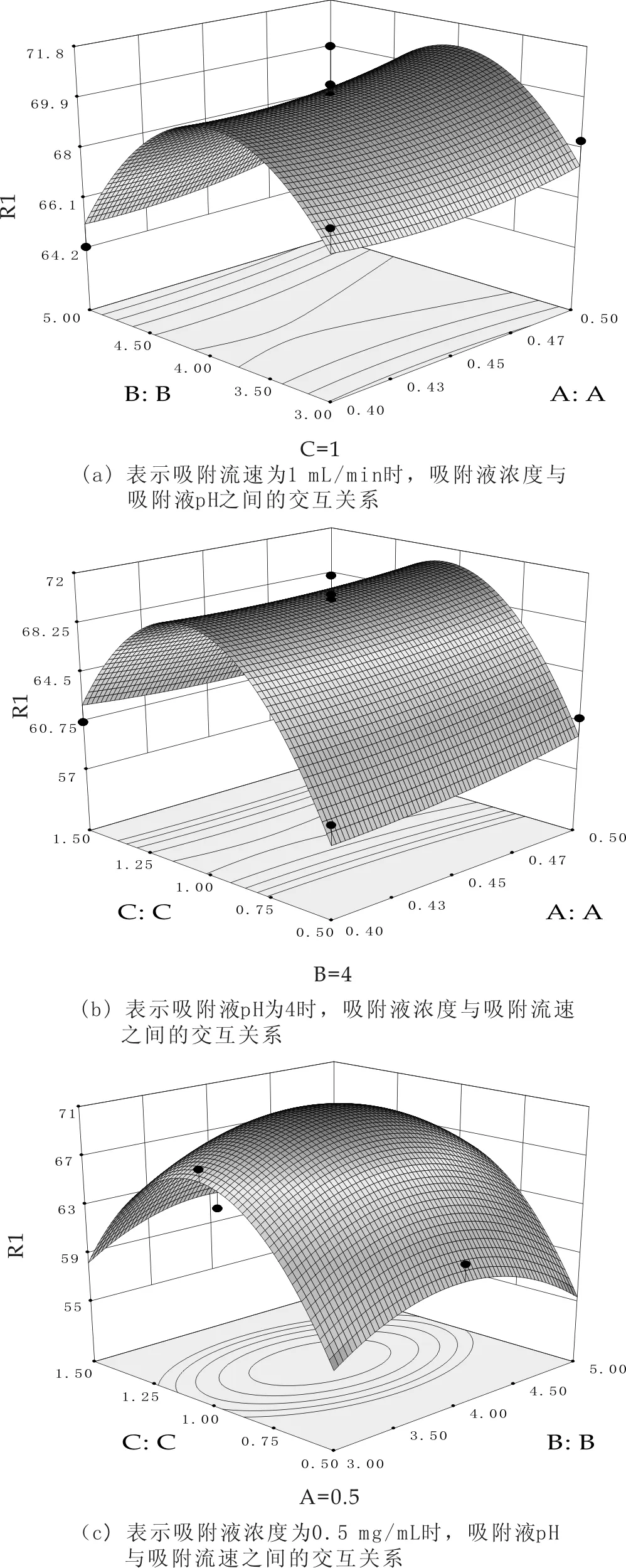
图1 吸附各因素之间等高线和响应面曲线
对试验结果进行分析处理,得出树脂吸附苹果渣粗提物的最佳操作条件为:吸附液浓度为0.5 mg/mL,吸附液pH为4,吸附流速为1.02 mL/min.在该最佳的吸附条件下,模型预测的最大吸附率可以达到70.94%.考虑到实际操作的可行性,将模型给出的最优条件取整,即操作最优条件为吸附液浓度0.5 mg/mL,吸附液pH4,吸附流速1.0 mL/min.在该实验条件下进行验证试验,平行测定3次,得到吸附率的平均值为69.87%,与模型给出的结果十分接近,表明该模型可信,可用于实际工艺参数确定的指导.
根据回归方程,绘制出两两交互作用对吸附率影响的等高线和响应面曲线,如图1所示.图1表明,各因素之间交互作用不显著.
2.2 响应面法优化树脂洗脱工艺条件
按照三因素三水平的试验设计,各影响因素对洗脱率影响的结果如表3所示,试验结果的方差分析如表4所示.
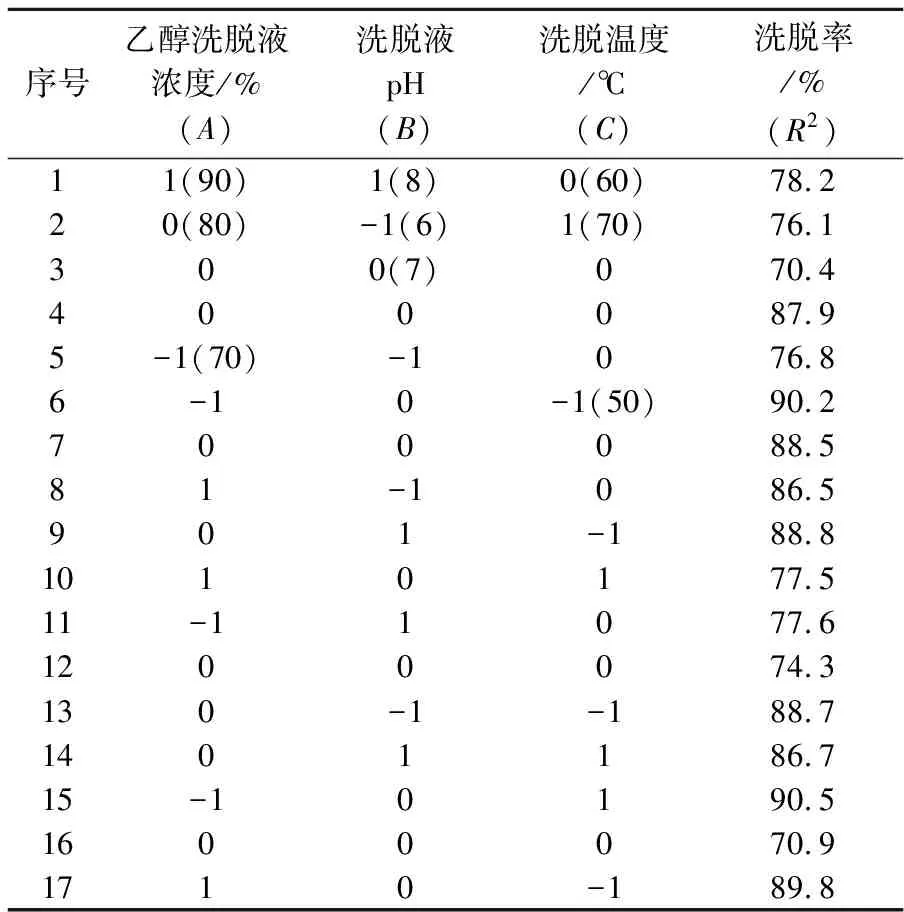
表3 树脂洗脱试验优化结果
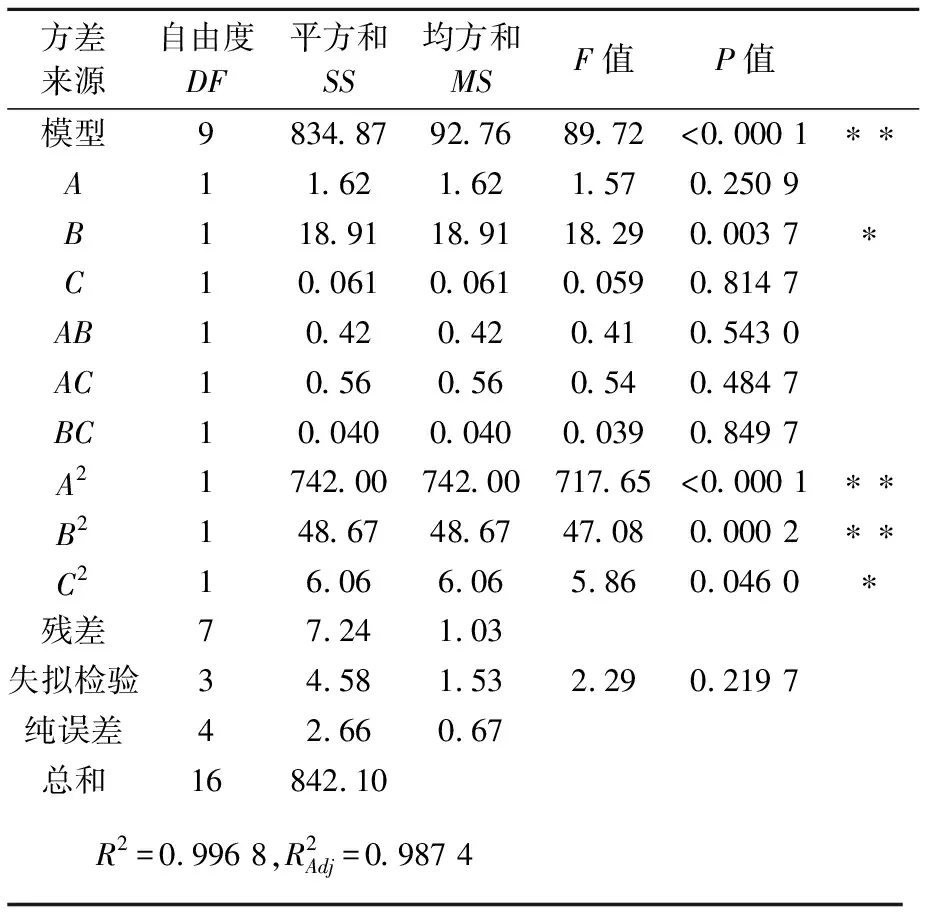
表4 树脂洗脱试验结果方差分析表
注:*表示显著水平(P<0.05);**表示极显著水平(P<0.01).
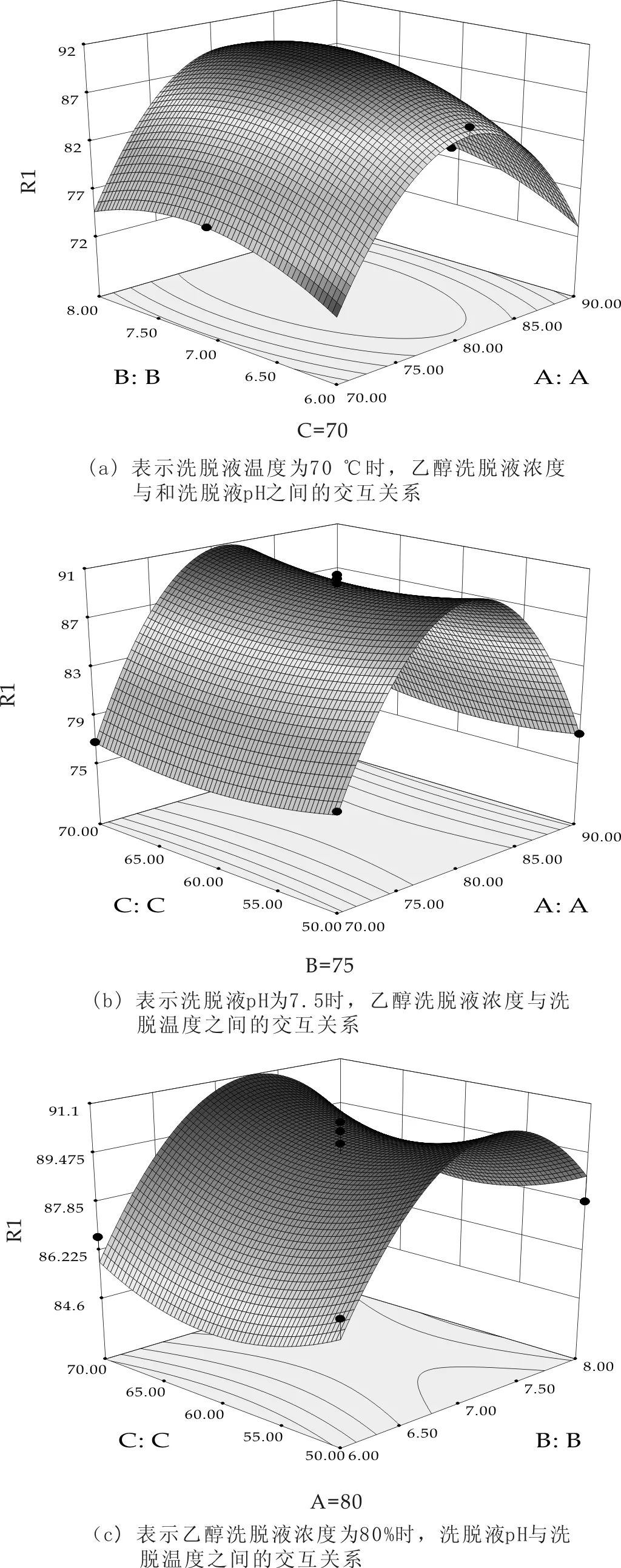
图2 洗脱各因素之间等高线和响应面曲线
根据回归分析,得出该模型因素实际值的二次回归方程为:
R2=857.887 50+20.832 50A+45.937 50B-1.801 25C+0.032 5AB-0.003 75AC-0.01BC-0.132 75A2-3.4B2+0.012C2
对试验结果进行分析处理,得出树脂洗脱的最佳操作条件为:乙醇浓度为79.05%,洗脱液pH为7.5,洗脱温度69.92 ℃.在该最佳的吸附条件下,模型预测的最大洗脱率可以达到90.63%.考虑到实际操作的可行性,将模型给出的最优条件取整,即操作最优条件为乙醇浓度80%,洗脱液pH为7.5,洗脱温度70 ℃.在该实验条件下进行验证试验,平行测定3次,得到洗脱率的平均值为89.92%,与模型给出的结果十分接近,表明该模型可信,可以用于实际工艺参数确定的指导.
根据回归方程,绘制出两两交互作用对吸附率影响的等高线和响应面曲线,如图2所示.图2表明,各因素之间交互作用不显著.
3 结论
本文通过响应面试验优化方法苹果渣中根皮苷大孔吸附树脂分离工艺条件,得到了回归方程,并确定大孔吸附树脂最优吸附条件为:吸附液浓度0.5mg/mL、吸附液pH值4、吸附流速1.0mL/min,在此条件下吸附率可达到69.87%,各因素对吸附率影响顺序为:吸附流速>吸附液pH>吸附液浓度;最优洗脱条件为:乙醇洗脱液浓度80%、洗脱液pH值7、洗脱温度70 ℃,洗脱率可达89.92%,各因素对洗脱率影响顺序为:洗脱液pH>乙醇洗脱液浓度>洗脱温度.
[1]LijunSun,YurongGuo,ChengchengFu,etal.Simultaneousseparationandpurificationoftotalpolyphenols,chlorogenicacidandphlorizinfromthinnedyoungapples[J].FoodChemistry,2013,136(2):1 022-1 029.
[2] 冯雪娇, 曹学丽, 李 艳, 等.根皮苷的应用及分离纯化研究进展[J].北京工商大学学报(自然科学版),2008,26(4):13-16.
[3]ChristianGosch,HeidiHalbwirth,KarlStich.Phloridzin:Biosynthesis,distributionandphysiologicalrelevanceinplants[J].Phytochemistry, 2010,71(8-9):838-843.
[4]YuanyuanYue,JianmingLiu,JingFan,etal.Bindingstudiesofphloridzinwithhumanserumalbuminanditseffectontheconformationofprotein[J].Phytochemistry, 2010,71(8-9):838-843.
[5]ChristianGosch,HeidiHalbwirth,JasminKuhn,etal.Biosynthesisofphloridzininapple(MalusdomesticaBorkh.)[J].PlantScience, 2009, 176(2):223-231.
[6]MasukoKobori,SaekoMasumoto,YukariAkimoto,etal.PhloridzinreducesbloodglucoselevelsandaltershepaticgeneexpressioninnormalBALB/cmice[J].FoodandChemicalToxicology,2012,50(7):2 547-2 553.
[7]EunsunJung,JongsungLee,SungranHuh,etalPhloridzin-inducedmelanogenesisismediatedbythecAMPsignalingpathway[J].FoodandChemicalToxicology, 2009,47(10):2 436-2 440.
[8]YusukeIkumi,ToshiyukiKida,ShinjiSakuma,etal.Polymer-phloridzinconjugatesasananti-diabeticdrugthatInhibitsglucoseabsorptionthroughtheNa+/glucosecotransporter(SGLT1)inthesmallintestine[J].JournalofControlledRelease, 2008,125(1):42-49.
[9]AmolGupte,JohnK.Buolamwini.Synthesisandbiologicalevaluationofphloridzinanalogsashumanconcentrativenucleosidetransporter3 (hCNT3)inhibitors[J].Bioorganic&MedicinalChemistryLetters,2009,19(3):17-921.
[10]GaryL.Uglem,RobertD.Love.Hymenolepisdiminuta:Propertiesofphlorizininhibitionofglucosetransport[J].ExperimentalParasitology,1977,43(1):94-99.
[11]Wei-TienChang,Wen-ChungHuang,Chian-JiunLiou.Evaluationoftheanti-inflammatoryeffectsofphloretinandphlorizininlipopolysaccharide-stimulatedmousemacrophages[J].FoodChemistry, 2012,134(2):972-979.
[12]B.J.Bradford,M.S.Allen.PhlorizinInducesLipolysisandAltersMealPatternsinBothEarly-andLate-LactationDairyCows[J].JournalofDairyScience, 2007,90(4):1 810-1 815.
[13] 张 毅,宁正祥,董华强.多穗柯总黄酮的连续逆流提取研究[J].现代食品科技,2011,27(5):550-570.
[14] 李胜华,伍贤进,牛有芽.D-101 大孔树脂纯化多穗柯中根皮苷的工艺研究[J].食品科技,2010,35(7):217-221.
[15]V.M.Rodríguez-González,A.Femenia,R.Minjares-Fuentes,etal.FunctionalpropertiesofpasteurizedsamplesofAloebarbadensisMiller:Optimizationusingresponsesurfacemethodology[J].LWT-FoodScienceandTechnology,2012,47(2):225-232.
[16]JiangweiHan,XingmingJiang,LidaZhang.OptimisationofextractionconditionsforpolysaccharidesfromtherootsofIsatistinctoriaL.byresponsesurfacemethodologyandtheirinvitrofreeradicalsscavengingactivitiesandeffectsonIL-4andIFN-γmRNAexpressioninchickenlymphocytes[J].CarbohydratePolymers, 2011,86(3):1 320-1 326.
[17]BinYang,XuanLiu,YanxiangGao.Extractionoptimizationofbioactivecompounds(crocin,geniposideandtotalphenoliccompounds)fromGardenia(GardeniajasminoidesEllis)fruitswithresponsesurfacemethodology[J].InnovativeFoodScience&EmergingTechnologies, 2009,10(4):610-615.
[18]W.C.Lee,S.Yusof,N.S.A.Hamid,etal.Optimizingconditionsforhotwaterextractionofbananajuiceusingresponsesurfacemethodology(RSM)[J].JournalofFoodEngineering,2006,75(4):473-479.
[19]IsmailEren,FigenKaymak-Ertekin.Optimizationofosmoticdehydrationofpotatousingresponsesurfacemethodology[J].JournalofFoodEngineering,2007,79(1):344-352.
[20] 苏光明,胡小松,廖小军,等.苹果中根皮苷的测定及其在苹果汁质量控制中应用初步研究[J].中国食品学报,2010,10(2):226-232.
