壳聚糖/明胶磁性微球的反相悬浮乳液包埋法制备研究
2013-01-29宋宏新薛海燕贺宝元
宋宏新, 李 韵, 薛海燕, 贺宝元
(1.陕西科技大学 生命科学与工程学院, 陕西 西安 710021; 2.陕西科技大学 资源与环境学院, 陕西 西安 710021)
0 引言
磁性微球是通过将磁性粒子与有机高分子结合,形成具有一定磁性及特殊结构的复合微球.用它来进行目标物分离,具有操作简单、高效快速、可重复使用、保持靶物质生物活性等特点.磁性微球分离技术广泛用于医学抗癌导向、生物物质分离及食品检测等,是生物分离技术的一次革命,有力地推动了医学和生物学研究的发展[1-3].
磁性微球的制备方法主要有包埋法、单体聚合法、共沉淀法和化学沉淀法等[4].磁性微球的制备一直是一个技术难点,高质量磁性微球主要依靠进口国外高价产品,大大限制了磁性微球在国内生物医学研究领域的应用[5].本研究在综合比较各种制备方法的基础上,研究了制备高质量磁性微球的优化工艺方法.
1 实验材料与方法
1.1 试剂及仪器
试剂:液体石蜡(化学纯),相对密度0.835~0.855;Span-80(化学纯)皂化价145~185;壳聚糖(BETTER),脱乙酰度95.7%,分子量775 Kda,等电点为4.7;明胶(西安舟鼎国生物技术有限责任公司),约225水华,平均分子量50,000,每100 g有100~150 mmol羧基基团,含水量13.7%,等电点为4.7~5.2;磁性粒子(南京共达纳米应用研究所),Fe3O4质量百分比含量大于95%,平均粒径20 nm左右,最大磁饱和强度为3千高斯;戊二醛(分析纯,天津市科密欧化学试剂有限公司),浓度为25%和50%;亲和层析多克隆兔抗鸡IgG(实验室制备).
仪器:752型紫外-可见分光光度计(上海光谱仪器有限公司);机械搅拌机(IKA);扫描电镜(S-2700,日本日立集团).
1.2 实验过程
1.2.1 磁性微球的制备
(1)制备水相.称取0.2 g明胶、0.3 g壳聚糖和0.1 g磁性粒子,加入10 mL蒸馏水,70 ℃水浴边搅拌边加入100μL冰醋酸,待壳聚糖和明胶完全溶解并与磁性粒子混合均匀后,用0.1 mol/L NaOH调节pH到4.5~7.0[6],得到2%明胶-3%壳聚糖-1%磁性粒子的复合溶液,室温备用.
(2)油水乳化.向三口烧瓶中加入20 mL液体石蜡和0.6mL span-80,60 ℃恒温水浴625 r/min搅拌混合30 min后,向其中逐滴加入5 mL水相样品,进行乳化.
(3)固化微球.乳化10 min后,同转速下改换4 ℃冰浴,使乳液迅速降温,使水相凝固初步定形成球.降温2 min后逐滴一次加入0.5 mL戊二醛交联30 min.逐渐升高水浴温度到30 ℃,继续固化反应90 min[7-9].反应结束后,乳液分别用石油醚、丙酮、异丙醇2 000 r/min反复洗涤后,避光自然晾干,得到褐色粉末.
1.2.2 磁性微球表征
(1)形貌表征.对磁性粒子进行扫描电子显微镜(SEM)的拍摄,观察壳聚糖/明胶磁性微球的大小、分散性和表面形貌.
(2)磁响应测定.每0.02 g磁性微球溶于pH 7.0的蒸馏水中,低温超声振荡混匀2 h,在磁力架上静置30 min,清液在420 nm处测吸光度A.A<0.05为磁响应良好[10].
1.2.3 磁性微球吸附BSA
按照表1,分别加入0.02 g/mL混匀的磁性微球溶液(pH7.0)、100μg/mL BSA和蒸馏水在1~6号离心管中, 37 ℃振荡2 h使BSA充分吸附在磁性微球表面,用磁力架分离磁性微球30 min,取清液用考马斯G250法测定595 nm处吸光度,计算蛋白质含量,确定BSA最佳加入量和吸附率[11].
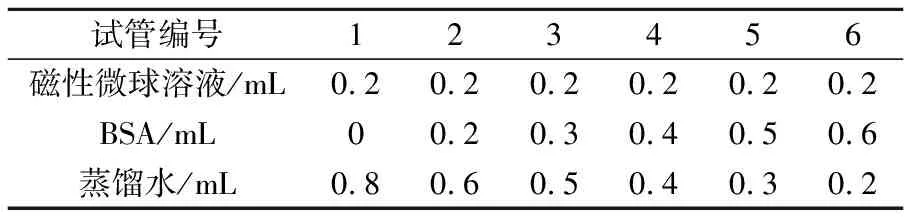
表1 磁性微球对BSA的吸附
1.2.4 磁性微球吸附亲和层析兔抗β-CNIgG
同样地按照表1,仅将100μg/mL BSA换成层析纯化多克隆兔抗β-CNIgG,其它操作同前,计算亲和层析兔抗β-CNIgG最佳加入量和吸附率.
最佳亲和层析兔抗β-CNIgG加入量和磁性微球进行混合37 ℃振荡反应2 h,4 ℃放置6 h、12 h、24 h、48 h、72 h后分别取清液,用考马斯G250法在595 nm处测定吸光度,确定磁性微球对抗体的吸附稳定性.
2 结果与讨论
2.1 SEM电镜
2.1.1 制备得到的壳聚糖/明胶磁性微球的SEM照.
如图1(a)可以看到微球成球效果较好,表面光滑无凹陷,分散性好,球与球间粘连少.但也可以看到微球大小不够均匀,制备方法还有待于改善;图1(b)中微球表面光滑无凹陷,与标尺比对得到制备的磁性微球粒径在3~8μm之间.微球上出现了一些白色亮点,这是由于微球内部磁性Fe3O4粒子与喷金表面有不同的电荷密度,电镜对两者感光度不同,使照片中微球上出现白色亮点,证实了磁性粒子被包裹在微球内部.结果表明反相悬浮乳液包埋法可以制备形貌较好的磁性微球.
2.1.2 戊二醛浓度对壳聚糖/明胶磁性微球制备的影响
25%和50%的两种不同浓度的戊二醛对比制备的磁性微球的SEM照片如图2所示.

(a)600倍 (b)1000倍图1 壳聚糖/明胶磁性微球的SEM形貌

(a)25%的戊二醛100倍 (b)50%的戊二醛100倍 (c)25%的戊二醛450倍 (d)50%的戊二醛450倍图2 不同浓度戊二醛制备的壳聚糖/明胶磁性微球的SEM形貌
图2(a)可以明显看到25%戊二醛制备得到的磁性微球分散性较好,大小较为均匀,相比之下图2(b)50%戊二醛制备的产物异形团聚物较多,分散性不好;图2(c)中25%戊二醛制备的微球成球性好、表面光滑粘连少;图2(d)的产物成球性不好,非球形个体较多,箭头所指处表面凹陷粘连严重.
结果表明,25%戊二醛制备得到的磁性微球形貌更好.
2.2 磁响应效果
制备的磁性微球的磁响应性是对其表征的重要指标之一.选取了最优制备条件下的3个样品和3个温度进行磁响应性的测定,结果如表2所示.
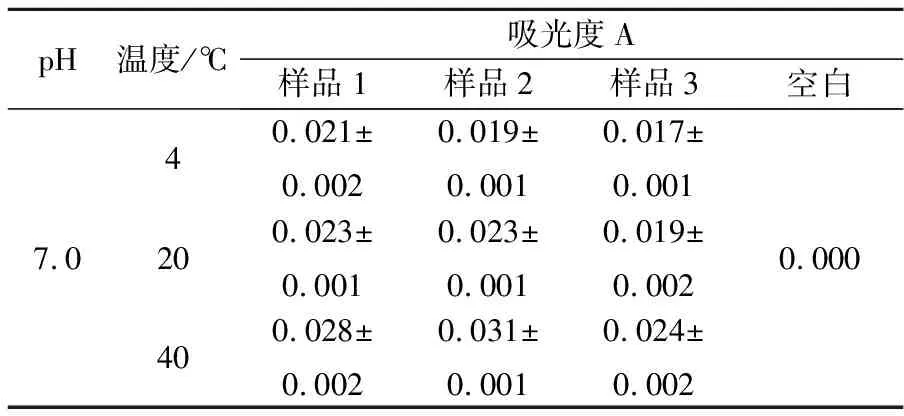
表2 壳聚糖/明胶磁性微球磁响应性结果
从表2中可以看出,3个样品在3个温度的下吸光度A<0.05.其中,在4 ℃和20 ℃时,吸光度较低,表明磁性微球在低温时磁响应较稳定;40 ℃时,吸光度略有升高,是因为部分微球中未交联的明胶在升温后溶解,破坏了微球结构,使其失去磁性粒子后漂浮于溶液中,溶液吸光度略有上升,但均未超过0.05,表明40 ℃时磁性微球稳定性较好.
磁响应性实验结果表明,制备得到的磁性微球磁响应效果好.
2.3 磁性微球吸附蛋白质效果
2.3.1 吸附BSA
对3个磁性微球样品进行了BSA吸附效果的实验,结果如图3所示.
图3显示BSA加入量在0~40μg/mL范围内时,吸附于磁性微球表面的BSA量,随着BSA加入量增加而增加.当BSA加入量为40μg/mL时出现了拐点,继续增加加入量,吸附量趋于稳定不再出现明显增加.故40μg/mL为0.02 g/mL的磁性微球的最佳BSA加入量.通过公式:吸附率 =[(总加入量-上清液含量)/总加入量]×100%,可计算出BSA的吸附率为86.25%,吸附量为34.5±0.6μg/mL.
结果表明,制备得到的磁性微球对BSA有较好的吸附效果.
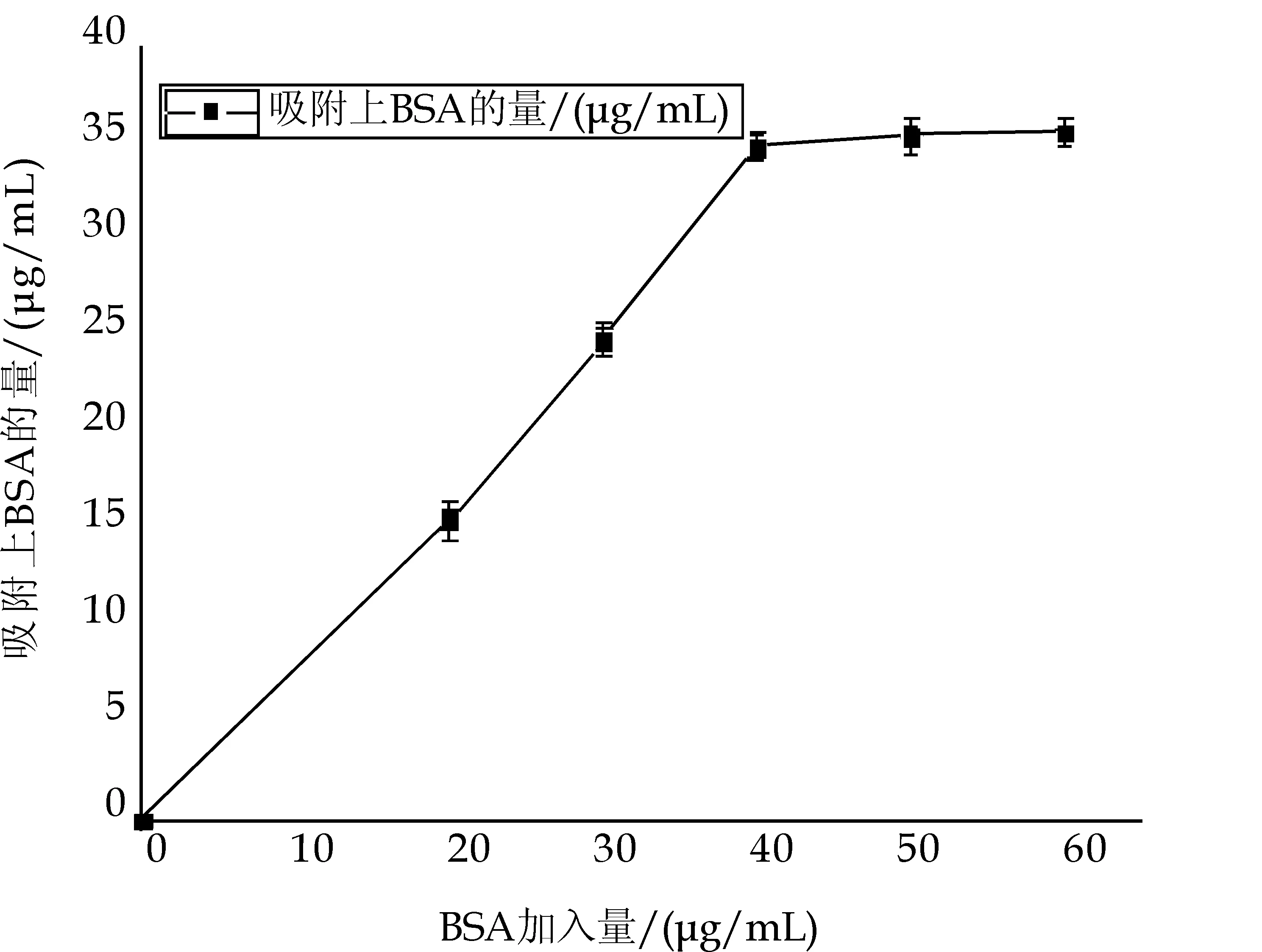
图3 磁性微球对BSA的吸附情况
2.3.2 吸附层析兔抗β-CNIgG
对3个磁性微球样品进行了IgG吸附效果的实验,结果如图4所示.
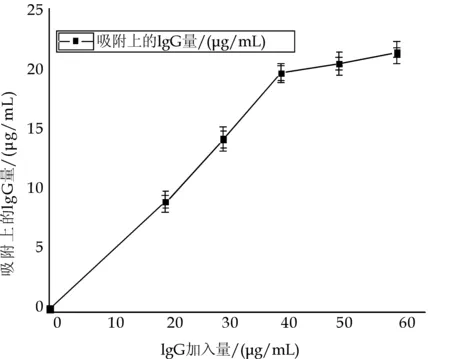
图4 磁性微球对IgG的吸附情况
图4显示IgG加入量在0~40μg/mL范围内时,磁性微球对IgG的吸附量,随着IgG加入量增加而增加.当加入量在40~60μg/mL范围内时,吸附量的增加不明显,40μg/mL为曲线拐点,故40μg/mL为0.02 g/mL的磁性微球的最佳IgG加入量.同样用吸附率公式可以计算出IgG的吸附量为19.6±1.0μg/mL吸附率为49.31%.
结果表明,制备得到的磁性微球对IgG有较好的吸附效果.
2.3.3 免疫壳聚糖/明胶磁性微球的时间稳定性
免疫磁性微球的时间稳定性结果如图5所示.
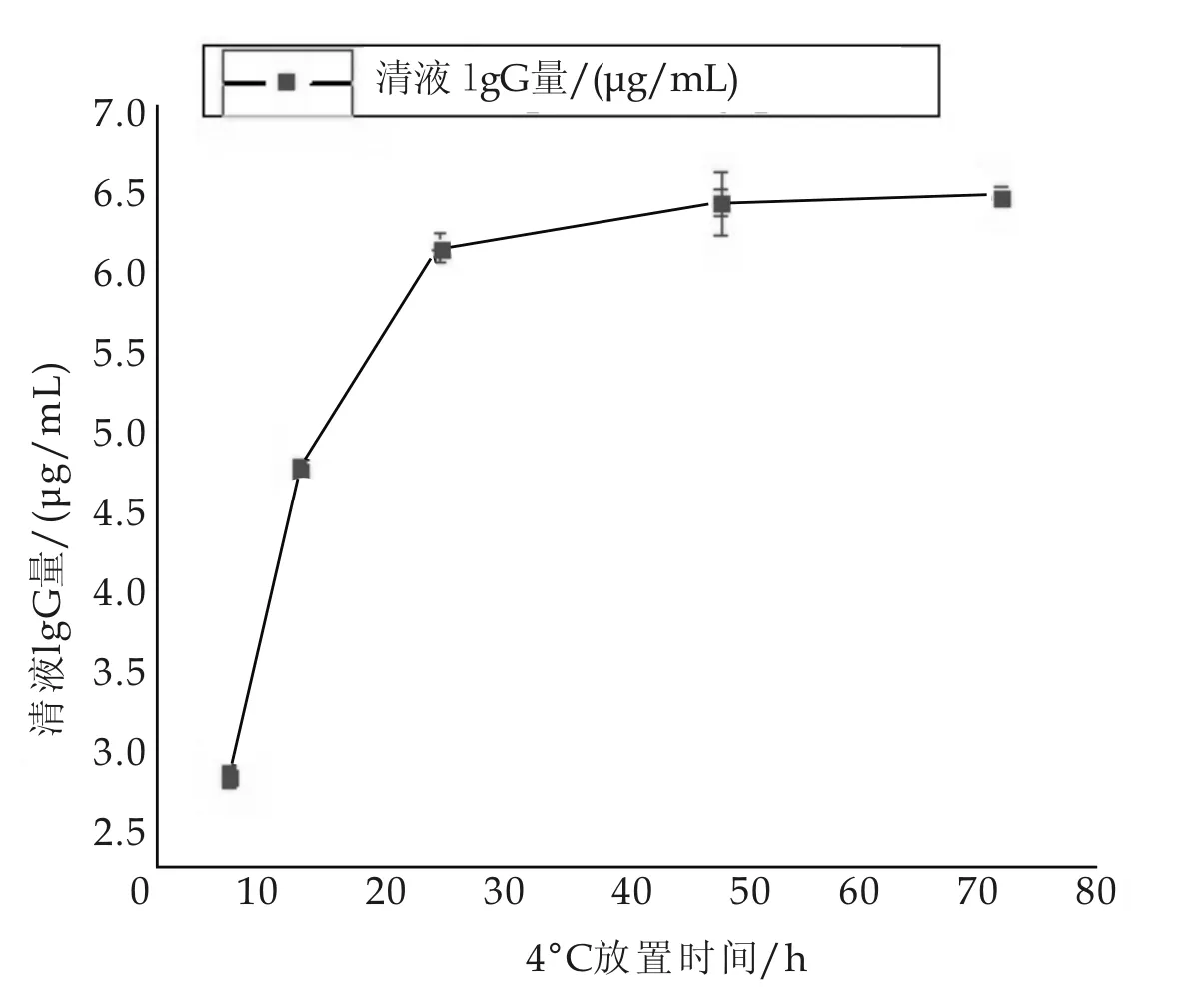
图5 时间变化对免疫磁性微球的稳定性的影响
图5显示,静置时间在0~24 h范围内,未吸附牢固的抗体进入清液,清液中的IgG量随时间延长明显增加.在24~72 h范围内,清液中的IgG量随着时间的延长增加不明显,48 h时清液中IgG的增加量第一次低于总加入量的1%,可以认为此时IgG与微球的吸附已经趋于稳定,48 h时IgG的吸附率为42.75%.
3 结论
本实验成功制备得到了粒径在3~8μm的表面光滑、分散性好的壳聚糖/明胶磁性微球.磁性微球稳定性较好,在高速离心和静置多日的情况下均未发生聚沉;25%戊二醛制备的磁性微球形貌较好;制备的磁性微球磁响应在4 ℃和20 ℃下均良好;磁性微球对BSA有较好的吸附效果,0.02 g/mL的磁性微球最佳的BSA加入量为40μg/mL,吸附率可以达到86.25%;磁性微球对层析兔抗β-CNIgG有较好的吸附效果,最佳加入量为40μg/mL,吸附率可以达到49.31%;制备的免疫磁性微球在48 h后趋于稳定,最终IgG吸附率为42.75%.
本试验制备磁性微球时,向油相中加入水相(磁粒子分散于壳聚糖/明胶溶液中),通过调整两相组分的比例,控制合适的搅拌速度是水相充分乳化稳定的关键,其次是在固化交联前对乳液快速降温(4~7 ℃)使明胶凝固,使球体形状初步固化成形,可以减少微球粘连和异形球体的出现;另一关键点是,戊二醛使壳聚糖分子间交联,合适浓度的戊二醛理想情况是使球体表面交联成壳,形成表面光滑、分散性较好的微球,浓度过大会使交联过快出现球体表面凹陷、球体异形及球体间粘连等现象.
本实验仅对交联剂进行了研究,取得了阶段性结论,其他影响乳化体系的复杂因素还值得进一步探讨.
[1] Ugelstad.A process for preparing an aqueous emulsion or dispersion of a partly water-solube material and use of polymer particles prepard accrording to this process as a toner in xerography[P].EUR:EP 0003905, 1979-09-05.
[2] 范 蓉.免疫磁性微球[J].国外医学免疫学分册,1998,23(1):51-54.
[3] 何 磊,郭亚飞,李智洋,等.免疫磁珠制备[J].化工时刊,2008,22(7):5-6.
[4] 徐 辉,张国婷,张凤宝.免疫磁性微球的研究进展[J].化学工业与工程,2003,20(1):27-32.
[5] 马 力,李 鹤.免疫磁性微球的制备及对IgG的分离[J].西华大学学报,2010,29(2):181-186.
[6] 王 建,冯玉杰.壳聚糖磁性微球的制备和工艺参数优化[J].磁性材料及器件,2008,39(6):44-70.
[7] Denkbas E B. Mangetic chitosan microsperes:preparation and charaction[J].Reactiv and Functional Polymers,2002,50:225-232.
[8] H.Zeng,Q.lai,X.lin,et al.Fcators influencing magnetix polymer microspheres prepared by dispersion polymerization[J].Journal of Applied Polymer Science,2007,106(5):3 474-3 480.
[9] 王海青,俞 玫,冷希岗,等.高灵敏免疫磁性微球的制备及评价[J].国际生物医学工程杂志,2008,31(5):257-260.
[10] 谢 钢,张和鹏,张秋禹,等.细乳液聚合法制备磁性复合微球及其表征[J].高分子学报,2003,47(5):626-630.
[11] 曹君剑,李富荣,唐 渝,等.纳米免疫磁性微球的制备和性能研究[J].中国免疫学杂志,2005,21(9):694-696.
