EGSB处理垃圾焚烧渗沥液及其微生物群落变化
2013-01-18叶杰旭孙德智
党 岩,张 瑞,叶杰旭,艾 晗,孙德智*
(1.北京林业大学水体污染源控制技术北京市重点实验室,北京100083;2.浙江工业大学生物与环境工程学院,浙江 杭州 310032)
垃圾焚烧作为城市生活垃圾减量化、无害化、资源化的一个有效手段,近年来得到越来越广泛的应用.由于我国城市生活垃圾厨余物多,含水率高,在焚烧过程中会产生大量的渗沥液[1],需要收集后集中处理.垃圾焚烧渗沥液成分复杂,C O D相比于垃圾填埋场渗滤液更高(>70000mg/L)[2],同时还含有高盐度、高氨氮、多种难降解物质(如腐殖酸等),处理难度大[1,3].厌氧生物处理具有处理效率高、能耗低、运行成本低等优点,国内外普遍采用膨胀颗粒污泥床(EGSB)等厌氧生物处理工艺处理垃圾填埋场渗滤液[4-6].但是,对于垃圾焚烧渗沥液的处理并不多见.垃圾渗沥液微生物种群在很大程度上决定了反应器的运行状况.通过研究垃圾焚烧渗沥液处理工艺超负荷运行前后的微生物群落结构变化能够全面掌握工艺处理效率降低的机理,指导工艺的稳定运行.
本实验采用实验室小试EGSB反应器处理垃圾焚烧厂渗沥液,考察了反应器有机负荷对COD去除率以及出水挥发酸(VFAs)含量的影响,最终超负荷状态下运行11d,并对超负荷运行前后的厌氧颗粒污泥的微生物群落结构进行了研究.
1 材料与方法
1.1 EGSB反应器的运行
实验室小试EGSB反应器由有机玻璃加工而成,有效容积4L(图1).内径60mm,主反应区高径比为12:1.内回流系统使主反应区内的液体上升流速保持在1.8m/h,反应器运行温度维持在(33±1)°C.接种污泥取自河南某实际处理啤酒废水的UASB反应器,MLVSS/MLSS为0.72.接种污泥量为6.4g MLVSS/L.
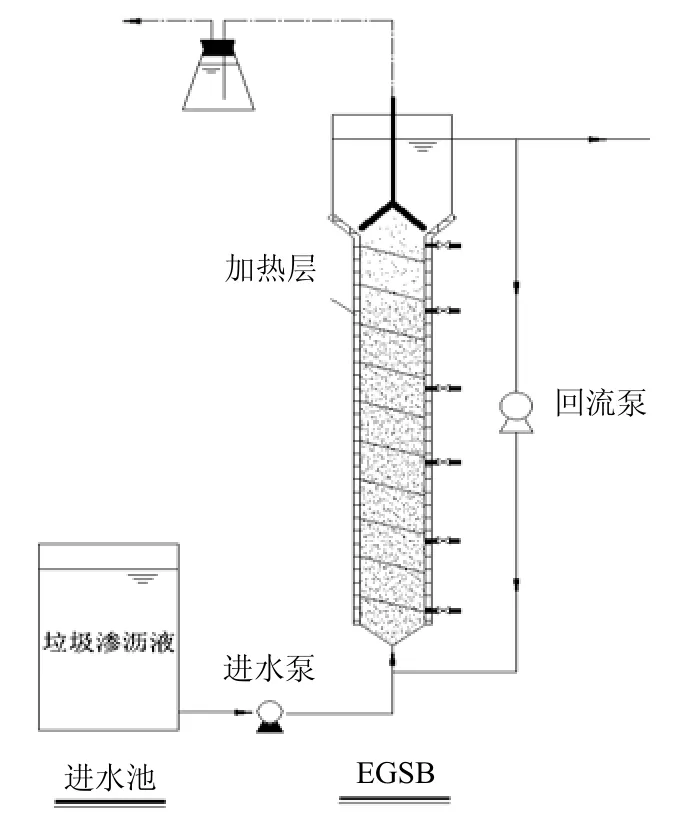
图1 EGSB反应器装置示意Fig.1 Schematic diagram of the lab-scale EGSB reactor
1.2 试验用水与工艺运行条件
试验用水采用北京市某垃圾焚烧发电厂渗沥液,其主要水质特点如表1所示.实验进水采用垃圾渗沥液与自来水根据需要按一定比例混合,并储存于4℃冰箱中.进水COD从5000mg/L开始逐渐提高,在反应器运行第1~56d水力停留时间 (HRT)保持在2.5d,第57~67d,以垃圾渗沥液原水为进水,为调整反应器有机负荷,HRT延长至3d.

表1 垃圾焚烧渗沥液主要水质特点Table 1 Characteristics of leachate from MSW incineration plant
1.3 分析项目及方法
COD的测定采用重铬酸钾滴定法,pH值的测定采用Thermo Orion 3-Star pH测定仪.水样中的乙酸、丙酸、丁酸、戊酸、己酸等的测定采用气相色谱法(气相色谱仪,Agilent 7890)配置Agilent HP-INNOWAX毛细管柱(30m,0.53mm,1.0μm)和氢火焰检测器(FID),测定条件参考Bertin等[7]的方法.
1.4 厌氧颗粒污泥样品与总DNA的提取
在EGSB反应器运行至第56,67d时,从反应器主反应区中下部取出少量颗粒污泥,用于DNA的提取.总DNA的提取,采用滚珠震荡机械破碎法[8]对颗粒污泥进行破碎,根据Omega公司生产的DNA提取试剂盒说明书对总DNA进行提取.提取纯化后的DNA经微量紫外分光光度计进行测定,2个样品A260/A280值分别为1.798和1.773,说明提取的DNA纯度较好.
1.5 PCR的扩增及克隆文库的构建
以总DNA为模板,分别以细菌和古菌的通用引物 27F/1492R(5′-AGAGTTTGATCCTGGCT CAG-3′/5′-GGTTACCTTGTTACGACTT-3′) 和109F/915R(5′-ACKGCTCAGTAACACGT-3′/5′-GTGCTCCCCCGCCAATTCCTT-3′)对其细菌和古菌进行16S rRNA基因扩增,用1%的琼脂糖凝胶电泳分离PCR产物,将目的条带切胶回收并纯化.
将纯化后的PCR产物连接到pGEM-T easy载体(Promega)上,然后转化到高效率感受态细胞JM109中.在 LB/氨苄/IPTG/X-Gal培养基上37°C培养18h.经蓝白斑筛选阳性克隆子,并通过引物T7/SP6进行菌落PCR扩增鉴定.
利用限制性内切酶对阳性克隆转化子进行酶切分类.对于细菌的16S rRNA基因扩增片段采用Rsa I和Msp I,对于古菌的16S rRNA基因扩增片段采用Rsa I和Taq I[9].在3%的琼脂糖凝胶上进行电泳,以了解每个克隆子中所含微生物片段的类型,并整合分类.
对插入质粒载体的目的DNA片段测序(中美泰和生物技术公司),将所得序列中相似度大于97%的序列归类为一个操纵子(OTUs),不同的OTU用BLAST程序在NCBI的Genbank上搜索相似序列,确定样品中所含微生物所属的种类范畴,通过MEGA(version 5)软件绘制neighbor-joining系统发育树.用Bootstrap评估树的稳定性.
2 结果与讨论
2.1 EGSB反应器的运行
由图2可见,反应器运行第1~56d,进水COD从大约5000mg/L逐渐提高到约55000mg/L,HRT保持在2.5d,有机负荷从2.1kgCOD/(m3·d)逐渐提升到23.1kgCOD/(m3·d).COD去除率在第7d时就提升到了90%以上,之后一直维持在93%以上.这一阶段中COD平均去除率达到94.82%,出水中VFAs含量(图3)一直低于350mg/L,反应器内pH7.4~7.8,说明这一阶段反应器运行稳定,处理效果良好.在反应器运行第57~67d,进水COD提升至大于70000mg/L,延长HRT至3.0d,有机负荷提升至 24.5kgCOD/(m3·d).这一阶段,COD去除率持续下降,第67d下降至73.9%.同时,出水中VFA含量迅速升高至约10000mg/L,其中以丙酸和乙酸为主(图3),反应器内pH值下降至6.8.说明此阶段反应器处于超负荷状态运行,大量VFAs积累导致反应器内出现酸化现象.
2.2 克隆文库构建和微生物群落结构分析
对反应器超负荷运行前后2个时期的厌氧颗粒污泥样品(第56,67d样品,分别定义为样品A和B)进行微生物群落结构的克隆文库分析.古菌和细菌分别选取了约80个和140个阳性克隆子构建克隆文库.经菌落PCR、酶切分类、测序后,获得了样品A和B的微生物群落结构(表2).
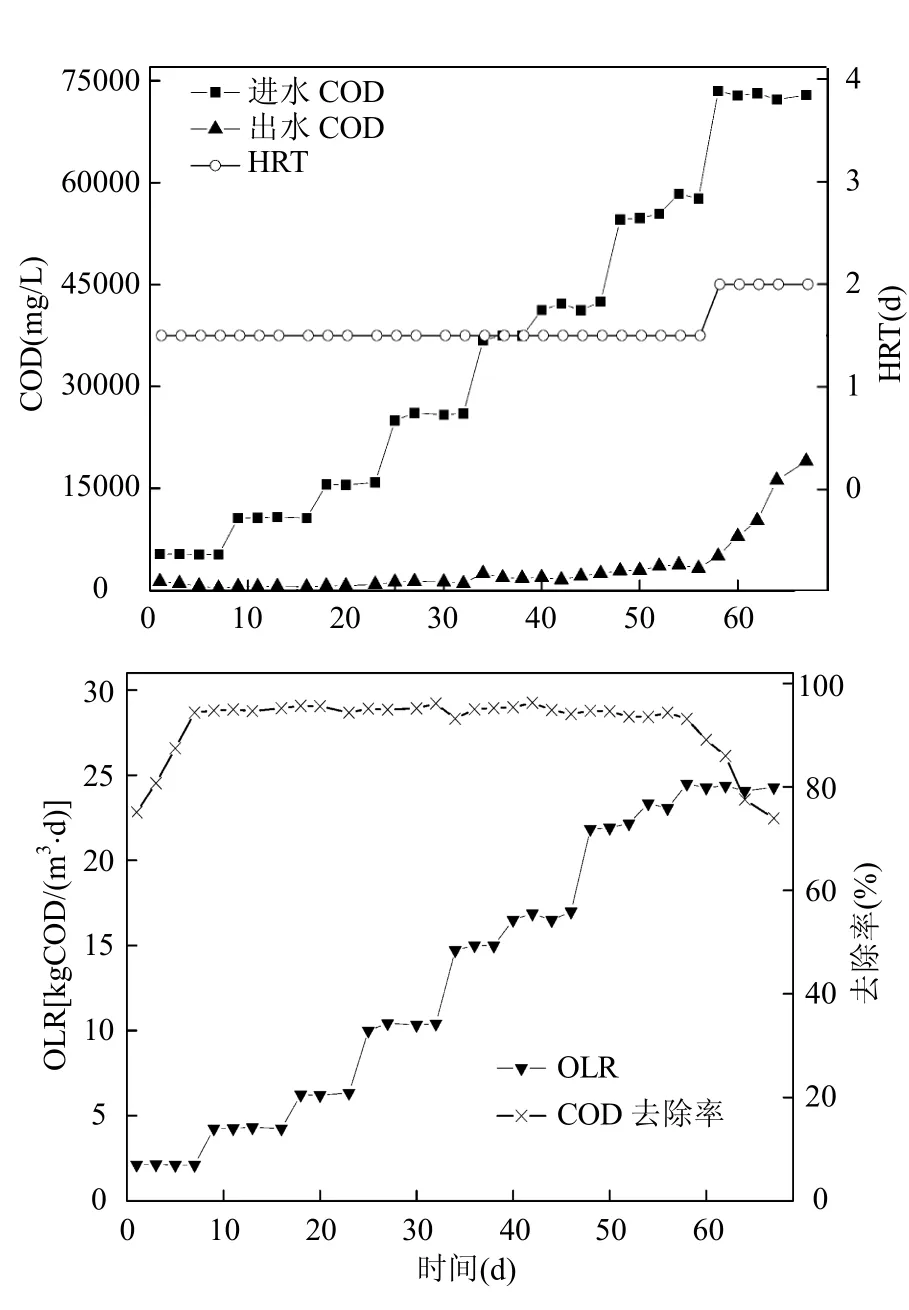
图2 EGSB反应器的运行Fig.2 Performance of the EGSB reactor
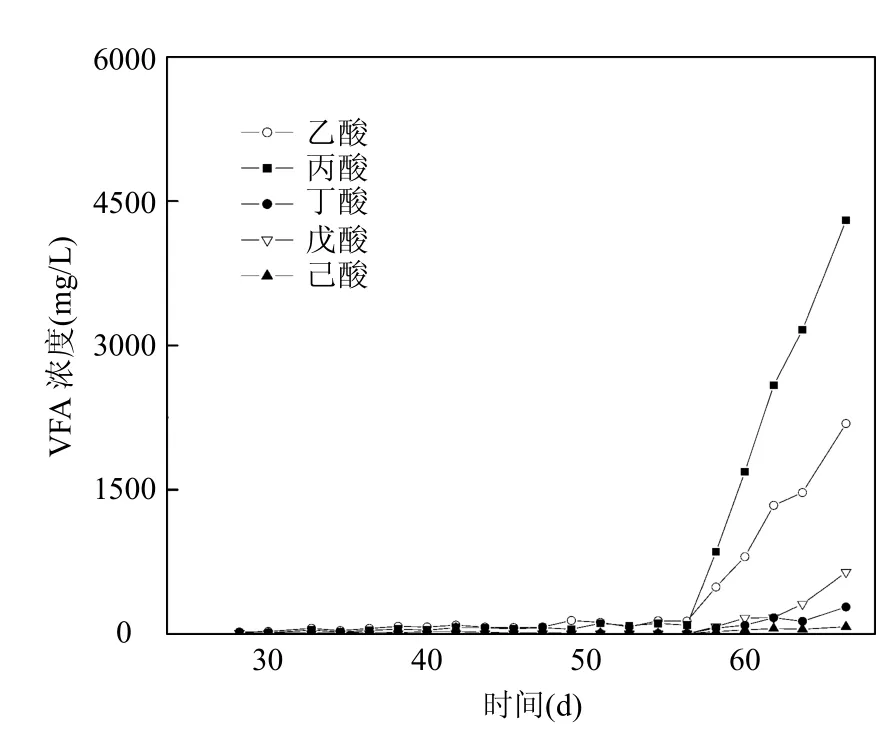
图3 出水中VFA含量的变化Fig.3 Variation of VFAconcentrations in the effluent
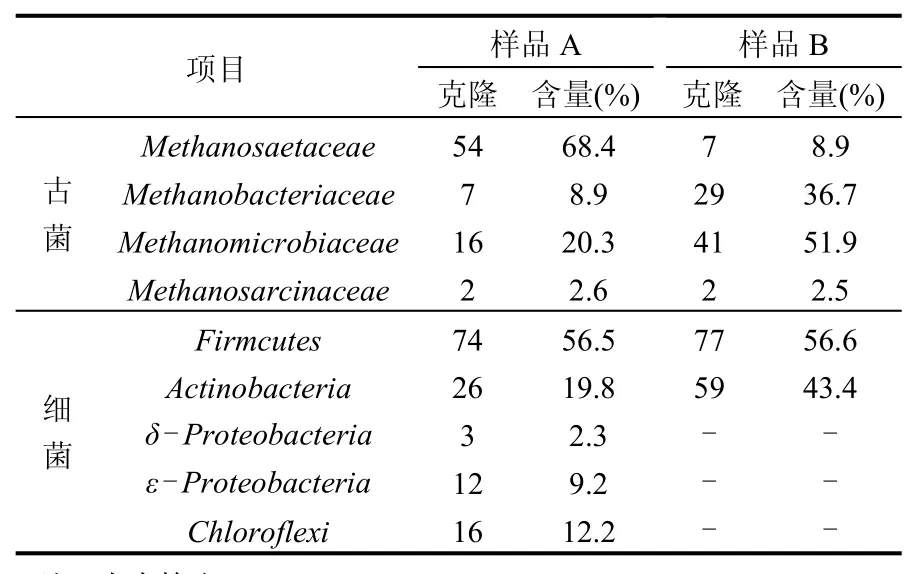
表2 污泥样品A和样品B的克隆统计结果Table2 Cloneresultsof microbein sludgesampleA andB
对于样品A,反应器在超负荷运行前,代表古菌的12个OTUs的79个克隆子被分为4类古菌:产甲烷髦毛菌(Methanosaetaceae)、产甲烷杆菌(Methanobacteriaceae)、产甲烷微菌(Methanomicrobiaceae)和产甲烷八叠球菌(Methanosarcinaceae),其优势菌群是产甲烷髦毛菌,含量为68.4%.古菌中丰度最高的克隆子A3(29/79)也属于产甲烷髦毛菌,它与Methanosaeta concilii(CP002565)的序列相似性为99%,M.concilii可以利用小分子有机酸形成甲烷并且与厌氧颗粒污泥的形成有关[10],保障了EGSB反应器的稳定运行.在产甲烷古菌中产甲烷髦毛菌与产甲烷八叠球菌属于乙酸营养型甲烷菌,是厌氧产甲烷反应器中的最重要的古菌,乙酸营养型甲烷菌的含量的多少直接决定了厌氧反应器运行效果[11].
样品A的细菌中,代表23个OTUs的131个克隆子被分为5类细菌:低GC革兰氏阳性菌(Firmicutes)、高 GC革兰氏阳性菌(Actinobacteria)、δ-变形菌、ε-变形菌、绿弯菌门(Chloroflexi),其中优势菌群是低GC革兰氏阳性菌,含量为56.5%,高GC革兰氏阳性菌含量为19.8%,是第2优势菌.细菌的菌群丰富度相比于一些以自配水为进水的厌氧生物反应器低很多[9,12],主要是由于垃圾渗沥液中存在多种毒性物质及生物抑制性物质所导致的[3].样品A取样时,EGSB反应器以进水COD约55000mg/L,有机负荷约23 kgCOD/(m3·d)稳定运行10d,COD平均去除率94.1%,说明在此负荷下,EGSB反应器可以稳定运行(样品A的系统发育树没有给出).
样品B,其微生物群落结构与样品A相比发生了明显的变化.对于古菌,优势菌群变为产甲烷微菌,其含量为51.9%,第2优势菌群是产甲烷杆菌,其含量为36.7%.产甲烷微菌和产甲烷杆菌均是氢营养型产甲烷菌,其总含量达到了88.6%.而在A样品中处于古菌优势地位的产甲烷髦毛菌的含量降低至8.9%,另一类乙酸营养型产甲烷菌产甲烷八叠球菌的含量依旧很低,仅为2.5%.乙酸营养型产甲烷菌含量的降低导致小分子有机酸(如乙酸、丙酸等)不能被迅速利用,造成有机酸的大量积累,反应器出现酸化现象.产甲烷古菌的生长周期较长,一般需要十几天到几十天[13],而本研究中反应的超负荷运行11d,没有充足的时间使产甲烷古菌大量繁殖,古菌菌群中乙酸营养型产甲烷菌含量的大幅度降低是由于产甲烷髦毛菌在超负荷状态下大量死亡所导致的.
对于样品B的细菌,代表12个OTUs的136个克隆子被分为2大类:低GC革兰氏阳性菌和高GC革兰氏阳性菌,其含量分别为56.6%和43.4%.而在样品A中存在的属于δ-变形菌、ε-变形菌和绿弯菌门的菌在样品B中均没有检出.说明超负荷状态下,属于这些菌群的细菌的生长均受到了抑制.细菌中,丰度最高的操纵子OTU 2(40/136)属于高 GC革兰氏阳性菌,它与Atopobiumsp.ICM42b10(HQ616393)的序列相似度达100%.Atopobium是一种产酸菌,其代谢产物一般为乳酸或丙酸[14],它的大量存在导致反应器中丙酸大量产生.样品B中的低GC革兰氏阳性菌中,几乎全部的克隆子都属于Clostridiales,Clostridiales的很多子分支的菌种都是厌氧生物反应器中很常见的菌,其中有很多是产乙酸菌,同时Clostridiales普遍具有能产生芽孢的生物特性,以抵御恶劣的生存环境[15].样品B的古菌及细菌的系统发育树如图4,图5所示.
2.3 讨论
本研究的工艺处理垃圾焚烧厂渗沥液在有机负荷为23.1kgCOD/(m3·d)时已接近反应器所能承受的有机负荷上限.同时,进水中的氨氮负荷、钙负荷、毒性物质浓度等也可能是引起反应器超负荷运行的原因[16].由反应器超负荷前后微生物群落结构变化情况可以看出,反应器在比较短的时间内(11d),古菌和细菌的种群结构都发生了明显变化,有较多的菌群在超负荷运行状态下不能继续生存,严重影响了反应器的处理效果.同时,由于垃圾渗沥液的生物抑制作用,厌氧颗粒污泥的微生物种群多样性较低,相对简单的种群结构抗冲击能力较差,更容易受到外界环境变化带来的影响.

图4 样品B的古菌系统发育树Fig.4 Phylogenetic tree of archaea in sludge sample B

图5 样品B的细菌系统发育树Fig.5 Phylogenetic tree of eubacteria in sludge sample B
一般厌氧颗粒污泥对有机物的降解性能下降有2种原因:一是污泥中微生物的生物活性受到抑制导致的,二是污泥中微生物死亡导致的.由于古菌的生长周期较长,如果反应器处理效果的下降是由于古菌的大量死亡导致的,恢复反应器的运行效果则需要很长的时间[5].反应器内VFAs的含量是衡量反应器运行状态的直观且迅速的指标,为防止反应器进入超负荷运行状态时间过长导致污泥中功能微生物的大量死亡,应密切注意出水VFAs的含量变化.
克隆文库法对混合菌群的群落结构进行考察存在一定的误差,比如由于克隆文库中克隆子数量的因素带来的偶然误差.在实验条件允许情况下,可以适当增加克隆子数量,减少偶然误差.
3 结论
3.1 采用EGSB工艺处理垃圾焚烧渗沥液在有机负荷低于23.1kgCOD/(m3·d)时COD去除率较高,平均达94.82%.进一步提高有机负荷,反应器进入超负荷状态,COD去除率显著降低.
3.2 反应器超负荷运行前后,在较短时间内微生物群落结构发生了明显的变化.古菌的优势菌群从产甲烷髦毛菌(68.4%)变为产甲烷微菌(51.9%);细菌的优势菌一直是低GC革兰氏阳性菌,且大多数属于Clostridiales目,具有形成芽孢的特性以抵御严格的生长环境.
3.3 反应器超负荷运行时出现的COD去除率下降以及出水VFA大量增高是由于乙酸营养型产甲烷菌的大量死亡导致的,甲烷髦毛菌的含量在超负荷运行前后的含量从68.4%降低至8.9%,产甲烷八叠球菌的含量一直低于3%.
[1]Nie Y.Development and prospects of municipal solid waste (MSW) incineration in China [J]. Frontiers of Environmental Science and Engineering in China,2008,2(1):1-7.
[2] Chen D,Christensen T H.Life-cycle assessment(EASEWASTE)of two municipal solid waste incineration technologies in China[J].Waste Management and Research,2010,28:508.
[3]Wiszniowski J,Robert D,Surmacz-Gorska J.Landfill leachate treatmentmethods:A review [J].Environmental Chemistry Letters,2006,4:51-61.
[4]Agdag O N,Sponza D T.Anaerobic/aerobic treatment of municipal landfill leachate in sequential two-stage up-flow anaerobic sludge blanket reactor(UASB)/completely stirred tank reactor(CSTR)systems[J].ProcessBiochemistry,2005,40:895-902.
[5]Liu J,Luo J,Zhou J,Liu Q,et al.Inhibitory effect of high-strength ammonia nitrogen on bio-treatment of landfill leachate using EGSB reactor under mesophilic and atmospheric conditions[J].Bioresource Technology,2012,113:239-243.
[6]Parawira W,Murto M,Zvauya R,et al.Comparative performance of a UASB reactor and an anaerobic packed-bed reactor when treating potato waste leachate[J].Renewable Energy,2006,31:893-903.
[7]Bertin L,LampisS,Todaro D,etal.Anaerobic acidogenic digestion of olive mill wastewaters in biofilm reactors packed with ceramic filters or granular activated carbon[J].Water Research,2010,44:4537-4549.
[8]Schmidt T M,DeLong E F,Pace N R.Analysis of a marine picoplankton community by 16s rRNA gene cloning and sequencing[J].Bacteriology,1991,173:4371-4378.
[9]孙寓姣,左剑恶,陈莉莉.同时产甲烷反硝化颗粒污泥中微生物群落结构 [J].中国环境科学,2007,27(1):44-48.
[10]Bainotti A E,Futagami K,Nakashimada Y.PH Auxostat continuous culture ofAcetobacterium sp.coupled with removal of acetate byMethanosaeta concilii[J].Biotechnology Letters,1997,19:989-993.
[11]Liu W T,Chan O C,Fang H H.Characterization of microbialcommunity in granularsludge treating brewery wastewater[J].Water Research,2002,36(7):1767-1775.
[12]邢 薇,左剑恶,林 甲,等.20℃EGSB反应器中颗粒污泥的微生物种群结构分析 [J].环境科学,2008,29(9):2558-2563.
[13]马溪平.厌氧微生物学与污水处理 [M].北京:化学工业出版社,2005:107.
[14]Angelakis E,Roux V,Raoult D,et al.Human case of Atopobium rimae bacteremia[L].Emerging Infectious Diseases,2009,15(2):354-355.
[15]Mechichi T,Labat M,Patel B K,et al.Clostridium methoxybenzovoranssp.nov.,a new aromatic o-demethylating homoacetogen from an olive mill wastewater treatment digester[J].InternationalJournalofSystematic and Evolutionary Microbiology,2009,49:1201-1209.
[16]Ye J,Mu Y,Cheng X,et al.Treatment of fresh leachate with high-strength organics and calcium from municipal solid waste incineration plant using UASB reactor[J].Bioresource Technology,2011,102:5498-5503.
