不同Fe(III)对活性污泥异化铁还原及除磷影响研究
2013-01-18王亚娥冯娟娟
王亚娥,冯娟娟,李 杰
(兰州交通大学环境与市政工程学院,甘肃 兰州 730070)
微生物异化Fe(III)还原是一个重要的生物及地球化学过程.该过程使有机或无机的电子供体以Fe(III)作为终端电子受体而被氧化,将难溶的三价铁氧化物还原成可溶解性的Fe(II),并从中获取能量,促进微生物生长、繁殖及酶的合成[1].研究表明,微生物异化Fe(III)还原过程可耦联有机物,尤其是难降解有机物(如氯代有机物、偶氮染料、石化类有机物)的氧化降解[2-3]、有毒重金属离子(铀,铬,砷等)的矿化[4]及参与自然界中的氮/磷循环[5-7].因此,成为近年来环境污染修复与治理的热门方法之一.异化Fe(III)还原微生物即铁还原菌(IRB)是活性污泥的重要组成部分,可占活性污泥微生物总量的3%左右[8],因此,强化污水处理系统中微生物异化Fe(III)还原过程,一方面可以提高污水处理系统对难降解有机物的降解效率;另一方面可以利用还原产物Fe(II)与磷酸盐的沉淀作用改善污水处理系统的除磷效果,实现化学除磷与生物除磷的有机结合.目前,国内外关于这方面的研究还少见报道.本文以活性污泥为菌源,通过介入不同的Fe(III),在兼性厌氧/严格厌氧条件下考察了不同Fe(III)对活性污泥异化铁还原过程的影响,同时考察该过程的除磷效果,并对除磷机理进行了初步探讨.以期为这一技术在污水处理中的应用提供理论基础.
1 材料与方法
1.1 试验材料
1.1.1 接种污泥来源 接种污泥取自本实验室中投放Fe0的SBBR反应器,该反应器有效容积为0.36m3,生物载体除Fe0外,还投放一定比例的具有自主知识产权的纳米凹凸棒土复合亲水性聚氨酯泡沫填料[9].该反应器已稳定运行1年多,污泥具有较高的微生物活性,其污泥沉降比(SV)为12%,pH值为7.2,所含Fe(II)和Fe(tot)含量分别为14.83,200.55mg/L.其中反应体系内污泥接种量为4.24g/L.
1.1.2 Fe(III)的制备 为研究不同Fe(III)对微生物异化Fe(III)还原的影响,试验选用氧化铁皮(即废铁磷)、青矿、红矿作为Fe(III)源,并以常用的 Fe(III)源——Fe(OH)3进行对比.试验用Fe(OH)3悬液(含铁量为5.188g/L)采用人工合成的方法制备,即用0.4mmol/L的FeCl3和0.5mol/L NaOH溶液慢速中和沉淀,得到的红褐色沉淀用去离子水反复洗涤,重复6次至完全去除悬液中的氯离子和钠离子为止[10].对氧化铁皮、青矿及红矿进行铁含量测定及X-ray晶体结构鉴定,氧化铁皮(含铁量71.3%)取自北京某铁矿厂,表面呈红色.青矿和红矿取自河南省济源市王屋铁矿厂,含铁量分别为60.7%、36.1%(W/W).投加前将氧化铁皮剪碎至粒径为2.0~3.0mm的条状,2种矿石均粉碎、研磨、筛分,选择80目粒径进行试验.
1.2 试验方法
10mL葡萄糖(10mmol/L)、5mL氯化铵(5g/L)及25mmol/L的磷酸盐缓冲液(KH2PO4与K2HPO4的摩尔比为0.5809)1.5mL.分别添加不同形式Fe(III)作为唯一电子受体,投加量均为1g.
试验中采用兼性厌氧和严格厌氧2种条件进行对比试验.取9个系列100mL血清瓶(其中兼性厌氧4个系列,严格厌氧4个系列,每个系列包括9个瓶),将上述铁还原培养基置于高压灭菌锅内,于121℃下灭菌20min,放至无菌室进行冷却,严格按无菌操作法接种经厌氧处理[(30±1)℃下密封7d]后的上述接种污泥20mL,同时设置灭菌的活性污泥(CK1)(用15%(V/V)的乙醇浸泡隔夜)[11]及仅有Fe(III)的不接种体系(CK2)作为对照.设置CK2为考察Fe(III)源对磷的表面吸附作用.最后,补充去离子水至有效容积60mL.其中严格厌氧组均充氮气5min,排氧,各组均加盖密封,于(30±1)℃恒温培养箱中避光培养.所有测试均3次重复.试验过程中通过测定体系中ORP,发现严格厌氧条件下ORP小于-250mV,兼性厌氧条件下ORP在-100mV左右.
1.3 取样及测定方法
每次采样时各取出1瓶,充分摇匀,各取试样2份.其中一份用于Fe(II)和Fe(tot)浓度的测定,即吸取2mL悬液,置于含8mL 0.5mol/L盐酸溶液的带盖聚乙烯离心管中,在摇床上震荡浸提1h[12].另取一份(10mL)用于TP的测定.均在1500r/min的转速下离心10min,取上清液用0.22μm滤膜过滤.各指标的测定均采用标准法[13].Fe(II)及Fe(tot):邻菲啰啉分光光度法,TP:钼酸铵分光光度法.ORP:便携式多参数(pH/Oxi 340i)测定仪.
2 结果与讨论
2.1 Fe(III)浓度对各条件下IRB富集培养的影响
2.1.1 兼性厌氧条件 从图1可以看出,由于灭菌的对照组中无微生物参与,体系的Fe(II)及Fe(III)浓度基本保持不变,这说明其他体系中所发生的Fe(II)及Fe(III)的变化是由IRB作用而产生.除对照组外,其他4个体系前7d天Fe(II)累计浓度均随着培养时间的延长而持续增高,表现出较好的铁还原能力,Fe(II)产生率分别为:Fe(OH)321.74mg/(L·d)、氧化铁皮 20.10mg/(L·d)、青矿13.90mg/(L·d)和红矿 12.08mg/(L·d),与不同形式Fe(III)源的含铁量呈现较好正相关;而在7~13d,4个系列Fe(II)浓度均呈现快速下降趋势,13d后基本稳定,稳定后体系中Fe(II)浓度由高到底的顺序依次为氧化铁皮、青矿、红矿及Fe(OH)3体系.从体系悬浮混合液中Fe(III)的浓度变化来看,Fe(III)的浓度以Fe(OH)3体系为最高,其他依次为灭菌的对照组、红矿、青矿.最值得注意的是氧化铁皮体系中Fe(III)的浓度在前7d呈现出持续下降的趋势,而从7d后则呈持续增加,16d后其体系中Fe(III)的浓度已超过Fe(OH)3体系.说明氧化铁皮是一种较易被微生物利用的Fe(III)源形式.
2.1.2 严格厌氧条件 由图2可以看出,不同Fe(III)对Fe(II)产生量及不同体系中Fe(III)浓度的变化趋势与兼性厌氧条件相一致.各体系在7d时累计Fe(II)产生量达到最大,Fe(OH)3最高,氧化铁皮、青矿和红矿依次降低,最大Fe(II)产生率分别为 27.58,20.28,16.88,15.27mg/(L·d),稍高于兼性厌氧条件.
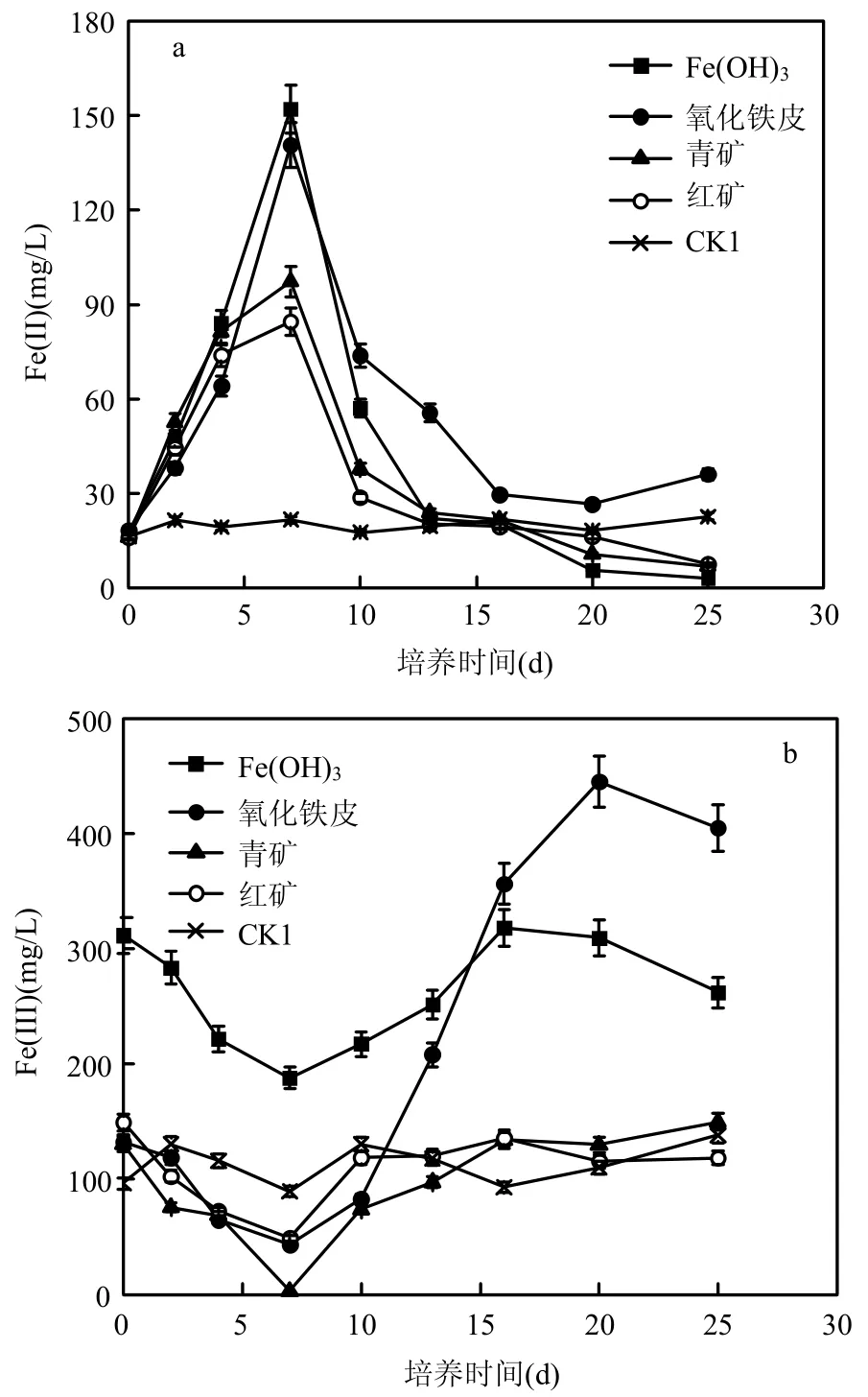
图1 兼性厌氧条件下Fe(II)及Fe(III)浓度的变化Fig.1 Variation of iron(II)and iron(III)concentrations in facultative anaerobic conditions
由图1、图2可以看出,累计培养7d后,体系中Fe(II)浓度均呈现持续下降的趋势.分析原因,可能由于以下几个方面导致:根据相关报道[14-15],在微生物异化铁还原过程中伴随有磁铁矿的形成,磁铁矿形成过程会消耗体系中大量的Fe(II),导致Fe(II)浓度显著下降.本试验初始接种液含有一定量的氨氮(约为117.9mg/L)与硝态氮(约为16.2mg/L),这为厌氧氨氧化菌的生长提供了条件.张蕾等[16]研究结果显示,铁离子对厌氧氨氧化菌的生长有较好的促进作用,体系中厌氧氨氧化菌的生长消耗Fe(II)离子.不同条件下各体系Fe(III)浓度在累计培养7d后均出现了不同程度的升高,尤其是氧化铁皮体系.
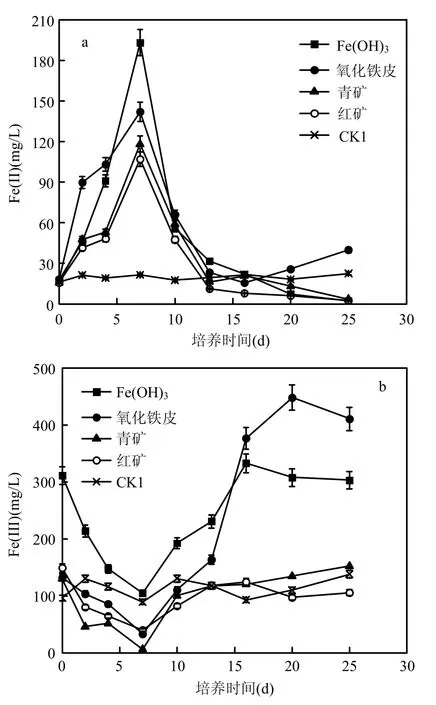
图2 严格厌氧条件下Fe(II)及Fe(III)浓度的变化Fig.2 Thevariationofiron(II)andiron(III)concentrations in strictly anaerobic conditions
可以推测7d后体系中厌氧氨氧化作用积累的 NO3-可能促进了 NO3--依赖型 Fe(II)氧化[17-18]作用的发生,将产生的Fe(II)进一步氧化为Fe(III).由于本研究未涉及脱氮效果,关于该体系中铁离子的存在形式及形态转换以及与氮素循环之间的关系,有待做进一步的研究.
2.2 不同Fe(III)微生物异化还原中的除磷效果

图3 不同DO条件下各体系除磷效果的比较Fig.3 Comparison of phosphorous removal efficiency in different DO conditions
从图3可以看出,无论是兼性厌氧还是严格厌氧条件,各体系总磷浓度变化趋势基本相似,前7d铁还原速率较高的Fe(OH)3与氧化铁皮体系,TP浓度均出现了急剧下降的趋势,出水TP浓度已达到2mg/L以下,之后继续降低,最终低于0.5mg/L.铁还原速率较低的青矿、红矿体系中,TP浓度下降较慢,25d后仍保持在2mg/L以上.对照图1、图2可以看出,TP浓度的变化与体系的Fe(II)及Fe(III)离子浓度有密切关系,2种离子浓度越高,TP的去除速率就越快.
分析原因,IRB将Fe(III)还原为Fe(II),产生的Fe(II)直接与HPO42-等作用生成FeHPO4,以沉淀方式得以去除.同时,由于体系中发生Fe(III)的水解反应,即产生 Fe(OH)+、Fe(OH)2、Fe(OH)3-等水合物,这些单核络合物一方面可以和PO43-反应形成难溶性的盐,另一方面通过碰撞进一步缩合,进而形成一系列不同形态的多核络合物 Fen(OH)m(n>1,m=3n).这些含铁的多核络合物往往具有较多的正电荷和较大的比表面积,能够迅速有效的消除或降低水体中胶体的电位,通过电性中和、吸附架桥以及絮体的卷扫作用使胶体凝聚,再通过沉淀分离将磷去除[19].
2.3 机理探讨
Nielsen等报道[8],异化Fe(III)还原条件下可通过IRB介导的生物途径和Fe(III)介导的非生物途径进行磷的去除(公式(1)~公式(4)).由图4可见,一方面,IRB在氧化有机物过程中产生的电子通过呼吸链传递给Fe(III),使其还原为吸附态Fe(II).同时,未被利用的Fe(III)可发生水解作用,对磷的去除亦起到一定的促进作用.Fe(II)自身被氧化的同时与产生的HPO42-结合生成FeHPO4.该过程为IRB作用除磷.另一方面,磷吸附在铁氧化物和铁的氢氧化物表面而得以去除.
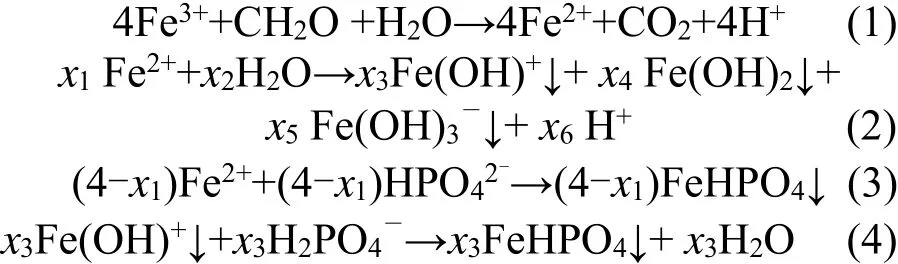
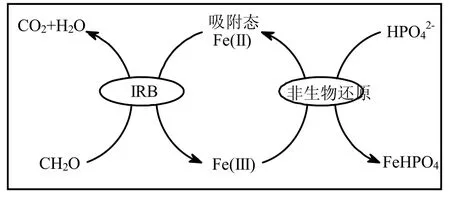
图4 IRB-Fe(III)氧化物界面交互反应机制示意Fig.4 Schematic diagram of IRB-Fe(III)oxide interact mechanism
2.3.1 表面吸附除磷 鉴于氧化铁皮处理效果明显,为考察铁氧化物及铁的氢氧化物表面对磷的吸附除磷作用大小,故采用IRB作用前后的氧化铁皮进行扫描电镜及组成成分分析.
由图5可见,氧化铁皮表面致密,经IRB作用之后,空隙增多,表现为更明显的疏松状.同时,伴随着铁离子的溶出,含铁量降低,磷含量明显增高,由初始的0.5%~0.7%增加到2.0%~7.1%(表1),因此可以证明,异化铁还原作用下的除磷作用部分是通过磷吸附在铁氧化物和铁的氢氧化物表面而得以去除[8].

图5 IRB作用前后氧化铁皮的电镜扫描图谱Fig.5 SEM of iron oxide scale by IRB before and post-interaction
2.3.2 磷的去除与Fe(II)产生速率关系 结合图4反应机制,为进一步考察体系中IRB作用下的协同除磷过程,试验过程中进行了不同形式Fe(III)的吸附试验,即CK2的对照试验.由于二价铁盐的化学沉淀除磷一般所需P/Fe摩尔比为0.33~1.0[20],因此通过P/Fe摩尔比来反应体系中IRB作用所占大小.
由图6可见,无论是兼性厌氧还是严格厌氧过程,不同Fe(III)的表面吸附作用对TP去除的贡献较小,主要为IRB驱动下TP的化学沉淀去除;从最大Fe(II)产生速率来看,由大到小顺序为Fe(OH)3>氧化铁皮>青矿>红矿,这与材料含铁量呈正相关;从P/Fe(II)(mol/mol)值来看,其中兼性条件下Fe(OH)3体系P/Fe(II)比最高,为0.18,严格厌氧条件下氧化铁皮体系最高,达到0.17.P/Fe(II)越大,则除磷速率与Fe(II)产生速率越接近,说明IRB作用下的沉淀除磷所占主导地位越明显,足以解释磷酸盐螯合Fe(II)的假设.与此相反,红矿体系P/Fe最低,说明该体系中磷的去除主要是由于过量的Fe(II)对磷的表面吸附去除和通过生成可溶性Fe(OH)2进行联合除磷,而非Fe(II)与少量磷酸盐的沉淀去除[21].

表1 IRB作用前后氧化铁皮组成成分比较Table 1 Composition of iron oxide scale by IRB before and post-interaction
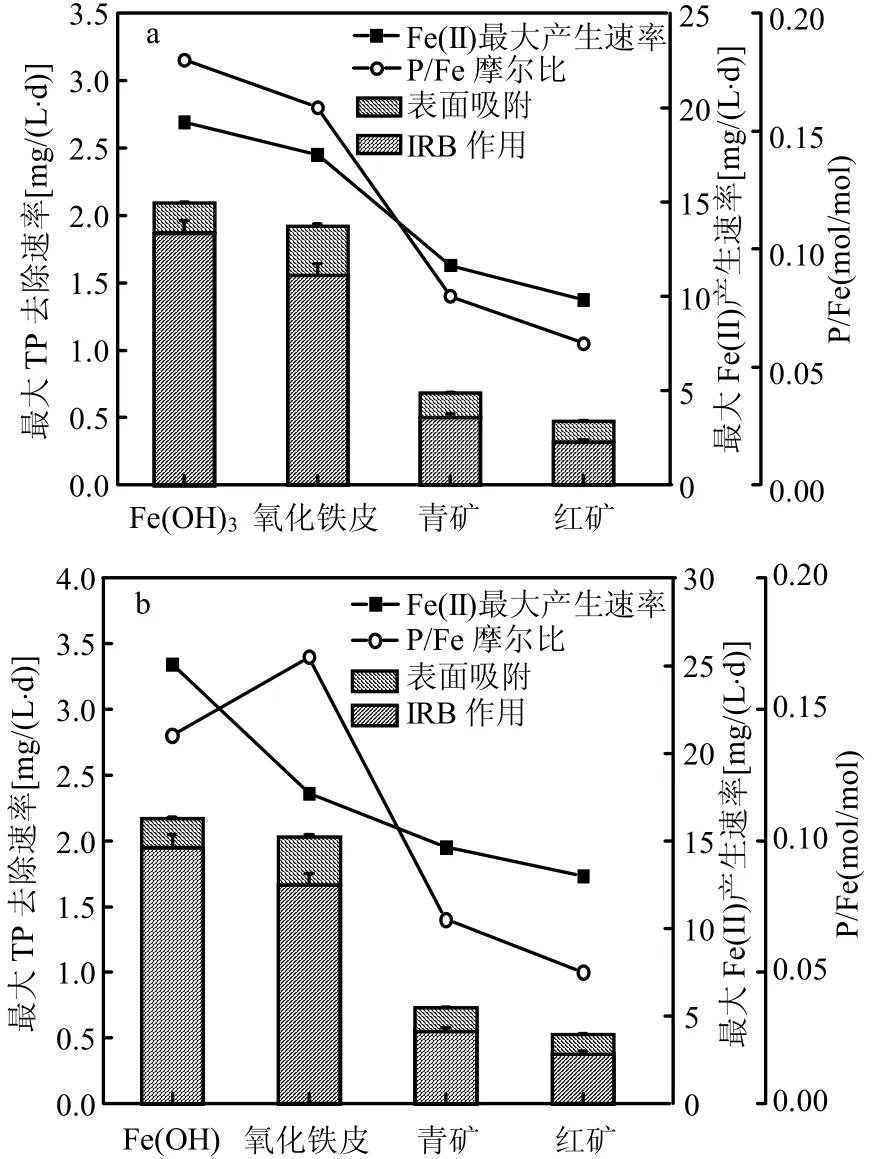
图6 除磷速率与Fe(II)产生速率之间的关系Fig.6 Relationship between phosphorus removal and ferrous production rates
3 结论
3.1 异化铁还原微生物对磷的去除与产生的Fe(II)浓度具有一定的相关性,这与投加Fe(III)形式密切相关.更容易利用比表面大的非晶体及易溶性铁(如Fe(OH)3),无定形氧化铁(如氧化铁皮)通常较易被微生物还原,而对有稳定晶体结构形式的铁(如青矿、红矿)则难以利用.
3.2 铁还原菌对磷的去除与材料的含铁量呈正相关,对磷的去除效果顺序依次为:Fe(OH)3>氧化铁皮>青矿>红矿.经过25d的恒温培养,兼性厌氧(严格厌氧)条件下,TP去除率分别达到96.0%(98.0%)、97.1%(99.1%)、83.7%(91.2%)及68.5%(73.4%).
3.3 该体系可以将化学除磷与生物除磷有机结合,IRB作用下的除磷占主导地位,Fe(III)化合物表面的吸附作用贡献较小.
[1]Weelink S A B,Miriam H A,Eekert V,et al.Degradation of BTEX by anaerobic bacteria:physiology and application[J].Environmental Science and Biotechnology,2010,9(4):359-385.
[2]Li F B,Li X M,Zhou S G,et al.Enhanced reductive dechlorination of DDT in an anaerobic system of dissimilatory iron-reducing bacteria and iron oxide [J].Environmental Pollution,2010,158(5):1733-1740.
[3] Lovley D R,Anderson R T.In fl uence of dissimilatorymetal reduction on fate of organic and metal contaminants in the subsurface[J].Hydrogeology Journal,2000,8(1):77-88.
[4]Kashefi K, Moskowitz B M, Lovley D R.Characterization of extracellular minerals produced during dissimilatory Fe(III)and U(VI)reduction at100℃ byPyrobaculum islandicum[J].Geobiology,2008,6(2):147-154.
[5]Stabnikov V P,Tay S T L,Tay D K,et al.Effect of iron hydroxide on phosphate removal during anaerobic digestion of activated sludge[J].Applied Biochemistry and Microbiology,2004,40(4):376-380.
[6]Ivanov V,Stabnikov V,Zhuang W Q,et al.Phosphate removal from the returned liquor of municipal wastewater treatment plant using iron-reducing bacteria[J].Journal of Applied Microbiology,2005,98(5):1152-1161.
[7]Clement J C,Shresthab J,Ehrenfeld J G.Ammonium oxidation coupled to dissimilatory reduction of iron under anaerobic conditions in wetland soils[J].Soil Biology and Biochemistry,2005,37(12):2323-2328.
[8]Nielsen J L,Juretschko S,Wagner M,et al.Abundance and phylogenetic af fi liation of iron reducers in activated sludge as assessed by fluorescence in situ hybridization and microautoradiography [J]. Applied and Environmental Microbiology,2002,68(9):4629-4636.
[9]张 媛,李 杰,石宗利.纳米凹凸棒土复合亲水性聚氨酯泡沫微生物固定化载体:中国,zl200910117393.3[P].2009-07-22.
[10]Lovley D R,Phillips E J P.Organic matter mineralization with the reduction of ferric iron in anaerobic sediments[J].Appl.Environ.Microbiol.,1986,52,683-689.
[11]Ivanov V,Lim J J W,Stabnikova O,et al.Biodegradation of estrogens by facultative anaerobic iron-reducing bacteria[J].Process Biochemistry,2010,45(2):284-287.
[12]Stabnikov V P,Tay S T L,Tay D K,et al.Effect of iron hydroxide on phosphate removal during anaerobic digestion of activated sludge[J].Applied Biochemistry and Microbiology,2004,40(4):376-380.
[13]国家环境保护总局.水和废水检测分析方法(第四版)[M].北京:中国环境科学出版社,2002.
[14]朱维晃,臧 辉,吴丰昌.微生物还原针铁矿胶体的动力学特征及其影响因素 [J].中国环境科学,2011,31(5):820-827.
[15]Benner S G,Hansel C M,Wielinga B W,et al.Reductive dissolution and biomineralization ofiron hydroxide under dynamic flow conditions[J].EnvironmentalScience and Technology,2002,36(8):1705-1711.
[16]张 蕾,郑 平,胡安辉.铁离子对厌氧氨氧化反应器性能的影响 [J].环境科学学报,2009,29(8):1629-1634.
[17]Jeppe L, Nielsen, Per H. Nielsen. Microbial nitrate-dependent oxidation of ferrous Iron in activated sludge[J].Environmental Science Technology,1998,32:3556-3561.
[18]Ratering S,Schnell S.Nitrate-dependent iron(II)oxidation in paddy soil[J].EnvironmentalMicrobiology,2001,3(2):100-109.
[19]徐丰果,罗建中,凌定勋.废水化学除磷的现状与进展[J]. 工业水处理,2003,23(5):18-20.
[20]Takacs I,Murthy S,Smith S,et al.Chemical phosphorus removal to extremely low levels:experience of two plants in the Washington,DC area[J].Water Science and Technology,2006,53(12):21-28.
[21]Ivanov V,Kuang S L,Stabnikov V,et al.The removal of phosphorus from reject water in a municipal wastewater treatment plant using iron ore[J].Journal of Chemical Technology and Biotechnology,2009,84(1):78-82.
