结直肠癌腹膜种植转移的相关因素分析*
2013-01-07何振华宋现青吴振杰欧阳君张薛磊
何振华 张 森 宋现青 吴振杰 欧阳君 张薛磊
结直肠癌是常见的消化道肿瘤之一,据估计2008年全球超过120多万新增病例,而死亡人数估计在608 700例[1]。在过去的20多年尽管结直肠癌的诊断和治疗方面取得了巨大进步,但复发和转移仍是治疗失败的主要原因[2]。而腹膜种植是结直肠癌转移的常见方式之一,其发生率为2%~19%[3-4],而且发生腹膜转移的患者预后很差,未经治疗的患者其自然病程中位生存时间为5~9个月[5-7]。然而,目前关于结直肠癌的临床病理特征与结直肠癌腹膜转移之间的关系是有限的。本研究通过搜集1 170例结直肠癌患者的临床病理资料进行回顾性分析,探讨结直肠癌腹膜种植转移的相关危险因素。
1 材料与方法
1.1 临床资料
收集2005年1月至2009年12月就诊广西医科大学第一附属医院结直肠癌患者资料,建立了全部资料的Excel数据库。病例入选标准:1)肿瘤原发于结直肠,排除肛管癌病例;2)有明确的病理学诊断;3)根据术中探查发现及术后病理结果证实为腹膜种植转移;4)排除家族性腺瘤性息肉病恶变、间质瘤和黑色素瘤;5)排除其他脏器肿瘤转移至腹膜。本组共1 170例,其中男性711例(60.7%),女性459例(39.3%);年龄18~93岁,中位年龄57岁。将患者分为腹膜转移组(92例)和无腹膜转移组(1 078例)。
1.2 观察指标
性别、年龄(岁)、病程(月)、民族、血型、首发症状(大便改变,腹部症状,二者均有或其他)、肿瘤部位(左半结肠、右半结肠、直肠)、肿瘤占肠腔周径(≤1/2周、>1/2周、术后剖开标本测量)、肿瘤最大径(≤5 cm、>5 cm)、肿瘤大体(隆起型、溃疡型、浸润型)、组织病理学类型(腺癌、黏液腺癌或印戒细胞癌、未分化癌)、分化程度(高、中、低)、肠壁浸润深度(黏膜或肌层、浆膜层及浆膜外)、淋巴结转移(有、无),血总蛋白量(<60 g/L、≥60 g/L),血白蛋白量(<40 g/L、≥40 g/L),术前血清CEA水平(<10 ng/mL、≥10 ng/mL)(表1)。
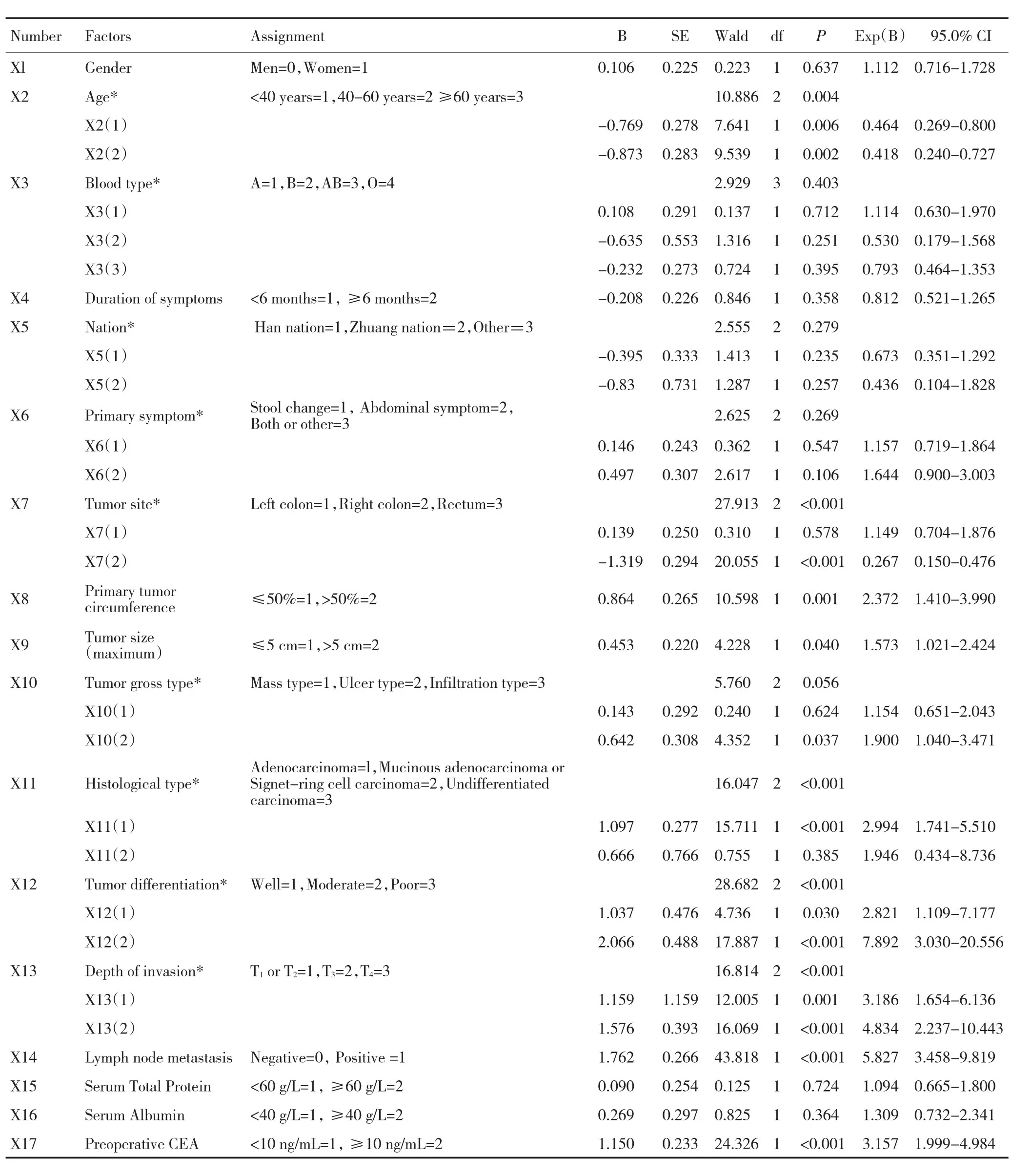
表1 1170例结直肠癌腹膜转移患者的临床病理特征单因素分析Table1 Logistic univariate regression analysis of peritoneal metastasis in 1170 colorectal cancer cases
1.3 统计学分析
采用非条件Logistic回归单因素分析,对有统计学意义的变量进行非条件Logistic回归多因素分析(采用逐步后退法wald),从而消除变量之间的干扰交互因素,确立影响腹膜转移发生的独立因素。P<0.05为差异有统计学意义。所有数据均使用SPSS 13.0统计软件进行分析。
2 结果
2.1 腹膜转移的单因素分析
与腹膜转移有密切相关的因素有年龄、肿瘤部位、肿瘤占肠腔周径、肿瘤最大径,组织病理学类型、分化程度、肠壁浸润深度、淋巴结转移和血CEA水平(P<0.05,表1)。
2.2 多因素回归分析结果
将单因素分析中有意义的9个因素行多因素分析,采用非条件Logistic回归多因素分析(后退法)。结果显示肿瘤部位、肿瘤占肠腔周径、分化程度、肠壁浸润深度、淋巴结转移和血CEA水平与结直肠癌腹膜转移有关(表2)。
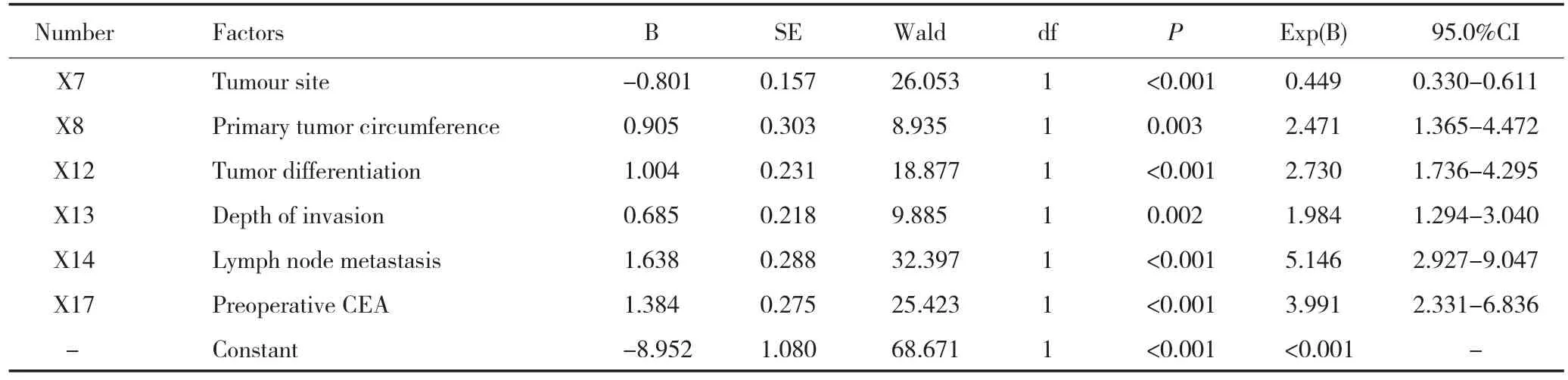
表2 1 170例结直肠癌腹膜转移患者的临床病理特征多因素分析Table2 Logistic multivariate regression analysis of peritoneal metastasis in 1170 colorectal cancer cases
3 讨论
许多研究报道,4%~12%结直肠癌患者在初诊时就出现腹膜转移,而4%~19%患者在根治手术后出现腹膜转移[4-5,8-11]。本研究中结直肠癌腹膜转移的发生率为7.86%,与国内外报道一致。相关文献报道结直肠癌腹膜种植转移的危险因素有组织学类型、分化程度、肠壁侵袭深度、淋巴结转移[4-5,8]。本研究发现肿瘤部位、肿瘤占肠腔周径、分化程度、肠壁浸润深度、淋巴结转移和血CEA水平与结直肠癌腹膜转移密切相关。
本研究单因素和多因素分析均提示肿瘤部位与结直肠癌腹膜转移相关。本组病例中,右半结肠癌腹膜转移率为12.9%(38/294),左半结肠癌转移率为11.4%(35/306),均明显高于直肠癌的3.3%(19/569),差异有统计学意义(χ2=31.844,P<0.001)。Segelman等[4]分析了11 124例结直肠癌患者,发现结肠癌比直肠癌更容易发生腹膜转移(10.5%vs.4.2%,P<0.001),特别是右半结肠癌。Lemmens等[8]发现与右半结肠癌相比,左半结肠癌发生腹膜转移率较低。这种现象可能是,由于结肠癌特别是右半结肠癌无症状期较长,且肿瘤直径通常较大,因此肿瘤浸润浆膜表面面积较大,从而增加肿瘤细胞脱落进入腹腔机会。此外,右半和左半结肠的胚胎起源、粪便的接触和遗传差异也可能是引起右半结肠癌腹膜转移率较高的原因[12-13]。
肿瘤浸润肠腔周径的大小是影响发生腹膜转移的重要因素之一,原位的肿瘤越大,越容易发生腹膜转移。本研究中,原发病灶的肿瘤的大小占肠腔周径>1/2周的腹膜转移率为10.2%(73/716),而占肠腔周径≤1/2周组的腹膜转移率为4.19%(19/454),两者差异有统计学意义(χ2=11.163,P=0.001)。肿瘤能够生长到大于肠腔1/2周,说明肿瘤具有丰富的血供和大量的血管。肿瘤的发生发展过程,其实就是肿瘤细胞不断增殖、浸润的过程,肿瘤的大小实际反应了肿瘤的病期;肿瘤越大,病期越长,则浸润越深,加上患者就诊较晚,肿瘤细胞已经有足够的时间发生远处器官的转移或形成微转移病灶。
此外,肿瘤分化程度也是结直肠癌腹膜转移的危险因素。本组病例显示肿瘤分化程度越低越容易出现腹膜转移(χ2=32.797,P<0.001)。因为肿瘤细胞分化程度越差,生长潜能越强,分裂迅速,越容易向大肠周围组织、毛细血管淋巴管侵袭和转移,从而更容易导致腹膜转移。有研究发现肿瘤分化差的结直肠癌肿瘤细胞,E-钙依赖黏附素与α-连环蛋白表达显著下降,使癌细胞间连接松散而易于脱落,发生浸润和转移[14-16]。
本组病例未突破肌层者的腹膜转移率为3.1%,浸润浆膜者为9.0%,侵及浆膜外者为14.1%。无论单因素或多因素分析结果都显示腹膜种植转移与肿瘤浸润深度有关。浆膜层的血管、淋巴管丰富,随着肿瘤浸润深度加深,大量具有活性的癌细胞穿透浆膜层后脱落并进入腹腔,形成腹腔内游离癌栓,黏附并降解腹膜细胞外基质,着床于腹膜间皮组织并增生,最终导致腹膜转移瘤的形成[17]。
本研究显示淋巴结转移与结直肠癌腹膜种植转移密切相关。本组病例淋巴结阳性的腹膜转移率为14.6%,明显高于淋巴结阴性的2.8%,差异有统计学意义(χ2=53.765,P<0.001),多因素分析也提示淋巴结阳性者其转移风险为阴性者的5.146倍(95%CI 2.929~9.047)。本研究与国内外的报道一致[4-5,8-9]。另有研究报道,在结直肠癌腹膜转移的患者中,有淋巴结转移者比无淋巴结转移者的预后差[18-19]。一旦癌细胞脱落,黏附分子CD44蛋白的过量表达介导肿瘤细胞和内皮细胞结合,也能使癌细胞获得淋巴细胞的伪装,容易进入淋巴结形成转移[20]。
血CEA水平升高预示结直肠癌肿瘤分期较晚和肿瘤细胞增殖较强,也提示肿瘤分化低、病理类型较差以及转移的发生。研究发现血清中CEA水平明显升高与结肠癌出现大网膜转移及其他器官转移密切相关[21]。刘峰等[9]的研究也发现术前血清CEA≥10 ng/mL是结直肠癌腹膜种植转移的一个重要危险因素。本研究结果显示CEA≥10 ng/mL组的结直肠癌患者腹膜种植转移率是12.9%,明显高于CEA<10 ng/mL组的4.5%(χ2=26.493,P<0.001),多因素分析显示血清CEA水平是腹膜种植转移的独立危险因素,CEA≥10 ng/mL发生腹膜种植转移的风险是CEA<10 ng/mL的3.991倍。提示在临床上可根据术前血清CEA水平来预测患者是否可能存在腹膜种植转移,为制定下一步治疗方案提供依据。
结直肠癌一旦发生腹膜种植转移,如未予治疗其预后极差。若能依据临床病理因素来准确预测腹膜转移的发生,并指导进一步治疗和随访,对于提高患者的生存率,改善预后有重要意义。对于有以下高危相关因素:原发肿瘤为结肠癌,特别是右半结肠癌,术中发现肿瘤原发病灶浸润超过肠腔>1/2周,组织类型为恶性分化差,肿瘤浸润浆膜或浆膜外,有淋巴结转移,术前CEA水平≥10ng/mL的患者,要对其加强随访,以尽早发现腹膜转移或局部复发。
1 Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
2 Cunningham D,Atkin W,Lenz HJ,et al.Colorectal cancer[J].Lancet,2010,375(9719):1030-1047.
3 Koppe MJ,Boerman OC,Oyen WJ,et al.Peritoneal carcinomatosis of colorectal origin:incidence and current treatment strategies[J].Ann Surg,2006,243(2):212-222.
4 Segelman J,Granath F,Holm T,et al.Incidence,prevalence and risk factors for peritoneal carcinomatosis from colorectal cancer[J].Br J Surg,2012,99(5):699-705.
5 Jayne DG,Fook S,Loi C,et al.Peritoneal carcinomatosis from colorectal cancer[J].Br J Surg,2002,89(12):1545-1550.
6 晏仲舒.对待腹膜肿瘤种植转移的新概念[J].中国普通外科杂志,2006,15(10):801-802.
7 Gomez-Portilla A,Cendoya I,Lopez de Tejada I,et al.Principles of the treatment of peritoneal carcinomatosis due to colorectal cancer.Current review and update[J].Cir Esp,2005,77(1):6-17.
8 Lemmens VE,Klaver YL,Verwaal VJ,et al.Predictors and survival of synchronous peritoneal carcinomatosis of colorectal origin:a population-based study[J].Int J Cancer,2011,128(11):2717-2725.
9 刘 峰,余 江,梁耀泽,等.结直肠癌腹膜种植转移的危险因素分析[J].中华胃肠外科杂志,2011,14(4):254-256.
10 宋 武,何裕隆,蔡世荣,等.结直肠癌伴腹膜扩散的临床病理分析及手术干预对预后的影响[J].中华外科杂志,2008,46(21):1634-1637.
11 Sjo OH,Berg M,Merok MA,et al.Peritoneal carcinomatosis of colon cancer origin:highest incidence in women and in patients with right-sided tumors[J].J Surg Oncol,2011,104(7):792-797.
12 Glebov OK,Rodriguez LM,Nakahara K,et al.Distinguishing right from left colon by the pattern of gene expression[J].Cancer Epidemiol Biomarkers Prev,2003,12(8):755-762.
13 Meguid RA,Slidell MB,Wolfgang CL,et al.Is there a difference in survival between right-versus left-sided colon cancers[J]?Ann Surg Oncol,2008,15(9):2388-2394.
14 Raftopoulos I,Davaris P,Karatzas G,et al.Level of alpha-catenin expression in colorectal cancer correlates with invasiveness,metastatic potential,and survival[J].J Surg Oncol,1998,68(2):92-99.
15 Filiz AI,Senol Z,Sucullu I,et al.The survival effect of E-cadherin and catenins in colorectal carcinomas[J].Colorectal Dis,2010,12(12):1223-1230.
16 Aresu L,Pregel P,Zanetti R,et al.E-cadherin and beta-catenin expression in canine colorectal adenocarcinoma[J].Res Vet Sci,2010,89(3):409-414.
17 Ceelen WP,Bracke ME.Peritoneal minimal residual disease in colorectal cancer:mechanisms,prevention,and treatment[J].Lancet Oncol,2009,10(1):72-79.
18 Matsuda K,Hotta T,Takifuji K,et al.Lymph nodes ratio is associated with the survival of colorectal cancer patients with peritoneal carcinomatosis[J].Am Surg,2011,77(5):602-607.
19 Chua TC,Yan TD,Ng KM,et al.Significance of lymph node metastasis in patients with colorectal cancer peritoneal carcinomatosis[J].World J Surg,2009,33(7):1488-1494.
20 Reeder JA,Gotley DC,Walsh MD,et al.Expression of antisense CD44 variant 6 inhibits colorectal tumor metastasis and tumor growth in a wound environment[J].Cancer Res,1998,58(16):3719-3726.
21 荆结线,杜丽莉,王文达,等.结直肠癌患者血清肿瘤标志物水平与临床病理学特征的关系[J].中国肿瘤临床,2008,35(3):162-166.
