超声消融子宫肌瘤后残余瘤组织的核磁共振影像学转归*
2013-01-07陈文直陈锦云唐良萏王智彪
秦 娟 陈文直 陈锦云 胡 亮 刘 政 唐良萏 王智彪
子宫肌瘤是激素依赖性良性肿瘤,其生长与遗传、年龄、生长因子等因素有关。目前的保守性手术治疗主要有子宫动脉栓塞、子宫肌瘤剔除术。超声消融子宫肌瘤是一种新型保留子宫的非侵入性治疗技术。基于对周边组织的安全性考虑,超声消融子宫肌瘤的范围为肌瘤假包膜内消融,部分患者肌瘤周边会有或多或少的瘤组织未被消融。本研究旨在研究超声消融后残余瘤组织的转归,为超声消融子宫肌瘤的预后和临床治疗方案的完善提供依据。
1 材料与方法
1.1 纳入标准
2007年1月至2009年9月,重庆医科大学附属第一医院诊断为子宫肌瘤有手术指征,并要求超声消融治疗的患者,符合以下条件:1)绝经前妇女,已婚已育,无生育要求;2)治疗前未使用GnRHa、避孕药等激素类药物;3)肌瘤最大径2 cm以上,1个或多个肌瘤;4)同意接受镇静镇痛下超声消融治疗,能准确地交流治疗过程中的感受并签署治疗同意书。排除病例:1)月经期妇女、妊娠期妇女(妊娠试验阳性)及哺乳期妇女;2)合并妇科其他疾病者(如阴道炎、盆腔炎、肿瘤等);3)结缔组织病或接受过腹部大剂量放疗者;4)严重的全身系统疾病及有核磁共振禁忌者。退出病例:因故未完成随访不纳入统计。研究获得重庆医科大学伦理委员会批准,并取得患者知情同意。
1.2 超声消融治疗
采用重庆海扶(HIFU)技术有限公司研制的JC型聚焦超声肿瘤治疗系统对靶肌瘤进行一次性超声消融治疗。参数设置:治疗超声换能器频率0.8 MHz,功率0 W~400 W可调,物理学焦域为1.5 mm×1.5 mm×10 mm。机载显像超声频率3.5 MHz。治疗中静脉给予低剂量的枸橼酸芬太尼及马来酸咪达唑仑使患者处于镇静状态。在实时超声声像监控下进行超声消融。治疗步骤在已发表的文献里有详细描述[1-2]。
1.3 核磁共振影像学评价及随访
治疗后通过增强核磁共振成像显示的无灌注区评价消融的结果[2-3],并测量无灌注区和残留灌注区体积。核磁共振(MRI,Magnetom Symphony 1.5T MR Tim系统)成像资料采用DICOM文件储存。Hifu_3DTPS基础类应用软件(重庆微海软件开发有限责任公司)测量并自动三维重建计算体积。
靶肌瘤体积在T2WI各层面进行描绘并计算,无灌注区体积在增强T1WI各层面进行描绘并计算(图1)。体积消融率(消融率)=无灌注区体积/靶肌瘤体积×100%,残余瘤组织=子宫肌瘤体积-无灌注区体积。消融肌瘤为多个的患者,肌瘤最大径>2 cm者为靶肌瘤,其体积消融率=靶肌瘤无灌注区体积之和/靶肌瘤体积之和×100%,残余瘤组织体积=靶子宫肌瘤体积之和-无灌注区体积之和。消融子宫肌瘤治疗后嘱所有患者回访4次监测消融后1、3、6、12个月靶肌瘤体积(uterine fibroid volume,UFV),残余瘤组织体积(residual tumor volume,RMV),无灌注区体积(non-perfused volume,NPV)。根据超声消融后1个月内所测消融率,将患者分为三组:A组:消融率>90%;B组:消融率70%~90%;C组:消融率<70%,比较子宫肌瘤消融治疗后不同消融率组残余瘤组织的转归情况。随访并记录超声消融治疗后12个月内因子宫肌瘤体积增大,以及症状缓解不明显或加重的患者行再次超声消融治疗、手术及子宫动脉栓塞的再干预情况。
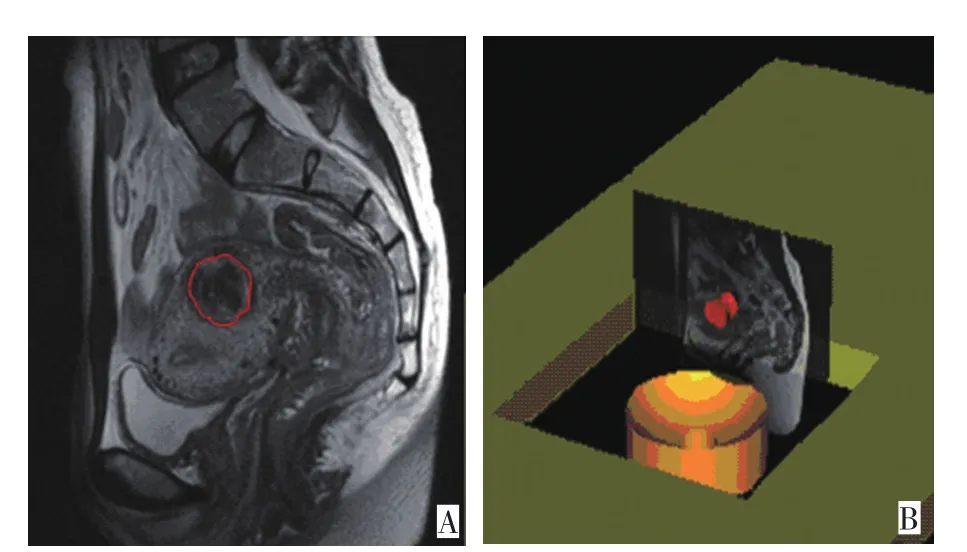
图1 Hifu_3DTPS软件重建及测量子宫肌瘤体积Figure1 Hifu_3DTPS software reconstruction and measurement of the uterine fibroid volume
1.4 统计学方法
2 结果
2.1 纳入患者的基本情况
按照研究设计完成随访资料完整者共71例,平均年龄为(36.33±5.21)(28~45)岁。其中,多发肌瘤患者16例,肌瘤个数36个,消融肌瘤个数30个,符合研究的靶肌瘤22个,单发肌瘤患者55例,纳入研究的靶肌瘤共77个。三组例数为A组21例、B组28例、C组22例,靶肌瘤个数分别为26个、29个、22个,三组平均年龄分别为(36.95±5.57)、(36.88±5.10)、(35.74±5.14)岁。三组治疗前子宫体积分别为(266.78±133.83)cm3、(236.34±117.07)cm3及(243.27±113.01)cm3,靶肌瘤体积分别为(38.06±13.46)cm3、(632.40±9.82)cm3及(37.36±12.68)cm3,三组间比较差异无显著性统计学意义(P>0.05)。位于前壁的肌瘤占靶肌瘤的比例,三组分别为57.7%、41.4%、18.2%;后壁肌瘤所占比例分别为19.2%、34.5%、59.1%,A、B组分别与C组相比,差异有显著性统计学意义(P<0.01)。位于肌壁间及浆膜下的肌瘤,三组分别为20、25、21个及1、3、1个,B组浆膜下肌瘤所占比例,与C组比较差异有显著性统计学意义(P<0.05)。T2高信号肌瘤占靶肌瘤的比例,三组分别为15.4%、20.7%、59.1%,A、B组分别与C组相比,差异有显著性统计学意义(P<0.05,表1)。
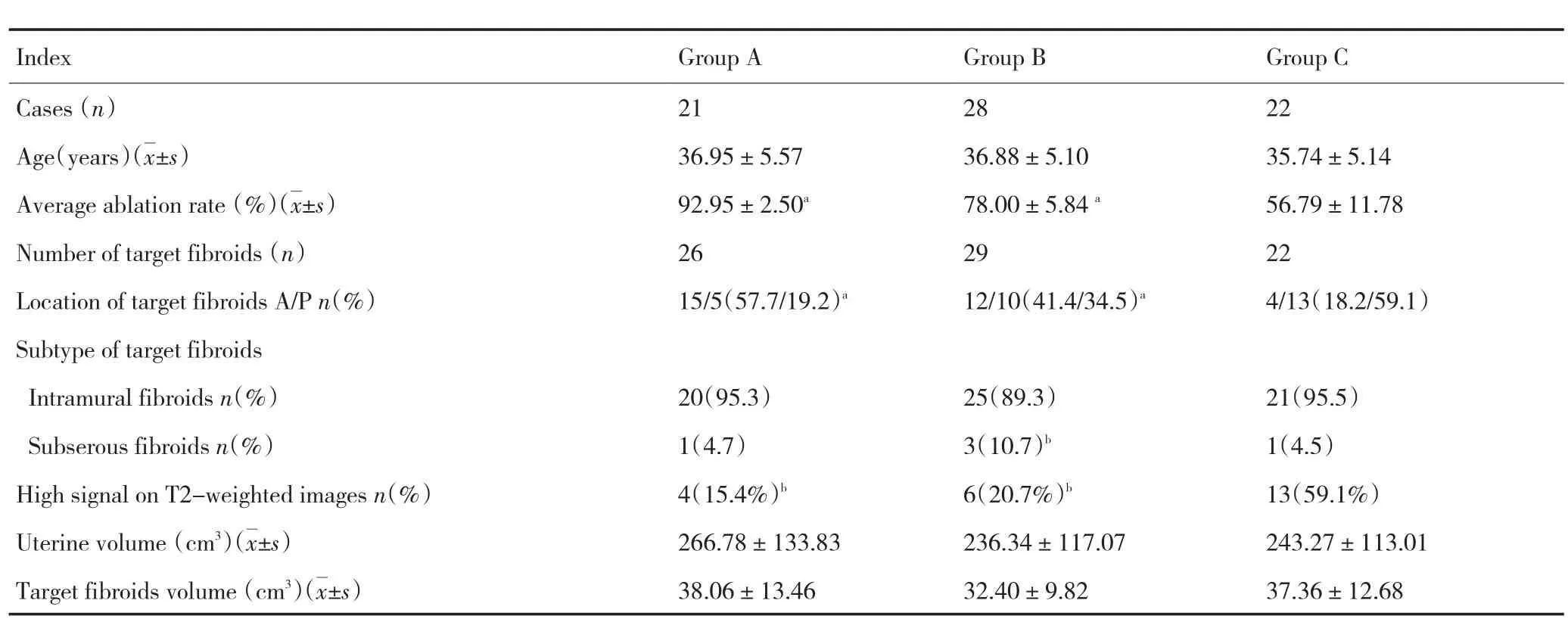
表1 三组患者的基本情况Table1 General characteristics of patients in the three treatment groups
2.2 残余瘤组织转归情况
三组子宫肌瘤及残余瘤组织体积转归情况(表2):超声消融率>90%组(A组)24例患者,术后3、6、12月随访靶肌瘤体积呈明显缩小趋势(P<0.01)。治疗后1个月内所测平均残余瘤组织体积(3.18±1.70)cm3,术后3、6、12个月分别为(1.88±0.99)cm3、(1.00±0.54)cm3、(0.44±0.20)cm3,在术后12个月内是呈逐渐缩小,前3个月缩小最快、第2个3个月缩小次之,术后6个月以后体积缩小最慢,术后12个月平均残余瘤组织体积缩小差异有显著性统计学意义(P<0.01)。无灌注区体积(NPV)术后由(25.12±12.61)cm3吸收至(10.99±8.28)cm3(P<0.01),在术后3、6、12个月吸收率分别为(5.63±20.65)%、(7.85±21.66)%、(13.29±25.58)%(图2)。
消融率70%~90%组(B组)28例患者,靶肌瘤体积术后3、6、12个月随访也呈缩小趋势(P<0.05)。治疗后1月内所测平均残余瘤组织体积(6.72±3.06)cm3,治疗3、6、12个月分别为(7.41±4.67)cm3、(5.19±3.91)cm3、(4.75±3.17)cm3,术后6个月以后体积缩小最快,体积缩小有差异(P<0.05)。术后NPV由17.21±9.19 cm3缩小至(9.14±6.42)cm3(P<0.05),在术后3、6、12月吸收率分别为(31.49±33.77)%、(36.84±25.12)%、4(4.99±30.82)%。(图2)。
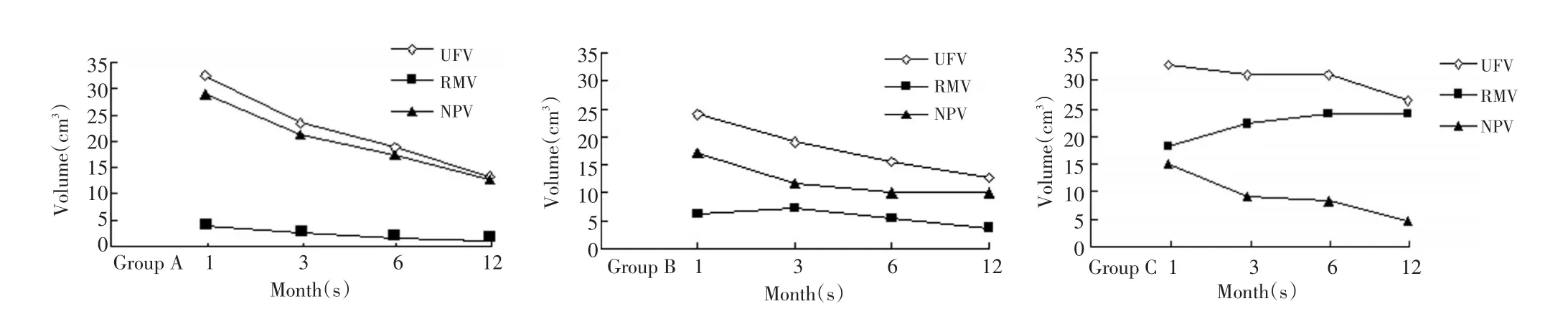
图2 超声消融治疗后A、B、C三组靶肌瘤体积(UFV)、残余瘤组织体积(RMV)及无灌注区体积(NPV)治疗后1、3、6、12个月的变化(cm3体积)Figure2 Change in UFV,RMV and NPV in the three treatment groups 1,3,6 and 12 months after HIFU(cm3Volume)
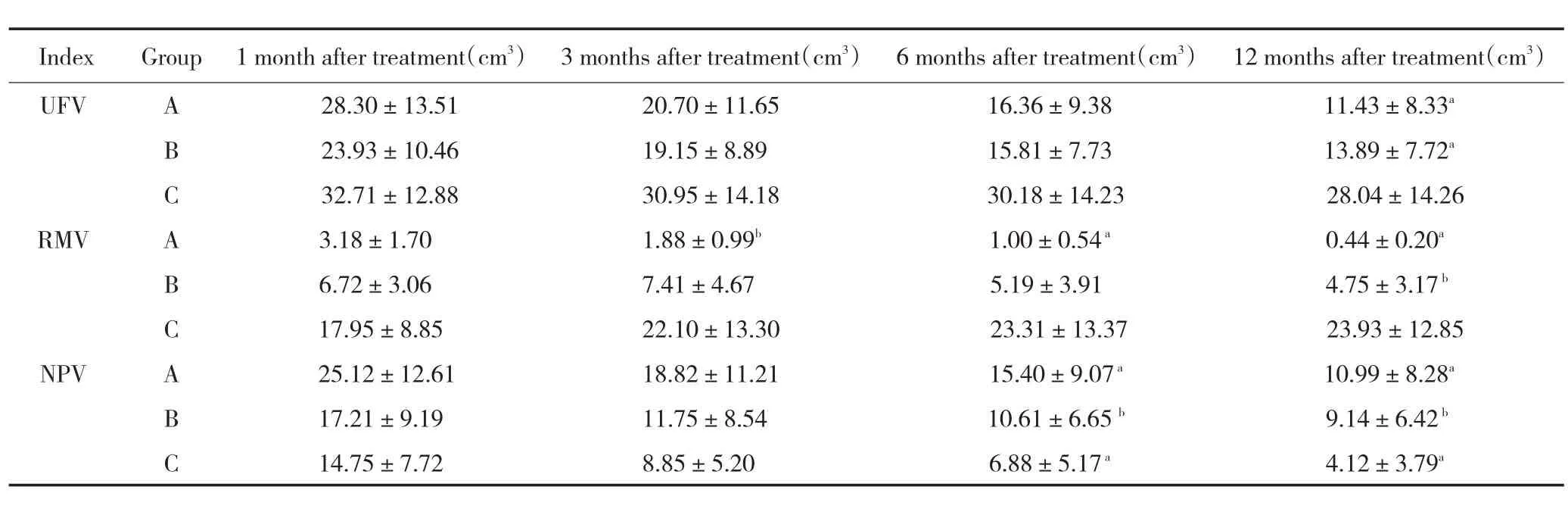
表2 子宫肌瘤及残余瘤组织体积转归Table2 Prognosis of uterine fibroid and residual tumor volume
消融率<70%组(C组)22例,靶肌瘤体积术后3、6、12个月随访体积变化差异无显著性统计学意义(P>0.05)。治疗后1个月内所测平均残余瘤组织体积为(17.95±8.85)cm3,治疗后3、6、12个月分别为(22.10±13.30)cm3、(23.31±13.37)cm3、(23.93±12.85)cm3,体积变化有增长趋势,但差异无显著性统计学意义(P>0.05)。术后NPV由(14.75±7.72)cm3缩小至4.12±3.79 cm3(P<0.01),在术后3、6、12个月吸收率分别为(36.10±31.98)%、(48.40±39.28)%、(68.46±26.91)%。
2.3 再治疗情况
74例中有16例(21.6%)术后12个月内因MRI监测子宫肌瘤体积无明显缩小或增大,以及症状缓解不明显或加重要求再次干预。消融率<70%组有12例(54.5%)再次干预治疗(再次消融9例,手术治疗2例及子宫动脉栓塞1例)。消融率70%~90%组有4例患者再次干预治疗(再次消融1例,手术治疗2例及子宫动脉栓塞1例),实际符合再治疗指征者3例(10.7%),另1例因为心理因素,要求行子宫肌瘤剔除手术。而消融率高于90%组,无一例患者在治疗后再次干预(表3)。
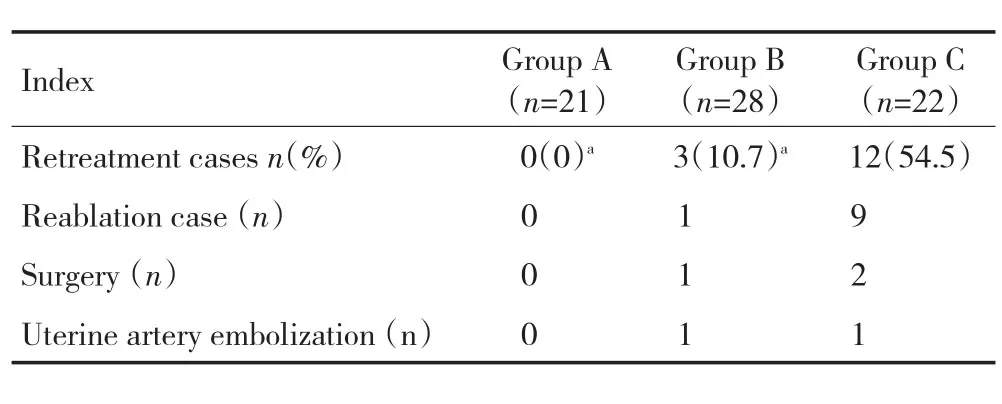
表3 三组患者再治疗情况Table3 Re-treatment cases in the three treatment groups
3 讨论
3.1 超声消融子宫肌瘤的范围
超声消融子宫肌瘤的目的是缓解与肿瘤相关的临床症状、控制肿瘤生长。因此超声消融治疗肌瘤的治疗原则是瘤内治疗,焦点必须与子宫肌瘤周边重要组织有一定的距离[4],相应位置的子宫肌瘤超声消融会有或多或少的残余瘤组织。一方面取决于子宫肌瘤周边的组织结构和毗邻关系。子宫是空腔脏器,单层肌壁厚度0.8 cm[5],子宫肌瘤发生于子宫肌层,呈膨胀性生长压迫肌壁变得更薄,甚至突向浆膜或黏膜,形成浆膜下肌瘤。表面仅有一层浆膜与腹腔相隔,浆膜外紧邻肠道,为了避免对邻近肠道和的影响,浆膜下子宫肌瘤组织消融容易比肌壁间子宫肌瘤组织出现残留,本结果也提示消融率70%~90%组的浆膜下肌瘤所占比例明显多于消融率>90%者。其次,取决于子宫肌瘤的部位,与相比前壁肌瘤,声通道上能量吸收较多,治疗剂量增加引起患者不适感觉增多,如某些邻近骶骨的后壁肌瘤,致后壁子宫肌瘤组织不易达到理想的消融效果,易出现残留。本研究结果发现C组(消融率<70%)中位于子宫后壁的肌瘤比例较另外两组高。另外,与子宫肌瘤的组织结构和功能状态不同也有关,如可以表现在T2加权像信号强度的不同[6]。C组(消融率<70%)T2加权像高信号的肌瘤比例也多于其它两组,易导致子宫肌瘤组织的残留。
3.2 超声消融术后残余瘤组织转归
子宫是由双侧子宫动脉供血的富血供器官,研究表明子宫肌瘤达到3 cm以上时已形成丰富的血管系统[7]。目前针对子宫肌瘤患者,保留子宫的手术主要有子宫肌瘤剔除术、子宫动脉栓塞治疗及超声消融治疗。子宫动脉栓塞治疗子宫肌瘤时,若栓塞不彻底,残留部分肿瘤血管则易形成侧支循环,部分栓塞的患者术后24个月再治疗的比例(50±15.2)%高于完全栓塞的患者(0)[8]。Hanafi通过随访子宫肌瘤剔除术后复发情况,发现剔除肌瘤原位复发及残留的微小肌瘤持续克隆增殖是术后新肌瘤形成的主要原因[7,9]。提示子宫肌瘤术后残余肿瘤是术后再治疗的危险因素。因此,这两种子宫肌瘤保守性手术要求尽量完全及彻底。但本研究结果却发现,当超声消融率>70%时,监测患者残余瘤组织虽有血流灌注但仍呈现缩小趋势,靶肌瘤的体积变化也呈缩小趋势。尤其是消融体积大于肌瘤体积的90%时,残余瘤组织表现为缩小趋势,甚至有的肌瘤可以全部自行吸收、消退。考虑超声具有的热效应及机械效应可以诱导细胞凋亡,抑制细胞生长。在超声消融靶区子宫肌瘤时,同时对靶区外的肌瘤组织也有一定的影响。可能通过能量的传导或是机械效应对一定大小的残余瘤组织细胞有抑制其生长的作用。既往已有报道,超声消融10%肌瘤体积可以减轻子宫肌瘤相关症状[10],但超声消融率越高,术后再治疗的发生可能性相应下降[11]。本研究结果同时发现,超声消融率>70%组术后的再治疗率低于消融率<70%组(0~14.3%,54.5%),进一步支持超声消融子宫肌瘤术后再治疗的低发生率有赖于对肌瘤进行大范围的消融这一观点。
研究结果提示超声消融率低于70%组子宫肌瘤体积在术后12个月内的缩小趋势平缓。治疗后6个月的缩小率为17.2%,明显高于Hindley等[12]报道的13.5%。Rabinovici等[13]也报道了35例MRI引导下超声消融(NPV 31±23)%治疗术后6个月子宫肌瘤缩小情况(缩小率为15%),相比较与本研究C组(NPV 56.79±11.78)%,术后6个月靶肌瘤体积的缩小率相似(缩小率为17.2%)。同时,本研究也观察到超声消融率低于70%组术后12个月内的残余瘤组织转归并非均呈现缩小的趋势,有的甚至是增长趋势,这与靶肌瘤转归趋势不一致。考虑原因可能是残余的子宫肌瘤体积越大,具有活性的肌瘤组织越大,肌瘤周边的血管密度相应增多[14],导致超声消融术后子宫肌瘤残留组织仍可获得良好的血液供应;另一方面,T2加权像呈高信号的子宫肌瘤往往提示肌瘤细胞增生活跃,如细胞型平滑肌瘤等,治疗后周边残留组织较大,瘤细胞增生活跃而致残留组织快速生长。而临床观察术后结果也提示C组的再干预的比例较高。因此,尤其对于消融率<70%的患者,应该考虑将残余肌瘤体积作为指标之一纳入临床随访中。
本研究也随访观察了无灌注区瘤组织体积的变化,结果显示三组患者消融所致凝固性坏死组织是可以被机体吸收的,但术后12个月坏死组织尚不能被完全吸收。另一方面,超声消融率<70%的患者凝固性坏死组织吸收最快,考虑凝固性坏死组织的吸收与周围组织血运有关,残余的肌瘤活性组织越大,就更有利于吸收坏死组织。消融率70%~90%组则因浆膜下肌瘤所占比例明显多于消融率>90%组,反而吸收率最慢。
总之,本研究采用的软件法监测残余瘤组织的体积,第一次观察了不同体积消融比例后的残余瘤组织的临床转归。研究结果有助于为超声消融范围提供一定的临床证据:即子宫肌瘤消融体积<70%,临床再干预风险增大;消融90%以上体积可以获得肌瘤持续缩小,甚至完全吸收。本研究对进一步完善超声消融子宫肌瘤的临床方案和评价体系有重要意义。
1 Zhang L,Chen WZ,Liu YJ,et al.Feasibility of magnetic resonance imaging-guided high intensity focused ultrasound therapy for ablating uterine fibroids in patients with bowel lies anterior to uterus[J].Eur J Radiol,2010,73(2):396-403.
2 陈文直,唐良萏,杨武威,等.超声消融治疗子宫肌瘤的安全性及有效性[J].中华妇产科杂,2010,45(12):909-912.
3 朱 丽,陈文直,陈锦云,等.子宫肌瘤超声消融与MRI信号特征关系的研究[J].第三军医大学学报,2009,31(14):1370-1373.
4 高强度聚焦超声肿瘤治疗系统临床应用指南(试行)[J].中华医学杂志,2005,85:796-797.
5 乐 杰,主编.妇产科学[M].第7版.北京:人民卫生出版社,2008:6.
6 史常旭,辛晓燕,主编.现代妇产科治疗学[M].第3版.北京:人民军医出版社,2010:160-168.
7 Hanafi M.Predictors of leiomyoma recurrence after myomectomy[J].Obstet Gynecol,2005,105(4):877-881.
8 Kroencke TJ,Scheurig C,Poellinger A,et al.Uterine artery embolization for leiomyomas:percentage of infarction predicts clinical outcome[J].Radiology,2010,255(3):834-841.
9 Holub Z,Eim J,Jabor A,Hendl A.Complications and myoma recurrence after laparoscopic uterine artery occlusion for symptomatic myomas[J].J Obstet Gynaecol Res.2006,32(1):55-62.
10 Stewart EA,Gostout B,Rabinovici J,et al.Sustained relief of leiomyoma symptoms by using focused ultrasound surgery[J].Obstet Gynecol,2007,110:279-287.
11 Fennessy FM,Tempany CM,Mc Dannold NJ,et al.Uterine leiomyomas:MR imaging-guided focused ultrasound surgery-results of different treatment protocols[J].Radiology,2007,243(3):885-893.
12 Hindley J,Gedroyc WM,Regan L,et al.MRI guidance of focused ultrasound therapy of uterine fibroids:early results[J].AJR Am J Roentgenol,2004,183(6):1713-1719.
13 J.Rabinovici,Y.Inbas,A.Revel.Clinical improvement and shrinkage of uterine fibroids after thermal ablation by magnetic resonance-guided focused ultrasound surgery[J].Ultrasound Obstet Gynecol,2007,30:771-777.
14 Walocha JA,Litwin JA,Miodoński AJ.Vascular system of intramural leiomyomata revealed by corrosion casting and scanning electron microscopy[J].Hum Reprod,2003,18(5):1088-1093.
