浙江扇脉杓兰野生居群的表型性状变异及其与地理-土壤养分因子的相关性
2012-12-31李全健王彩霞李翠新
李全健,王彩霞,田 敏,①,李翠新
(1.中国林业科学研究院亚热带林业研究所,浙江富阳311400;2.西南林业大学,云南 昆明 650224)
表型多样性是遗传多样性与环境多样性的综合体现[1],是基因和所处生态环境共同作用的结果,是生物遗传变异的表征[2]。而天然居群的表型变异具有适应和进化上的意义,是人工驯化和遗传育种研究的基础,也是揭示种群适应性的有效途径之一[3]。尽管同工酶标记和分子标记已被广泛应用于植物遗传多样性的研究[4],但表型性状的研究仍然是遗传多样性研究最基本的方法和途径[5]。近些年来,国内外许多学者通过表型变异的方法对峨眉蔷薇(Rosa omeiensis Rolfe)[6]、木香花(Rosa banksiae Ait.)[7]、岷江百合(Lilium regale Wilson)[8]、蒙古栎(Quercus mongolica Fisch.ex Ledeb.)[9]、云杉(Picea asperata Mast.)[10-12]、御谷〔Pennisetum glaucum(L.)R.Br.〕[13]、Clarkia unguiculata Lindl.[14]等多种植物进行了研究,表明利用表型性状研究居群遗传多样性仍然是重要而有效的。
扇脉杓兰(Cypripedium japonicum Thunb.)是兰科(Orchidaceae)杓兰属(Cypripedium L.)植物,叶片扇形,通常2枚,近对生,极罕有3枚叶互生;花序顶生;生于海拔1 000~2 000 m的灌木林下、林缘、溪谷旁、荫蔽山坡等较为潮湿的环境中;主要分布于陕西、甘肃、安徽、浙江、江西、湖南、湖北、四川和贵州等地[15]。其花形独特、花色鲜艳,观赏价值较高;并有活血调经、祛风止疼等药用功效[16]。人为采挖和生境变化致使其野生居群大量减少,有的遗传资源已丢失,且处于濒危状态。目前对扇脉杓兰的研究报道较少,仅见其果实发育及传粉生态学方面的初步研究结果[17-18],尚无有关其居群遗传多样性的研究报道。作者以浙江省内的6个扇脉杓兰野生居群为研究对象,对居群的表型变异规律及其与环境因子的相关性进行分析,以期了解扇脉杓兰的遗传变异程度、揭示其变异规律,为该种的科学保护和合理利用提供参考依据。
1 材料和方法
1.1 居群概况与样株选择
在浙江省临安市选取老殿、宝剑石、红蛇洞、清凉峰、大明山和里横塘6个扇脉杓兰野生居群为研究对象,基本涵盖了浙江省内该种的自然分布区,各居群的地理概况见表1。若居群中植株总数多于30株则选取开花与无花植株各15株为样株,共30株;总数不足30株时全部选为样株。样株为生长正常、无严重缺陷、无明显病虫害的植株。
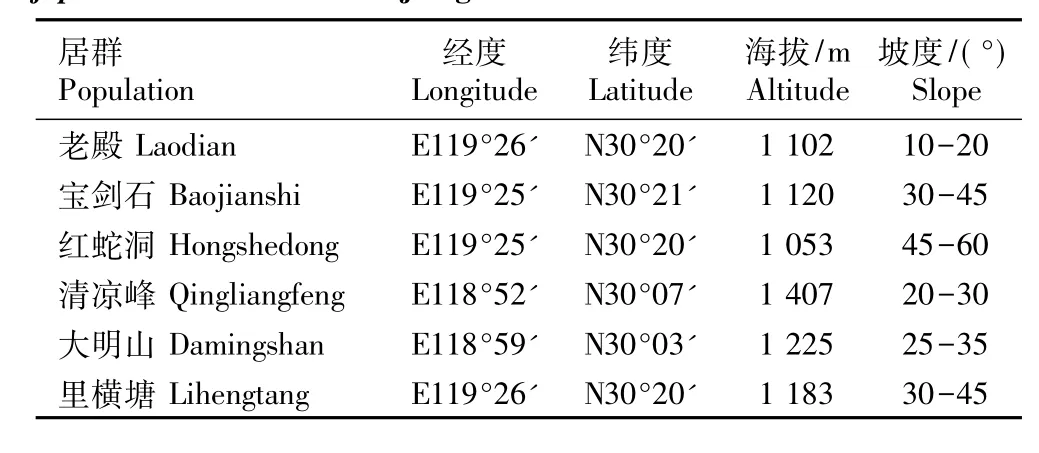
表1 浙江省6个扇脉杓兰野生居群的自然概况Table 1 Natural status of six w ild populations of Cypripedium japonicum Thunb.in Zhejiang Province
老殿居群的伴生植物有:小叶白辛树(Pterostyrax corymbosus Sieb.et Zucc.)、灯台树〔Bothrocaryum controversum(Hemsl.)Pojark.〕、柳杉(Cryptomeria fortunei Hooibrenk ex Otto et Dietr.)、牛蒡(Arctium lappa L.)、驴蹄草(Caltha palustris L.)、庐山楼梯草(Elatostema stewardii Merr.)等。宝剑石居群的伴生植物有:箬竹〔Indocalamus tessellatus(Munro)Keng f.〕、色木槭(Acer mono Maxim.)、短尾柯〔Lithocarpus brevicaudatus(Skan)Hay.〕、灯台树、延龄草(Trillium tschonoskii Maxim.)、楼梯草(Elatostema involucratum Franch.et Sav.)、牛蒡、毛叶山桐子(Idesia polycarpa var.vestita Diels)、毛茛(Ranunculus japonicus Thunb.)以及一些蕨类植物等。红蛇洞居群的伴生植物有:驴蹄草、箬竹、天目朴树(Celtis chekiangensis Cheng)、交让木(Daphniphyllum macropodum Miq.)、柳杉、短尾柯、六角莲〔Dysosma pleiantha(Hance)Woods.〕、华重楼〔Paris polyphylla var.chinensis(Franch.)H.Hara〕、倒卵叶瑞香(Daphne grueningiana H.Winkl.)等。清凉峰居群的伴生植物有:灯台树、头状四照花〔Dendrobenthamia capitata(Wall.)Hutch.〕、黄山栎(Quercus stewardii Rehd.)、中国绣球(Hydrangea chinensis Maxim.)、野蔷薇(Rosa multiflora Thunb.)等。大明山居群的伴生植物有:头状四照花、天目紫茎(Stewartia gemmata Chien et Cheng)、青 钱 柳〔Cyclocarya paliurus(Batal.)Iljinsk.〕、蓝果树(Nyssa sinensis Oliv.)、菝葜 (Smilax china L.)、华空木(Stephanandra chinensis Hance)、野蔷薇、盾叶莓(Rubus peltatus Maxim.)、榉 树〔Zelkova serrata (Thunb.)Makino〕等。里横塘居群的伴生植物有:色木槭、鸢尾(Iris tectorum Maxim.)、掌叶复盆子(Rubus chingii Hu.)、宝铎草(Disporum sessile D.Don)、金钱松〔Pseudolarix amabilis(Nelson)Rehd.〕、灯台树、箬竹、延龄草等。
1.2 方法
1.2.1 性状测定方法 用GPS测定并记录各居群的经度、纬度和海拔等地理因子;用直尺测量植株展度(两叶片尖端之间的长度)和高度(有花植株为地表到植株最高处,一般为中萼片顶端;无花植株为叶片最高处),精度0.01 cm;其余性状均用游标卡尺测量,精度0.01 mm;各性状的长度均为基部到顶端的长度,宽度则为最宽处,花梗直径则为中央直径。选择成龄叶进行测定并标记叶片:下部叶片记为下叶,上部叶片记为上叶。测量性状包括:下叶长、下叶宽、下叶长/宽比、上叶长、上叶宽、上叶长/宽比、中萼片长、中萼片宽、苞片长、苞片宽、子房长、花梗直径、花梗长、唇瓣长、唇瓣宽、植株展度、株高和地径。
1.2.2 土壤养分含量测定 在每个样地内确定3个样点,挖取距地表15 cm左右根系附近土壤,将各样地内3个样点的土壤样品混合,自然风干后研磨、备用。按照LY/T 1256—1999、LY/T 1232—1999、LY/T 1228—1999、LY/T 1233—1999、LY/T 1236—1999、LY/T 1229—1999、LY/T 1237—1999和LY/T 1239—1999的方法分析土壤中全氮、全磷、全钾、有效磷、速效钾、水解性氮和土壤有机质含量及pH,由国家林业局经济林产品质量检验检测中心(杭州)完成。各样地土壤养分含量的测定结果见表2。
1.3 统计分析方法
对测定数据进行统计分析,并应用方差分析和变异系数(CV)、多样性指数(Shannon-Weaver信息指数H′)等指标分析各表型性状的变异规律;利用相关分析、聚类分析(UPGMA法)对各表型性状间以及表型性状与地理-土壤养分因子的相关性进行分析,并建立不同居群间的亲缘关系树系图。所有统计分析均采用Excel 2003和SPSS 18.0软件完成。
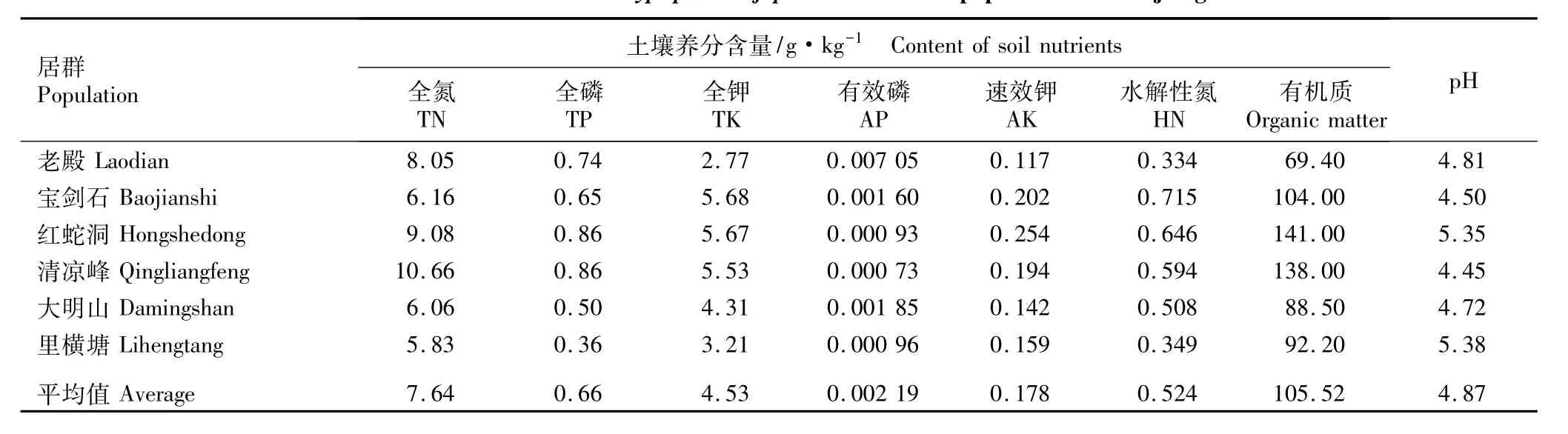
表2 浙江省扇脉杓兰居群土壤养分含量的测定结果Table 2 Determ ination result of soil nutrient content of Cypripedium japonicum Thunb.populations in Zhejiang Province
2 结果和分析
2.1 扇脉杓兰居群表型性状的变异特征
扇脉杓兰6个居群18个表型性状的测定结果见表3。红蛇洞居群植株的地径较粗,叶片、子房、唇瓣和萼片等也较大;清凉峰居群植株的地径相对稍细,叶较小,但株高最高。整体上看,6个居群子房和唇瓣的变异规律与叶片基本一致。各居群植株的下叶均大于上叶,下叶和上叶的长/宽比变异趋势基本一致,均为老殿居群最大、清凉峰居群最小,且上叶长/宽比大于下叶,说明上叶的形状比下叶圆。中萼片宽和子房长的变异趋势一致,均以红蛇洞居群最大、大明山居群最小;唇瓣长和宽的变异趋势基本一致。在野外调查过程中发现红蛇洞居群有2株样株具有3枚叶片,而且第3枚叶片小于前2枚叶片,这2株样株的叶片长和宽分别为119.65和97.85 mm、100.08和44.23 mm。说明野生居群中单株叶片数存在差异。
表3 浙江省6个扇脉杓兰居群表型性状测定值及方差分析结果(±SD)1)Table 3 Determ ination values and variance analysis result of phenotypic traits of six populations of Cypripedium japonicum Thunb.in Zhejiang Province(±SD)1)
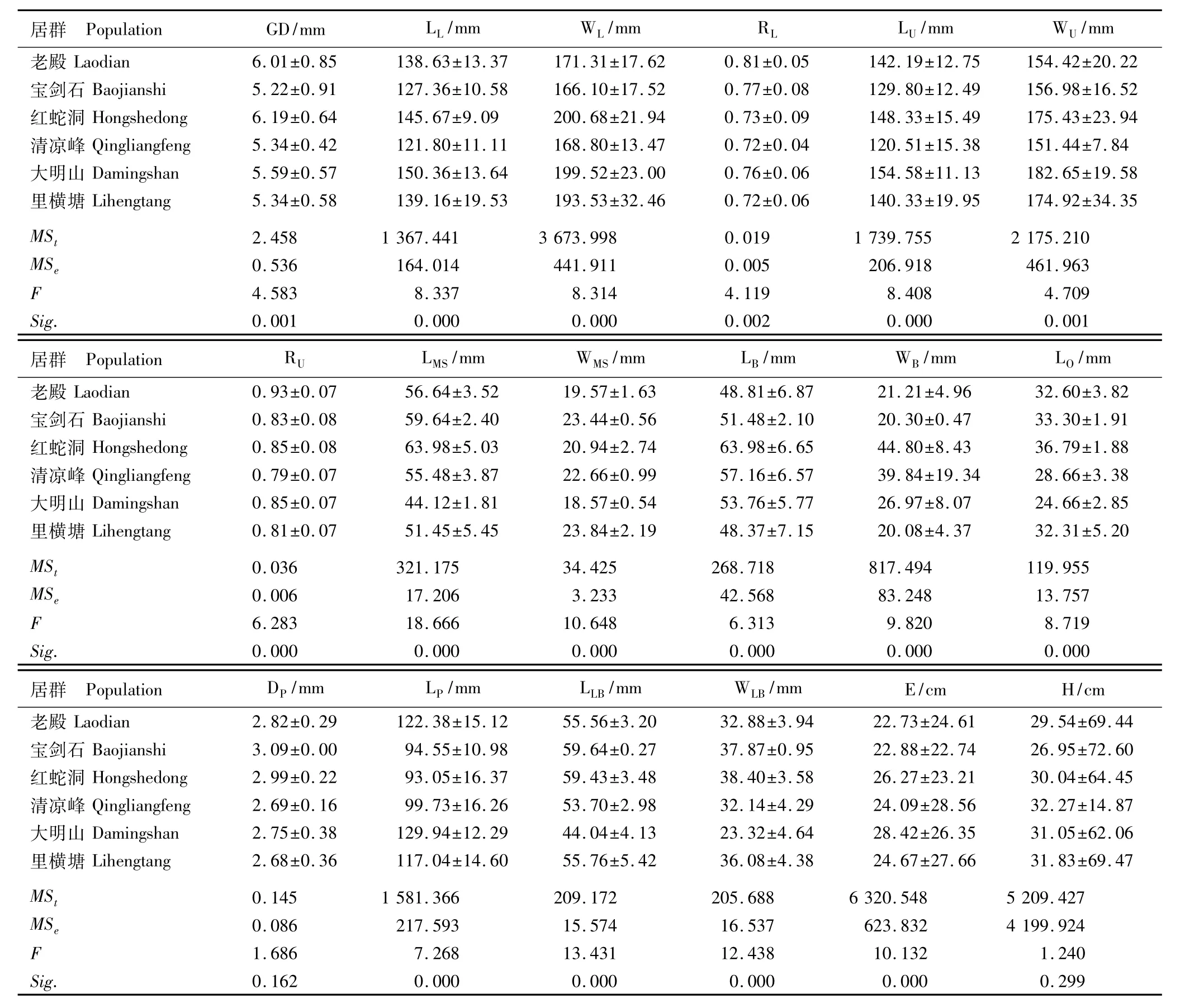
表3 浙江省6个扇脉杓兰居群表型性状测定值及方差分析结果(±SD)1)Table 3 Determ ination values and variance analysis result of phenotypic traits of six populations of Cypripedium japonicum Thunb.in Zhejiang Province(±SD)1)
1)GD:地径Ground diameter;LL:下叶长Length of lower leaf;WL:下叶宽Width of lower leaf;RL:下叶长/宽比Ratio of length to width of lower leaf;LU:上叶长Length of upper leaf;WU:上叶宽Width of upper leaf;RU:上叶长/宽比Ratio of length to width of upper leaf;LMS:中萼片长Length ofmiddle sepal;WMS:中萼片宽Width ofmiddle sepal;LB:苞片长Length of bract;WB:苞片宽Width of bract;LO:子房长Length of ovary;DP:花梗直径Diameter of pedicel;LP:花梗长Length of pedicel;LLB:唇瓣长Length of labellum;WLB:唇瓣宽Width of labellum;E:植株展度Plant exhibition degree;H:株高Plant height.MSt:居群间均方Mean square among populations;MSe:居群内均方Mean square within populations.
居群 Population GD/mm LL/mm WL/mm RL LU/mm WU/mm老殿Laodian 6.01±0.85 138.63±13.37 171.31±17.62 0.81±0.05 142.19±12.75 154.42±20.22宝剑石Baojianshi 5.22±0.91 127.36±10.58 166.10±17.52 0.77±0.08 129.80±12.49 156.98±16.52红蛇洞Hongshedong 6.19±0.64 145.67±9.09 200.68±21.94 0.73±0.09 148.33±15.49 175.43±23.94清凉峰Qingliangfeng 5.34±0.42 121.80±11.11 168.80±13.47 0.72±0.04 120.51±15.38 151.44±7.84大明山Damingshan 5.59±0.57 150.36±13.64 199.52±23.00 0.76±0.06 154.58±11.13 182.65±19.58里横塘Lihengtang 5.34±0.58 139.16±19.53 193.53±32.46 0.72±0.06 140.33±19.95 174.92±34.35 MSt 2.458 1 367.441 3 673.998 0.019 1 739.755 2 175.210 MSe 0.536 164.014 441.911 0.005 206.918 461.963 F 4.583 8.337 8.314 4.119 8.408 4.709 Sig. 0.001 0.000 0.000 0.002 0.000 0.001居群 Population RU LMS/mm WMS/mm LB/mm WB/mm LO/mm老殿Laodian 0.93±0.07 56.64±3.52 19.57±1.63 48.81±6.87 21.21±4.96 32.60±3.82宝剑石Baojianshi 0.83±0.08 59.64±2.40 23.44±0.56 51.48±2.10 20.30±0.47 33.30±1.91红蛇洞Hongshedong 0.85±0.08 63.98±5.03 20.94±2.74 63.98±6.65 44.80±8.43 36.79±1.88清凉峰Qingliangfeng 0.79±0.07 55.48±3.87 22.66±0.99 57.16±6.57 39.84±19.34 28.66±3.38大明山Damingshan 0.85±0.07 44.12±1.81 18.57±0.54 53.76±5.77 26.97±8.07 24.66±2.85里横塘Lihengtang 0.81±0.07 51.45±5.45 23.84±2.19 48.37±7.15 20.08±4.37 32.31±5.20 MSt 0.036 321.175 34.425 268.718 817.494 119.955 MSe 0.006 17.206 3.233 42.568 83.248 13.757 F 6.283 18.666 10.648 6.313 9.820 8.719 Sig. 0.000 0.000 0.000 0.000 0.000 0.000居群 Population DP/mm LP/mm LLB/mm WLB/mm E/cm H/cm老殿Laodian 2.82±0.29 122.38±15.12 55.56±3.20 32.88±3.94 22.73±24.61 29.54±69.44宝剑石Baojianshi 3.09±0.00 94.55±10.98 59.64±0.27 37.87±0.95 22.88±22.74 26.95±72.60红蛇洞Hongshedong 2.99±0.22 93.05±16.37 59.43±3.48 38.40±3.58 26.27±23.21 30.04±64.45清凉峰Qingliangfeng 2.69±0.16 99.73±16.26 53.70±2.98 32.14±4.29 24.09±28.56 32.27±14.87大明山Damingshan 2.75±0.38 129.94±12.29 44.04±4.13 23.32±4.64 28.42±26.35 31.05±62.06里横塘Lihengtang 2.68±0.36 117.04±14.60 55.76±5.42 36.08±4.38 24.67±27.66 31.83±69.47 MSt 0.145 1 581.366 209.172 205.688 6 320.548 5 209.427 MSe 0.086 217.593 15.574 16.537 623.832 4 199.924 F 1.686 7.268 13.431 12.438 10.132 1.240 Sig. 0.162 0.000 0.000 0.000 0.000 0.299
由各性状的均方差异和F检验结果可见(表3): 6个居群18个测量性状的F值为1.240~18.666,除花梗直径和株高差异不显著外,其余16个性状的差异均达到极显著水平。差异性状占总体的88.89%,说明不同居群间存在明显差异。
2.2 扇脉杓兰居群表型分化特征
2.2.1 变异系数分析 表型性状离散程度可用变异系数表示,变异系数越大,表明性状测量值的离散程度越大。由表4可知:各居群表型性状的变异程度因性状而异,唇瓣长的平均变异系数最小(6.119%)、苞片宽的平均变异系数最大(24.124%),说明唇瓣长的稳定性高于其他表型性状,而苞片宽的稳定性最小且变异比其他性状显著。同一性状在不同居群中存在较大差异,苞片宽的变异系数为清凉峰居群最大、宝剑石居群最小;下叶宽的变异系数为里横塘居群最大、清凉峰居群最小。同一居群的不同性状也存在差异,在老殿居群中变异系数最大的是株高、最小的是唇瓣长;而在清凉峰居群中变异系数最大的是苞片宽、最小的是中萼片宽。
根据居群间同一性状的变异系数可见(表4):不同表型性状的平均变异程度由大至小依次为苞片宽、株高、花梗长、上叶宽、地径、唇瓣宽、下叶宽、苞片长、上叶长、子房长、植株展度、下叶长、上叶长/宽比、花梗直径、下叶长/宽比、中萼片宽、中萼片长、唇瓣长。根据各居群18个表型性状的平均变异系数可见:里横塘居群18个性状的平均变异系数最大、宝剑石居群最小;各居群按18个表型性状的平均变异系数由大到小依次排序为里横塘居群、老殿居群、大明山居群、红蛇洞居群、清凉峰居群、宝剑石居群。
2.2.2 多样性指数分析 采用Shannon-Weaver信息指数(H′)分析扇脉杓兰各居群表型性状的多样性指数,其中地径的多样性指数最大(H′=2.045),苞片宽的多样性指数最小(H′=1.663),各表型性状的H′平均值为1.977。18个表型性状的H′值差异明显,按H′值的大小依次排序为地径(2.045)、上叶长(2.033)、植株展度(2.031)、株高(2.029)、下叶长(2.026)、上叶宽(2.026)、上叶长/宽比(2.026)、花梗直径(2.012)、中萼片宽(2.005)、唇瓣长(1.992)、下叶宽(1.988)、花梗长(1.988)、下叶长 /宽比(1.987)、子房长(1.969)、中萼片长(1.962)、唇瓣宽(1.941)、苞片长(1.859)、苞片宽(1.663)。根据野外实际观察结果以及各性状的测量值可见:在居群内或居群间地径和上叶长的差异均较大,因此其多样性指数也较高。
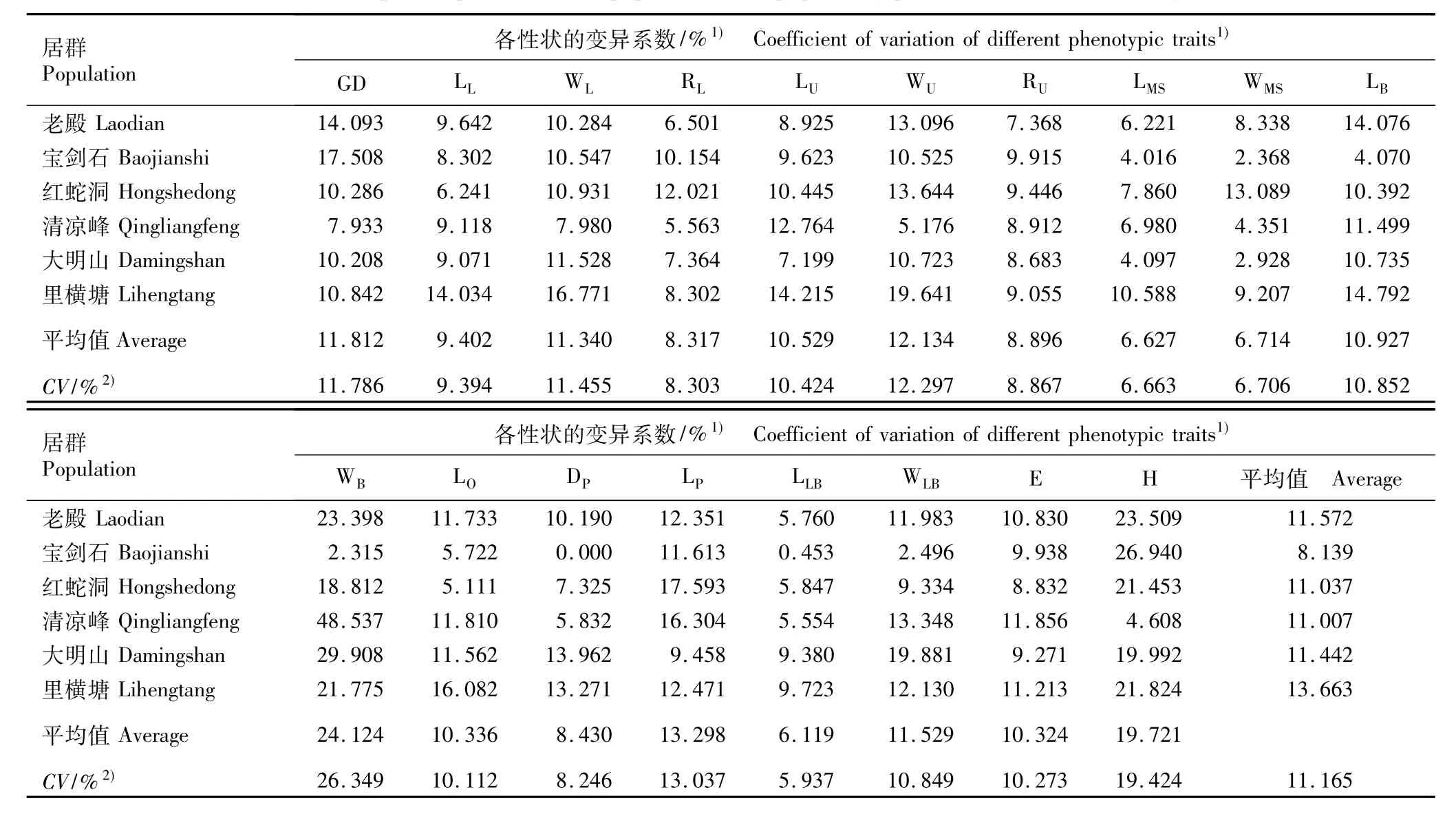
表4 浙江省6个扇脉杓兰居群表型性状的变异系数Table4 Coefficient of variation of phenotypic traits of six populations of Cypripedium japonicum Thunb.in Zhejiang Province
2.3 扇脉杓兰居群的聚类分析
根据表型性状的分析结果对6个扇脉灼兰居群进行聚类分析,结果见图1。在欧氏距离10处可以把6个居群分为3组:第1组包括清凉峰、大明山、老殿和宝剑石居群;第2组和第3组分别仅包含红蛇洞居群和里横塘居群。其中,清凉峰和大明山居群的遗传距离最小,老殿和宝剑石居群的遗传距离也较为接近,说明清凉峰与大明山居群间的分化程度最小,老殿和宝剑石居群间的分化程度也较小;而红蛇洞及里横塘居群与前述4个居群的分化程度均较大。

图1 基于表型性状分析结果的6个扇脉杓兰居群UPGMA聚类图Fig.1 UPGMA clustering dendrogram of six populations of Cypripedium japonicum Thunb.based on phenotypic traits analysis
2.4 扇脉杓兰居群表型性状和地理-土壤养分因子的相关性分析
2.4.1 表型性状间的相关性分析 对扇脉杓兰18个表型性状的平均值进行相关性分析,结果表明:下叶长与上叶长、下叶宽与上叶宽极显著正相关,相关系数分别为0.993和0.960;并且下叶长分别与下叶宽、上叶宽显著正相关,相关系数分别为0.861和0.858;下叶长/宽比与上叶长/宽比显著正相关(r=0.872)。苞片长与苞片宽极显著正相关(r= 0.952)。中萼片长分别与子房长、唇瓣长和唇瓣宽显著正相关,相关系数分别为0.889、0.910和0.857;中萼片长与花梗直径显著负相关(r=-0.835)。子房长分别与花梗长和花梗直径极显著正相关,相关系数分别为0.931和0.929;花梗长和花梗直径极显著正相关(r=0.984)。植株展度分别与下叶宽和上叶宽显著正相关,相关系数分别为0.854和0.866。株高和花梗长显著负相关(r=-0.911)。
2.4.2 表型性状与地理-土壤养分因子间的相关性分析 对扇脉杓兰18个表型性状的平均值与居群的地理-土壤养分因子进行相关性分析,结果见表5。由表5可见:地径与速效钾含量显著正相关(r= 0.854);子房长、唇瓣长和宽与全磷含量显著正相关,相关系数分别为0.916、0.854和0.914;植株展度与土壤pH显著正相关(r=0.810)。中萼片宽、苞片宽和唇瓣宽均与经纬度负相关,唇瓣长与经度负相关,其余各性状与经、纬度均正相关;多数性状与海拔负相关、少数正相关。虽然各表型性状与经纬度和海拔存在正、负相关性,但均不显著。另外,多数性状与土壤养分因子正相关,少数则负相关。
由表5还可见:中萼片长和宽、苞片长和宽、子房长、唇瓣长和宽等7个花部性状中有3个与某项地理-土壤因子存在显著相关性,而另外11个营养器官性状中只有地径和植株展度与某项地理-土壤因子存在显著相关性,说明环境对扇脉杓兰繁殖器官的影响大于对营养器官的影响。由各地理-土壤养分因子对各性状的相关系数绝对值之和[7,16]可知,各地理-土壤养分因子对扇脉杓兰表型性状的影响程度有一定差异,按相关系数绝对值之和的大小依次排序为有效磷含量、土壤pH、速效钾含量、纬度、海拔、全磷含量、土壤有机质含量、经度、全氮含量、水解性氮含量、全钾含量。
3 讨论和结论
表型性状具有稳定性和变异性,是植物基因型和所处生态环境的综合体现[19]。植物居群间的变异程度能反映该种类对不同环境的适应程度,变异系数越大,适应的环境条件越广[9,20]。研究结果表明:扇脉杓兰表型性状变异包含居群间和居群内的变异,供试的6个野生居群的18个表型性状中有16个性状的变异达到显著水平,占统计性状的88.89%;18个表型性状的方差和变异系数均有较大差异,说明扇脉杓兰的各表型性状均存在明显的遗传变异。同一性状在不同居群内的变异幅度也有差异,说明不同区域的环境异质性导致了居群表型变异的差异。扇脉杓兰6个居群间各表型性状的变异系数较大,为8.139%~13.663%,平均变异系数为11.143% 与川西云杉(Picea balfouriana Mast.)(CV=15.96%)[20]和青钱柳(CV=14.19%)[21]居群表型性状的变异系数相当,低于紫丁香(Syringa oblata Lindl.)(CV=20.73%)[1]和岷江百合(CV=30.46%)[8]居群表型性状的变异系数,也说明扇脉杓兰表型性状存在着丰富的居群间和居群内变异。
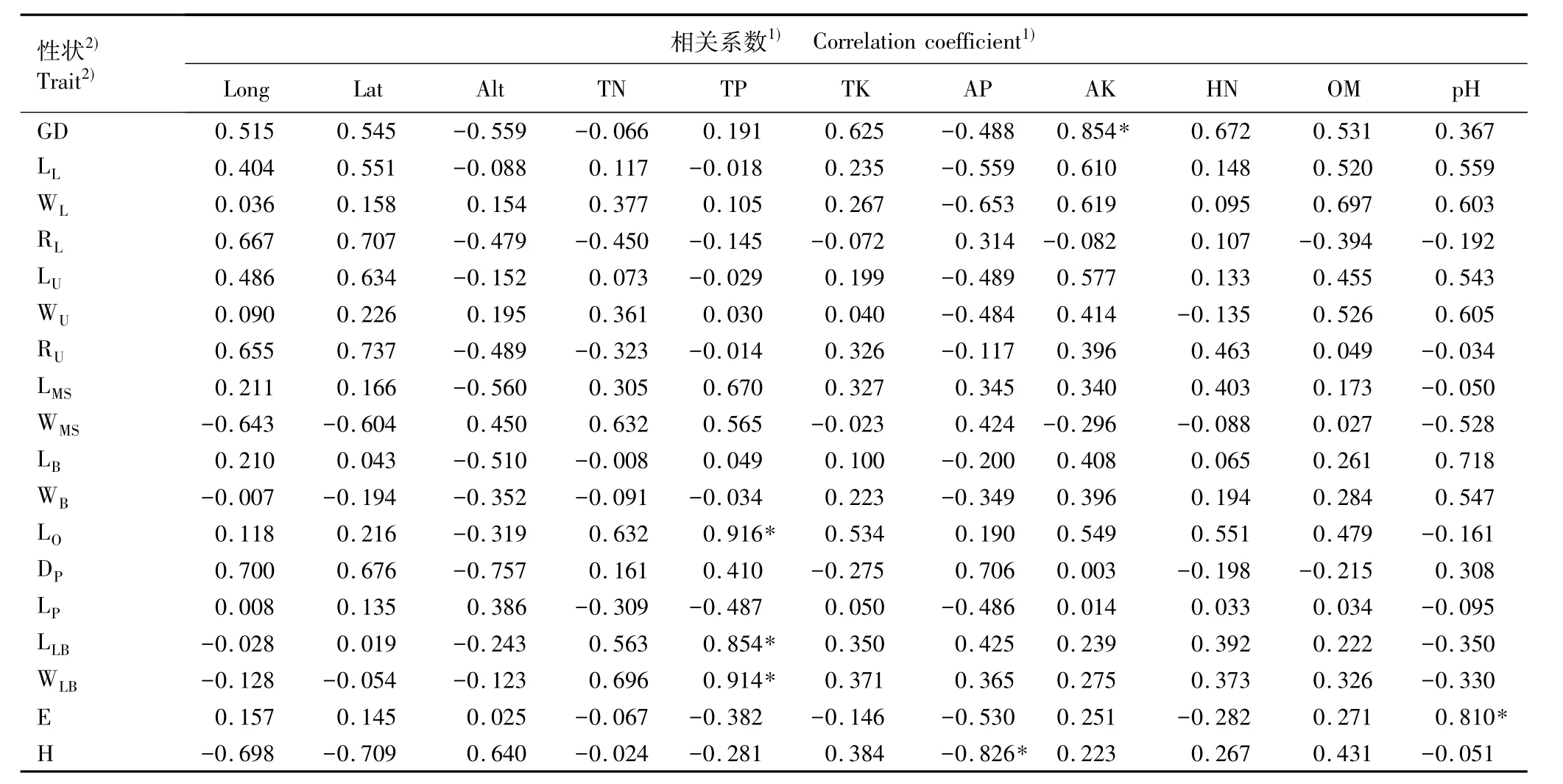
表5 扇脉杓兰居群表型性状与地理-土壤养分因子的相关系数Table 5 Correlation coefficients between phenotypic traits of Cypripedium japonicum Thunb.populations and geographical-soil nutrient factors
由扇脉杓兰居群各表型性状的Shannon-Weaver指数(H′)来看,各性状的平均多样性指数为1.977,高于茶条槭(Acer ginnala Maxim.)(H′=1.599)[22]、蚕豆(Vicia faba L.)(H′=0.829)[23]和大豆〔Glycinemax (L.)Merr.〕(H′=1.482)[24];地径的多样性指数最大、苞片宽的多样性指数最小,各性状多样性指数的变化幅度为1.663~2.045,也说明扇脉杓兰居群具有较高的遗传多样性。
扇脉杓兰各表型性状与地理-土壤养分因子的相关性不高,仅地径和速效钾含量显著正相关(r= 0.854);子房长、唇瓣长和宽与全磷含量显著正相关,相关系数分别为0.916、0.854和0.914;植株展度和土壤pH显著正相关(r=0.810)。而茶条槭的17个表型性状与土壤中的全氮、全钾、水解性氮、速效钾、有效磷、土壤有机质含量和含水量均存在显著或极显著的正、负相关性[22],说明物种之间的差异可能与其生境中的土壤肥力或各居群生境的异质性有关。扇脉杓兰各居群土壤中水解性氮和速效钾含量的平均值分别为524.33和178.00 mg·kg-1,均高于茶条槭(分别为388.08和113.8 mg·kg-1)[22]和蚕豆[23](分别为93.0和150.0 mg·kg-1)。而从野外调查情况来看,扇脉杓兰居群生活的土壤均为灰黑色,并且较松软、潮湿,说明其生长土壤的肥力较高。当土壤满足植物生长所必需的营养成分时,植株各表型性状之间的差异较小。扇脉杓兰的部分表型性状与土壤中的速效钾含量、全磷含量和pH有显著相关性,说明土壤中这3个因子的差异是形成扇脉杓兰表型性状多样性的原因之一。
供试的6个扇脉杓兰野生居群的海拔为1 053~1 407 m,变化幅度相对较小,这也可能是其多数表型性状与海拔相关性不高的原因之一。另外,扇脉杓兰野生居群表型多样性与其所处的生境密切相关,自然选择的压力越大,表型的多样性就越丰富。在野生状态下,扇脉杓兰居群的伴生植物类型多样,有的居群生活在乔木、灌木和草本组成的混交林中,有的则生长于只有灌木和草本组成的灌草层中。此外,坡向和坡度也各不相同,呈现多样化生境。由于扇脉杓兰长期生活在多样化的环境中,对生境的适应使其表型性状呈现丰富的多样性。但是,对于扇脉杓兰表型变异是否受基因控制或受控制的程度尚不知晓,有待进一步研究。
[1]明 军,顾万春.紫丁香表型多样性研究[J].林业科学研究,2006,19(2):199-204.
[2]葛 颂,洪德元.遗传多样性及其检测方法[M]∥中国科学院生物多样性委员会.生物多样性研究的原理和方法.北京:中国科学技术出版社,1994:123-140.
[3]曾 杰,郑海水,甘四明,等.广西西南桦天然居群的表型变异[J].林业科学,2005,41(2):59-65.
[4]STAUB JE,SEROYEN F C,MCCREIGHT JD.Genetic diversity in cucumber(Cucumis sativus L.) Ⅲ:an evaluation of India germplasm[J].Genetic Resources and Crop Evolution,1997,44: 315-326.
[5]陈 光,杜雄明.我国陆地棉基础种质表型性状的遗传多样性分析[J].西北植物学报,2006,26(8):1649-1656.
[6]周宁宁,唐开学,邱显钦,等.云南峨眉蔷薇天然群体的表型多样性[J].西南农业学报,2009,22(6):1732-1736.
[7]陈 玲,张 颢,邱显钦,等.云南木香花天然居群的表型多样性研究[J].云南大学学报,2010,32(2):243-248.
[8]张彩霞,明 军,刘 春,等.岷江百合天然群体的表型多样性[J].园艺学报,2008,35(8):1183-1188.
[9]李文英,顾万春.蒙古栎天然群体表型多样性研究[J].林业科学,2005,41(1):49-56.
[10]罗建勋,左 林.云杉人工林材性变异的初步研究[J].西北农林科技大学学报,2001,29(3):29-34.
[11]罗建勋,李晓清,孙 鹏,等.云杉天然群体表型变异研究[J].东北林业大学学报,2003,31(1):9-11.
[12]罗建勋,顾万春.云杉表型与同工酶遗传多样性研究进展[J].林业科学研究,2004,17(2):255-262.
[13]STICH B,HAUSSMANN B IG,PASAM R,et al.Patterns of molecular and phenotypic diversity in pearl millet〔Pennisetum glaucum(L.)R.Br.〕from West and Central Africa and their relation to geographical and environmental parameters[J].BMC Plant Biology,2010,10:216-225.
[14]CHRISTINE S J,MONICA A G.Variation among populations of Clarkia unguiculata(Onagraceae)along altitudinal and latitudinal gradients[J].American Journal of Botany,1999,86(3):333-343.
[15]中国科学院中国植物志编辑委员会.中国植物志:第十七卷[M].北京:科学出版社,1997:42.
[16]浙江植物志编委会.浙江植物志:第七卷[M].杭州:浙江科学技术出版社,1993:490.
[17]刘 芬,田 敏,王彩霞,等.扇脉杓兰果实生长动态及胚胎发育过程观察[J].植物资源与环境学报,2012,21(1):28-35.
[18]孙海琴.独花兰和扇脉杓兰的传粉生态学[D].北京:中国科学院植物研究所,2005:54-75.
[19]杨 继.植物种内形态变异的机制及其研究方法[J].武汉植物学研究,1991,9(2):185-195.
[20]辜云杰,罗建勋,吴远伟,等.川西云杉天然种群表型多样性[J].植物生态学报,2009,33(2):291-301.
[21]佘诚棋,杨万霞,方升佐,等.青钱柳天然群体种子性状表型多样性[J].应用生态学报,2009,20(10):2351-2356.
[22]王 丹,庞春华,高亚卉,等.茶条槭不同海拔种群的表型多样性[J].云南植物研究,2010,32(2):117-125.
[23]刘玉皎,宗绪晓.青海蚕豆种质资源形态多样性分析[J].植物遗传资源学报,2008,9(1):79-83.
[24]张礼凤,李 伟,王彩洁,等.山东大豆种质资源形态多样性分析[J].植物遗传资源学报,2006,7(4):450-454.
