Survivin启动子驱动LRIG1基因表达的重组腺病毒对人膀胱癌细胞BIU87生长的影响
2012-12-31严泽军蒋军辉胡嘉盛施小东黄坚成
严泽军,程 跃,蒋军辉,胡嘉盛,施小东,黄坚成
肿瘤靶向性基因治疗是当今医学研究的热点之一,其基本原理是将具有组织特异性的启动子序列与抑癌基因整合,通过该启动子,使抑癌基因只在特定的组织细胞中表达,从而提高肿瘤治疗的靶向特异性,减少或避免治疗过程中对正常组织细胞造成损害。为了解决基因治疗的靶向性,本课题组构建了的含有Survivin启动子和富含亮氨酸重复和免疫球蛋白样结构域1(tandem leucine-rich repeats and immunoglobulin-like domains 1,LRIG1)基因的重组腺病毒载体Ad-Surp-LRIGl,检测了其对人膀胱癌BIU87细胞生长的影响,证实该载体具有良好的靶向性。
1 材料与方法
1.1 主要试剂和材料 RPMI-1640(Sigma公司),胎牛血清(杭州四季青公司),质粒提取纯化试剂盒、琼脂糖凝胶回收试剂盒(Promega公司),各种限制性内切酶、T4 DNA连接酶(Takara公司),Lipofectamine2000(Invitrogen公司),含有5型腺病毒的骨架质粒Pbhge3(Microbix Biosystems公司)均购自武汉古泰生物公司。含LRIG1基因的质粒pLRIGl-GFP由瑞典Umea大学的Hedman教授惠赠,含Survivin启动子的pSurp-EGFP质粒和感受态大肠杆菌DH5α由本实验室制备。PCR引物合成和测序由上海博亚生物技术有限公司完成。含LRIG1基因的重组腺病毒载体AD-LRIG1由本课题组前期构建[1],用作对照组。
1.2 细胞株及细胞培养 人膀胱癌细胞株BIU87(北京大学泌尿外科研究所),人胚肾293细胞(HEK293)、人膀胱上皮永生化细胞SV-HUC-1(美国典型物保藏中心)分别培养于含10%胎牛血清、青霉素100U/mL及链霉素100μg/mL的RPMI-1640培养液中,细胞在相对湿度为95%、37℃、5%CO2的环境中单层生长,每3d换液传代1次,取对数生长期细胞用于实验。
1.3 pEGFP-Surp-LRIGl的构建 用KpnⅠ单酶切包含Survivin启动子的pSurp-EGFP质粒,回收线性化质粒片断,T4DNA聚合酶平两端,再用NheⅠ酶切,回收大小为440bp的目的片断(即Survivin启动子)待用。用EcoRⅠ单酶切pLRIGl-GFP后回收线性化质粒片断,T4DNA聚合酶填平两端后,再用NheⅠ酶切,回收整个线性化质粒片断(即自多克隆酶切位点切除了38bp的pLRIGl-GFP,大小约8.7kb)。将以上两片段用T4DNA连接酶连接,连接产物转化感受态大肠杆菌DH5α,挑取克隆,抽提质粒DNA。再用EcoRⅠ和NheⅠ酶双酶切鉴定,能切出440bp的Survivin启动子片段,将酶切鉴定正确的阳性克隆命名为pEGFP-Surp-LRIGl。
1.4 重组腺病毒载体的构建和鉴定 将质粒pEGFP-Surp-LRIGl与含有5型腺病毒右臂的质粒Pbhge3通过Lipofectamine 2000共转染至293细胞(操作按说明书进行),待出现病毒空斑,经过3次病毒空斑纯化,用病毒DNA提取试剂盒提取腺病毒DNA,用LRIG1引物和Survivin引物做PCR鉴定,LRIG1的引物设计及反应条件参照本课题组的前期报道[2],Survivin的设计引物为上游:5′-CTGGTACCGCAATGGCACAAT-3′;下游5′-GTGCTAGCCGCACGCCCTCTT-3′;片段长度440bp,反应体系为50μL,反应条件为:95℃预变性5min;94℃变性60s,58℃退火30s,72℃延伸60s,30个循环;72℃延伸7min。经鉴定正确的腺病毒命名为Ad-Surp-LRIGl,即Survivin启动子调控的携带LRIG1基因的复制缺陷型腺病毒。
1.5 重组腺病毒的扩增、纯化和滴度测定 取0.5μL首次扩增的病毒保存液于5×106个HEK293细胞在37℃、5%CO2培养箱中孵育72h,收集细胞,反复冻融3次,离心,收集上清反复扩增至需要的病毒量。氯化铯梯度离心纯化病毒,以50%细胞培养物感染量(50%tissue culture infective dose,TCID50)法测定病毒滴度。
1.6 重组腺病毒转染率的测定 将Ad-Surp-LRIGl和AD-LRIG1分别转染BIU87细胞和SV-HUC-1细胞,参照文献进行培养[3],计算病毒转染效率。
1.7 重组腺病毒Ad-Surp-LRIGl的体外抑瘤实验消化、收集处于对数生长期的BIU87细胞,并调成浓度为1×103/mL的单细胞悬液,接种于用96孔培养板中,每孔150μL,于37℃,5%CO2孵箱中培养24h,待细胞贴壁。分为3组,Ad-Surp-LRIGl组、AD-LRIG1组、PBS组,每组设21个复孔,各组分别加入上述重组腺病毒(MOI=25),每天各组取3孔用MTT比色法[4]进行检测。参照波长630nm,检测波长570nm,根据测定的A值绘制细胞生长曲线。
1.8 统计学方法 采用SPSS11.5软件处理数据。计量资料采用±s)表示,计数资料用率表示。组间计量资料比较采用成组设计的t检验,率的比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 pEGFP-Surp-LRIGl的酶切鉴定 用EcoRⅠ和NheⅠ双酶切pEGPF-Surp-LRIGl后,显示440bp和8.7kb两条带;用BamHⅠ和NheⅠ双酶切pEGPF-Surp-LRIGl后,显示4.44kb和4.7kb两条带(见图1)。酶切结果均与理论推算值一致。
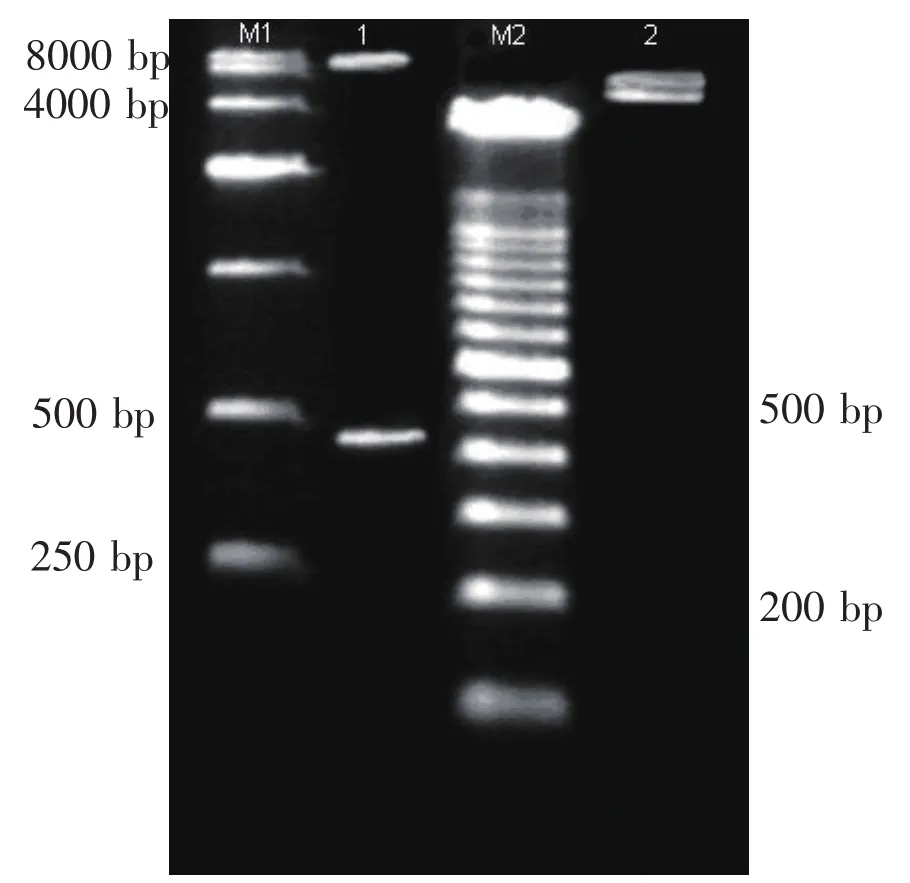
图1 pEGFP-Surp-LRIGl的酶切鉴定
2.2 Ad-Surp-LRIGl病毒的鉴定 用LRIG1引物和Survivin的上下游引物做PCR鉴定,分别扩增出892bp的LRIG1和440bp的Survivin条带,说明重组腺病毒中带有Survivin启动子及LRIG基因片段(见图2)。
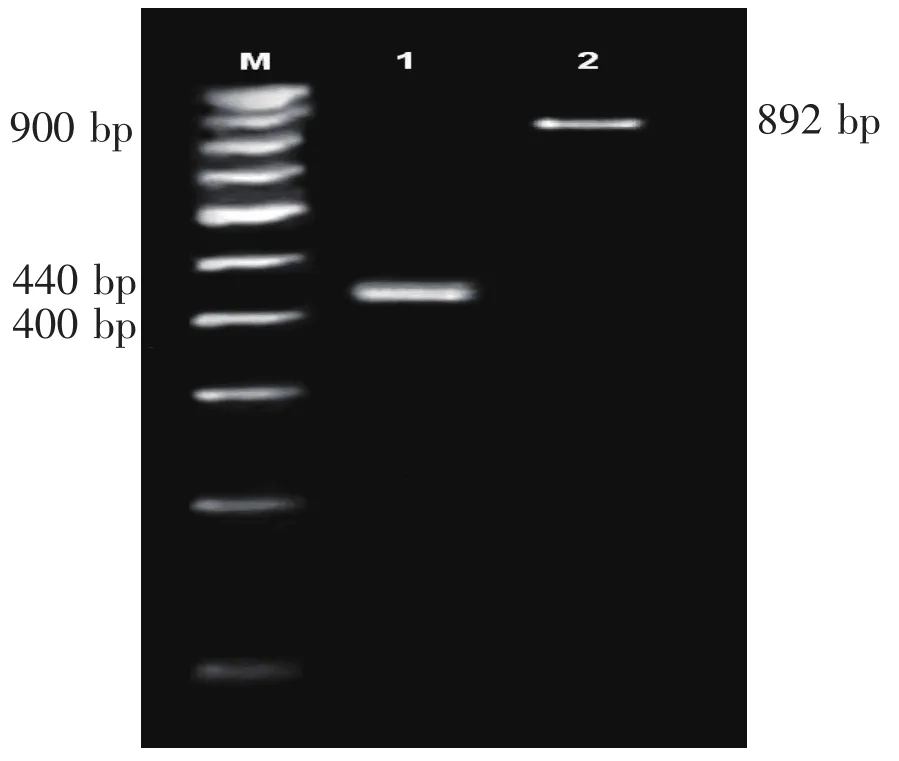
图2 Ad-Surp-LRIGl病毒的鉴定
2.3 重组腺病毒的扩增、纯化和滴度测定 将Ad-Surp-LRIGl和Ad-LRIG分别转染HEK-293细胞,荧光显微镜下观察可见绿色荧光蛋白显著表达,证实转染成功。Ad-Surp-LRIGl病毒滴度为1.4×1010pfu/mL,Ad-LRIG1病毒滴度为1.7×1011pfu/mL。
2.4 重组腺病毒转染率的测定 倒置荧光显微镜下观察显示,加入重组腺病毒Ad-Surp-LRIGl和Ad-LRIG1后12h,倒置荧光显微镜下即可观察到绿色荧光的BIU87细胞。2d后镜下观察,当MOI=25时,Ad-Surp-LRIGl在BIU87细胞中的转染效率为74.56%,在SV-HUC-1细胞中无表达,转染率为0,差异有统计学意义(χ2=58.64,P<0.05)。Ad-LRIGl在BIU87细胞中的转染效率为68.27%,在SV-HUC-1细胞中转染率为72.52%,差异无统计学意义(χ2=0.075,P>0.05)。Ad-Surp-LRIGl和Ad-LRIGl在BIU87细胞中的转染效率相比,差异无统计学意义(χ2=0.016,P>0.05)。
2.5 重组腺病毒对BIU87细胞生长抑制作用 常规培养1d,PBS组的细胞A值即开始超过Ad-Surp-LRIGl组和Ad-LRIGl组细胞A值,随着时间的延长,这一差异逐步增大,第4d时这一差异显著(F=15.96,P<0.05)。提示转染了LRIG1基因的BIU87细胞生长速度比PBS组的BIU87细胞生长速度慢,而Ad-Surp-LRIGl组和Ad-LRIGl组细胞生长速度无明显差异(图3)。
3 讨论
重组腺病毒载体因能广泛转染宿主细胞而在肿瘤的基因治疗中被运用,但由于其转染细胞没有特异性,除了能在肿瘤细胞中表达目的基因产物外,还会在正常细胞中表达这些产物,从而带来某些潜在的毒副作用。而病毒在体内的复制本身就会对正常细胞产生影响[5]。因此,如何调控重组腺病毒载体在肿瘤细胞中特异性复制并表达目的基因产物,最大限度地避免治疗的副作用,是目前基因治疗研究的热点[6]。
Survivin基因是一种抗凋亡基因,其表达产物Survivin蛋白在包括膀胱癌在内的许多肿瘤内大量表达,而在正常组织中则不表达[7]。Survivin基因中含有多转录起始位点,该位点内的Survivin启动子可以在转录水平调控Survivin基因的表达。研究发现,在肿瘤细胞内某些因子上调了Survivin启动子活性,启动了Survivin基因的表达,从而造成肿瘤细胞和正常细胞内Survivin蛋白的表达差异[8]。因此,将Survivin启动子用于表达载体中调控目的基因的表达时,只会在肿瘤细胞内特异性表达目的基因产物,从而起到增强基因治疗特异性及降低其毒副反应的效果。而将Survivin启动子克隆至腺病毒载体上取代其原有启动子时,由于Survivin启动子也同时调控了病毒本身结构基因的表达,因而这种重组腺病毒仅能在Survivin阳性细胞内复制,即为“条件复制型腺病毒”,从而避免了腺病毒复制对正常细胞的影响。
LRIG1属于LRIGs基因家族。LRIGs是新近发现的一类基因,在哺乳动物体内广泛存在,已经发现该家族至少包括三个成员:LRIG1、LRIG2和LRIG3。它们的编码产物为一类结构相似的胞外段有多个亮氨酸重复序列和Ig样结构域的跨膜糖蛋白。人、鼠的LRIGs基因和蛋白具有广泛同源性。Gur等[9]研究发现,LRIG1除了通过其胞外段直接与表皮生长因子受体(epidermal growth factor receptor,EGFR)结合,抑制EGF同EGFR结合之外,还能够增加EGFR对泛素化配体C-cbl的募集和结合,导致EGFR降解,从而进一步起到阻断信号转导、加快细胞凋亡的作用。EGFR是一种跨膜酪氨酸蛋白激酶生长因子受体,与人类肿瘤关系密切,其表达在包括膀胱癌在内的多种肿瘤中有明显增高[10]。在多种肿瘤组织中,存在着LRIG1表达下调或消失以及EGFR/LRIG1比例上升的情况。此外,LRIG1基因定位于人染色体3p14.3,而这个位点正是多种抑癌基因缺失的好发部位。我们的前期研究显示[11-12],人膀胱癌细胞系BIU87转染野生型LRIG1基因后,细胞的增殖、运动和侵袭能力受到明显抑制。因此可以推测,构建携带有Survivin启动子和抑癌基因LIRG1的重组条件复制型腺病毒,不仅能够在肿瘤细胞内特异性表达目的基因产物,起到杀伤肿瘤细胞的目的,还不会对正常细胞造成不良影响,尽可能避免目前基因治疗的很多副反应。本研究显示,Ad-Surp-LRIGl和Ad-LRIGl在体外均能明显抑制BIU87细胞的生长。Ad-LRIGl在膀胱癌细胞BIU87和人膀胱上皮永生化细胞SV-HUC-1均有表达,而Ad-Surp-LRIGl只在BIU87细胞中表达,在SV-HUC-1中不表达,表明Ad-Surp-LRIGl具有肿瘤特异性。

图3 MTT法检测BIU87细胞转染重组病毒后的生长曲线
本实验成功构建了Survivin启动子驱动LRIG1基因表达的重组腺病毒Ad-Surp-LRIGl,由于Survivin启动子只在表达Survivin蛋白的肿瘤细胞中调控基因的表达,所以可以利用其驱动治疗基因特异地表达,实现肿瘤的基因治疗,最大限度地降低基因治疗可能存在的副作用。
[1]李凡,杨为民,叶章群.腺病毒介导LRIG1过表达联合顺铂对膀胱癌细胞株EJ的抑制作用[J].中华实验外科杂志,2010,27:1805-1808.
[2]叶章群,严泽军,杨为民,等.LRIG1基因对膀胱癌细胞侵袭力的影响[J].中华外科杂志,2007,45(4):258-261.
[3]王亚轩,蔡文清,黎玮,等.人端粒酶逆转录酶启动子调控腺病毒介导的胸苷激酶基因治疗膀胱癌的实验研究[J].中华实验外科杂志,2005,26(4):229-232.
[4]司徒镇强,吴军正.细胞培养[M].西安:世界图书出版公司,2004:250-252.
[5]Cafferata EG.,Macció DR,Lopez MV,et al.A novel A33 Promot⁃er-Based conditionally replicative adenovirus suppresses tumor growth and eradicates hepatic metastases in human colon cancer models[J].Clin Cancer Res,2009,15(5):3037-3049.
[6]Seth P.Gene therapy for cancer[J].JAMA,2008,299(3):1367-1368.
[7]Fukuda S,Pelus LM.Survivin,a cancer target with an emerging role in normal adult tissues[J].Mol Cancer Ther,2006,5(5):1087-1098.
[8]Konopka K,Spain C,Yen A,et al.Correlation between the levels of Survivin and Survivin promoter-driven gene expression in can⁃cer and non-cancer cells[J].Cell Mol Biol Lett,2009,14(1):70-89.
[9]Gur G,Cubin C,Katz M,et al.LRIG1 restricts growth factor sig⁃naling by enhancing receptor ubiquitylation and degradation[J].The EMBO Journal,2004,23(7):3270-3281.
[10]Villares G,Zigler M,Blehm K,et al.Targeting EGFR in bladder cancer[J].World J Urol,2007,25(6):573-579.
[11]杨为民,严泽军,叶章群,等.抑癌基因LRIG1对膀胱癌细胞BIU87生物学特性的影响[J].中华实验外科杂志,2005,22(12):1543-1545.
[12]Weimin Yang,Zejun Yan,Zhangqun Ye,et al.LRIG1,a candi⁃date tumour-suppressor gene in human bladder cancer cell line BIU87[J].BJU Int.2006,98(4):898-902.
