芙蓉菊组培快繁技术的研究
2012-12-29陈雪鹃李雪珂张启翔
陈雪鹃 ,吴 珏 ,李雪珂 ,孙 明,3,张启翔 ,3
芙蓉菊组培快繁技术的研究
陈雪鹃1,吴 珏2,李雪珂1,孙 明1,3,张启翔1,3
(1.北京林业大学 园林学院,北京100083;2.无锡鸿源景观建设有限公司,江苏 无锡214000;3.国家花卉工程中心,北京100083)
以芙蓉菊Crossostephium chinense带腋芽的茎段和叶柄为外植体进行组织培养。结果表明,带腋芽的茎段是较好的组培外植体。最佳灭菌时间为:茎段75﹪酒精20 s,0.1﹪ HgCl22 min;叶柄75﹪酒精20 s,0.1﹪ HgCl21 min。最适宜的初代培养基为:茎段MS+0.1 mg/L NAA+2.0 mg/L 6-BA,愈伤组织诱导率可达80.6﹪,叶柄MS+1.0 mg/L NAA+2.0 mg/L 6-BA,愈伤组织诱导率可达83.3﹪。继代培养以茎段为外植体,MS+0.2 mg/L NAA+2.0 mg/L 6-BA培养基的增值系数最高。继代苗在MS培养基中生根率为80.6﹪,1/2MS培养基中生根率为86.1﹪。
芙蓉菊;组织培养;快繁技术; 茎段
菊花Chrysanthemum morifolium是中国传统名花之一,也是世界四大切花之一。我国是栽培菊花的起源中心和菊属种质资源的分布中心。菊属共有40余种,其中,在我国分布的就有20余种,栽培菊花品种达3 000余个[1]。近年来,随着世界花卉产业的发展,通过扦插、嫁接等传统的繁殖方法已不能满足市场的需要,而新近发展起来的遗传转化技术显示了其独特的优越性。它可定向修饰菊花的某些目标性状并保留原有性状,使其在花色、花期、抗病虫、抗逆性等方面发挥重要作用。而成功的基因转化首先依赖于良好的菊花再生体系的建立,要求一定的再生频率和分化率,同时还需具有稳定性和重复性。 组织培养不仅繁殖系数高、繁殖速度快,而且还可进行品种的脱毒复壮、种质资源保存等[2-5]。
芙蓉菊Crossostephium chinense,又称玉芙蓉、蕲艾、千年艾、香菊,为菊科芙蓉菊属Crossostephium常绿亚灌木,产于我国中南及东南部(广东、台湾)。芙蓉菊叶聚生枝顶,狭匙形或狭倒披针形,两面密被灰色短柔毛,具芳香,头状花序黄色,花果期全年[6]。自古以来,芙蓉菊因其具有广泛的药用价值而在广东民间广泛栽培,前人的研究也集中于探讨其基础栽培和其药用价值[7-9]。由于芙蓉菊具有耐热、耐旱、耐盐碱、耐瘠薄、抗风性强等特性,而且叶片呈灰白色,整体株型紧凑,近年来已经开始推广作为城市绿化材料和耐盐观赏灌木。既可应用于城市花坛或花径观叶,又可在沿海绿地作为地被植物片植,市场潜力巨大。而芙蓉菊为亚灌木,采用传统的扦插繁殖方法生长缓慢,无法满足市场需求。前人虽然已经对菊科部分植物进行过相应的组培研究,但并无芙蓉菊的相关报道。为此,本文对芙蓉菊的组培快繁技术进行研究,以期为其资源的进一步开发和利用奠定基础。
1 材料与方法
1.1 材 料
芙蓉菊引自上海,由于其不耐寒冷,在北京地区无法露地越冬,故采用温室盆栽管理。植株保存于北京国家花卉工程中心基地,于3~4月,在温室盆栽苗中选取生长旺盛、健壮的植株,取中上部带腋芽茎段和叶柄为外植体。
1.2 方 法
1.2.1 不同灭菌时间对灭菌效果的影响
外植体的预处理及接种方法 ①茎段:将茎段完全除叶(叶片密被柔毛,易污染),洗洁精溶液浸泡20分钟以上,用软毛刷轻轻刷洗表面,再用流水冲洗3~4 h。②叶柄:剪取充分展开的中上部幼嫩叶片的叶柄,约带2 mm×2 mm叶片,自来水洗净后流水冲洗3~4 h。将外植体预于超净工作台上,75﹪的酒精处理20 s,无菌水冲洗3次后,再用0.1﹪氯化汞溶液处理,处理时间分别设 置1 min,2 min,3 min,5 min,之后再用无菌水冲洗5次。用无菌滤纸吸干多余水分后,茎段和叶柄均去除直接与酒精和氯化汞接触的伤口部分,将茎段和叶柄剪成1 cm长,接种于培养基上,每个处理接种10个外植体,3次重复,2周后统计成活率和污染率,从中选出最佳灭菌时间。
计算方法:污染率=污染的外植体数/接种外植体数×100﹪;
存活率=正常生长的外植体数/接种外植体数×100﹪。
1.2.2 不同培养基对芙蓉菊初代培养的影响
目前,在菊花组织培养中应用的培养基有MS、B5、H、Monnior等,但应用最为广泛的还是MS培养基,或是在此基础上进行改动。由于芙蓉菊属于亚灌木,因此,本实验在前人研究的基础上,参考诱导亚菊茎段侧芽生长的最佳培养基MS+6-BA 2.5 mg/L+NAA 0.1 mg/L[10],利用茎段和叶柄为外植体,对细胞分裂素6-BA和生长素NAA的浓度进行筛选。培养基附加琼脂0.6﹪,蔗糖3﹪,肌醇0.1﹪,灭菌前用1 mol/L HCl或者NaOH调节pH值至6.0。每处理接种12个外植体,3次重复。从接种4天后开始观察,每隔3天观察一次,观察不同外植体的愈伤和生长情况。30 d后将未污染的茎段和叶柄转接,并统计其愈伤率,从中选出最适宜的初代培养基。具体培养基配方如表1所示。
计算方法:诱导愈伤率=诱导愈伤的外植体数/接种外植体数×100﹪;
褐化率=褐化的外植体数/接种外植体数×100﹪。
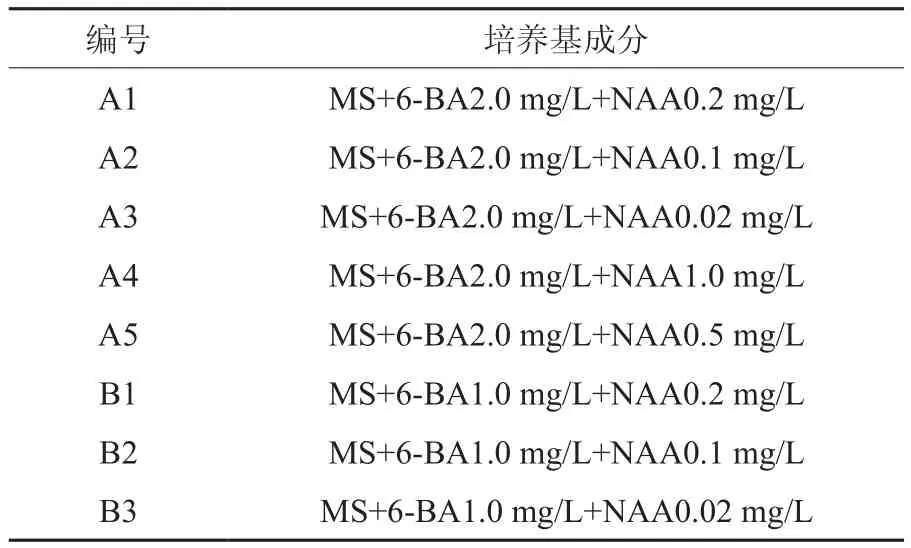
表1 芙蓉菊初代培养培养基Table 1 Mediums for initial culture of Crossostephium chinese
1.2.3 不同培养基对芙蓉菊继代培养的影响
与初代培养相同,菊科植物继代培养大多采用MS为基本培养基。通常,最优化的增殖体系不但要求有较高的增殖率,而且还要有健壮的形态颜色及方便于转接所需的节间长度。
菊花增殖的基本培养基一般为MS培养基,再添加不同浓度的生长素和细胞分裂素即可。不同的BA与NAA浓度对不定芽的生长及分化数量有影响:BA浓度过高及NAA浓度太低,形成的试管苗太细弱;NAA浓度过高则愈伤组织生长快,分化芽的数量降低。一般认为在MS+BA 0.5~2.0 mg/L+NAA 0.01~0.2 mg/L的培养基上增殖效果较好[11]。亚菊的芽增殖以MS+6-BA1.5 mg/L+NAA 0.3 mg/L为最好,BA含量低于1.5 mg/L芽的增殖率随之递减,高于此含量则将逐渐产生不良反应,直到最后产生玻璃化苗[10]。本实验采用茎段为外植体,以MS为基本培养基,由2种不同浓度的6-BA和5种不同浓度的NAA配成8种不同的培养基,从中选出最适合芙蓉菊丛生芽增殖的培养基配方。每处理接种12个外植体,3次重复。从接种4天后开始观察,每隔10天观察一次生长情况。30 d后统计增殖芽数,从中选出最适宜的继代培养基。具体培养基配方如表2所示。
计算方法:丛生芽增殖系数=丛生芽数/接种外植体数×100﹪。
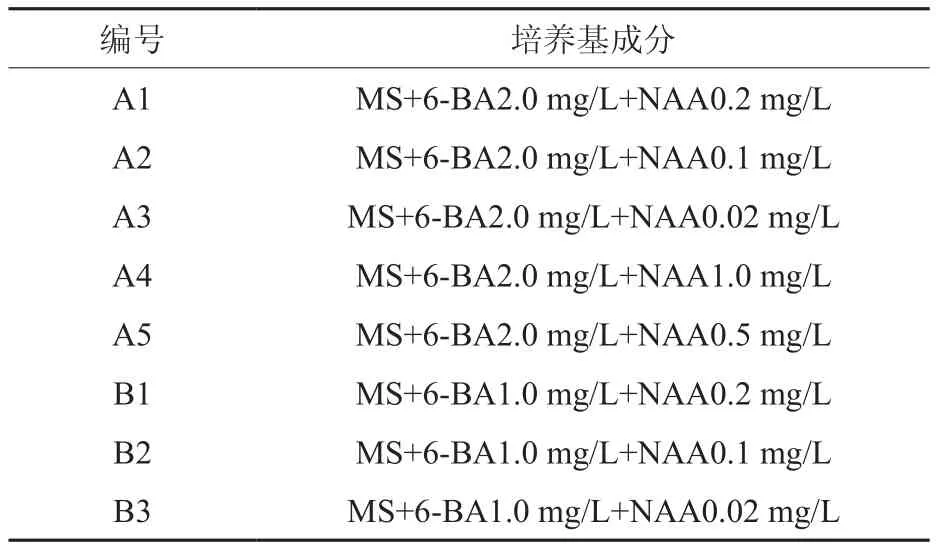
表2 芙蓉菊继代培养培养基Table 2 Mediums for subculture of Crossostephium chinense
1.2.4 不同培养基对芙蓉菊生根的影响
前人研究多认为菊科植物试管苗的生根比较容易,有时在增殖培养中就会发生生根现象。生根培养基大多为1/2 MS培养基,不加激素或加少量生长素(IBA或NAA:0~0.1 mg/L)就可生根,且生根条数多,生长速度快[2]。
本实验在芙蓉菊继代培养后期,停止添加激素,转接入MS基本培养基和1/2MS培养基。每处理接种12株,3次重复。从接种4天后开始观察,每隔10天观察一次生长情况。30 d后统计生根率。
计算方法:生根率=生根的外植体数/接种外植体数×100﹪。
1.3 培养条件
组织培养室温度(24±2) ℃,光照时间12 h/d,光照强度3 600 lx。
2 结果与分析
2.1 不同灭菌时间对灭菌效果的影响
实验前期已经摸索过芙蓉菊基本灭菌时间范围,分别设置酒精处理20 s,升汞(0.1﹪氯化汞)处理3 min、5 min和7 min。结果表明,升汞灭菌7 min时外植体全部死亡;5 min时无污染,但有大量外植体死亡;3 min时有个别外植体出现污染,但无死亡现象,因此,设置4个灭菌时间处理,结果见表3和图1。
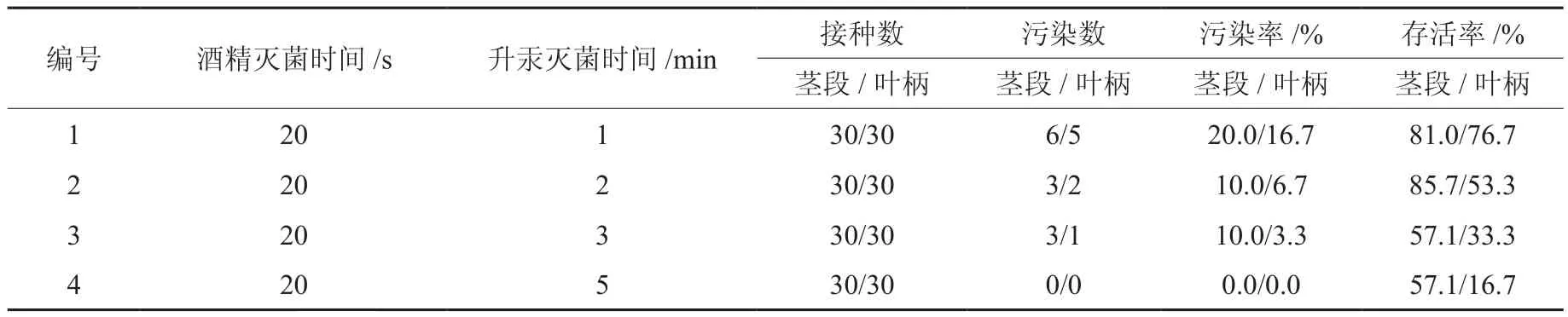
表3 灭菌时间对外植体灭菌效果的影响Table 3 Effects of different disinfection time on sterilization of explants
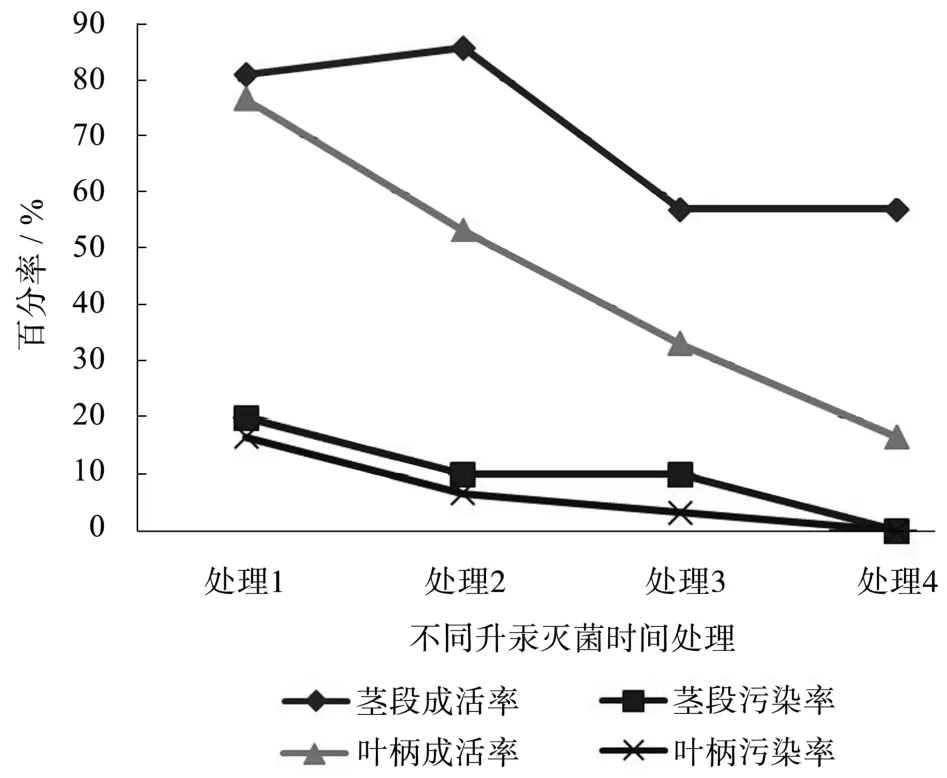
图1 灭菌时间对外植体灭菌效果的影响Fig .1 Effects of different disinfection time on sterilization of explants
由表3和图1可知,随着灭菌时间的延长,外植体污染率逐渐下降,但外植体的伤害也逐渐加大,无菌苗获得率低。当用茎段作外植体时,升汞灭菌时间为1 min时,污染率最大,为20﹪,但外植体损伤较弱,外植体没有出现由于灭菌时间过长而出现的死亡现象,长势好;当升汞灭菌时间为2 min时,污染率较小,外植体长势好,基本无死亡现象,外植体存活率最大;当升汞灭菌时间为3 min时,污染率较小,但外植体长势不如前两种,成活率也低;当升汞灭菌时间达到5 min时,基本已无污染产生,但长势差,外植体损伤大,存活率最低。而叶柄作为外植体时,升汞灭菌1 min即可,此时成活率较高,增加升汞灭菌时间,则成活率急剧下降,不利于外植体培养。由此可见,灭菌时间对芙蓉菊存活率和长势影响大,因此,在降低污染率的前提条件下,尽量的减少灭菌时间,以避免的外植体的死亡。综上所述,以芙蓉菊的茎段为外植体时,对其进行75﹪的酒精20 s和0.1﹪的升汞2 min进行灭菌;以叶柄为外植体时,用75﹪酒精20 s和0.1﹪升汞1 min处理可获得较为理想的结果。
2.2 不同培养基对芙蓉菊初代培养的影响
通常较大的草本植物以采取茎段较适宜,能在培养基的帮助下萌发出侧芽,成为进一步繁殖的材料。在快速繁殖中,重要的是选择最幼态的组织或器官,而且这些组织或器官能够尽快诱导形态发生,避免过长的愈伤组织阶段,这是实现快速繁殖的关键[12]。菊花中也常见用叶柄作为外植体进行组织培养[13-14],因此本实验同时采用茎段和叶柄作为外植体筛选合适的初代培养基。
2.2.1 茎段的愈伤
茎段接种后经过30 d的生长,根据观察情况统计其愈伤情况,得到数据如表4所示。

表4 不同激素浓度配比对芙蓉菊茎段愈伤的影响Table 4 Effects of different mediums on stem callus for initial culture of C. chinense
由表4可见,A2培养基的愈伤率最高,而B3最低。A组培养基的愈伤诱导率总体好于B组,可见当6-BA浓度为2.0 mg/L时,芙蓉菊的茎段更易诱导出愈伤。当6-BA浓度为2.0 mg/L,随着NAA浓度的升高,茎段的愈伤诱导率大体呈现先升后降的趋势,NAA浓度为0.1 mg/L时,茎段的愈伤诱导率达到最高,为80.6﹪,愈伤生长状况好,很快分化出丛生芽。而当6-BA浓度为1.0 mg/L,NAA浓度为0.02 mg/L时,茎段的愈伤率最低,为52.8﹪,生长状况差,丛生芽分化率低。
综合愈伤率和愈伤生长情况,A2培养基是最适合的茎段初代培养基。
2.2.2 叶柄的愈伤
对表4中的8种培养基进行了筛选,选择了其中6种作为叶柄的初代培养培养基。叶柄接种后经过30 d的生长,统计其愈伤情况(见表5)。
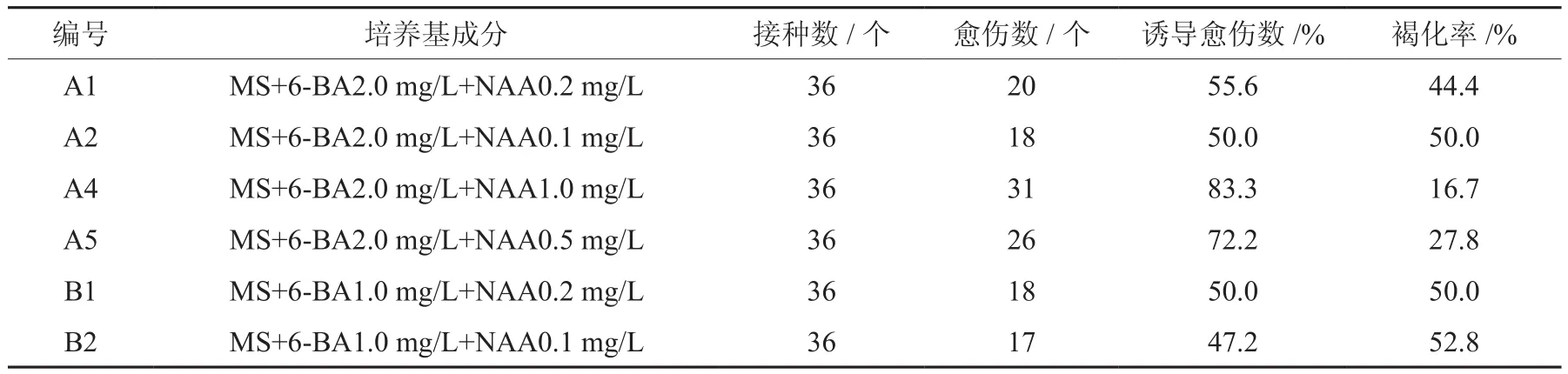
表5 不同激素浓度配比对芙蓉菊叶柄愈伤的影响Table 5 Effects of different mediums on petioles callus for initial culture of C. chinense
由表5可知,不同培养基对叶柄初代培养影响很大,A4培养基的愈伤率最高为83.3﹪,而B2培养基的愈伤诱导率最低,为47.2﹪。A组培养基明显好于B组,即6-BA浓度为2.0 mg/L更适合叶柄的愈伤诱导和生长。当6-BA浓度为2.0 mg/L时,随着NAA浓度的升高,叶柄的愈伤率也随之提高,当NAA浓度达到1.0 mg/L时,愈伤率也达到最高。
总体而言,A组培养基相较于B组来说,更适合叶柄的愈伤培养,其中A4培养基是最适合的叶柄初代培养基。
2.3 不同培养基对芙蓉菊继代培养的影响
通过初代培养,芙蓉菊茎段和叶柄都获得了较高愈伤诱导率,但叶柄产生的愈伤组织无法分化出芽,因此选用茎段愈伤组织作为继代培养筛选材料。初代培养基上的茎段诱导出的愈伤经过30 d的生长,分化出新的芽点,将其接种到继代培养基上,再经过30 d生长,观察记录计算出各种培养基上丛生芽的增殖芽数(见表6)。

表6 不同激素浓度配比对芙蓉菊增殖培养的影响Table 6 Effects of different subculture MS mediums on multiplication culture of C. chinense
可以明显看出,A1培养基的丛生芽增值系数最大,B3培养基的丛生芽系数最小,A组的丛生芽增殖系数总体高于B组。而从生长状况来看,A组生长情况好于B组(见封三图3)。同时,在筛选具有较高增殖系数的培养基过程中,考虑到所增殖的不定芽的质量,A1培养基中丛生芽的生长状况最好。
2.4 不同培养基对芙蓉菊生根的影响
增殖试管苗进行生根生长,转接30 d后统计生根率(见表7)。

表7 MS和1/2MS培养基对芙蓉菊生根的影响Table 7 Effects of MS and 1/2 MS mediums on rooting rate of buds of C. chinense
增值试管苗在MS和1/2MS中生长状况良好,生根率都较高,其中1/2MS培养基生根率为86.1﹪,略高于MS培养基(80.6﹪)。
3 结论与讨论
菊科很多植物体表都具有绒毛,极大的影响其作为外植体时的灭菌效果。灭菌时间过短,则外植体污染较为严重;灭菌时间过长,则易对外植体造成较大伤害,致使外植体褐化死亡。因此,在建立无菌体系时,根据所选择的外植体类型不同,需选用不同的灭菌时间。实验结果显示表明:芙蓉菊茎段所需升汞的灭菌时间比叶柄略长,用75﹪的酒精20 s和0.1﹪的升汞2 min对茎段进行灭菌处理效果较好,而用75﹪酒精20 s和0.1﹪升汞1 min处理叶柄时可获得较为理想的结果。
由于同一植物的不同组织和器官,其再生能力有很大差距,并非所有的部位都能顺利分化出芽。因此,在组织培养实验中选择合适的外植体类型是实验成功的重要条件之一。本实验在芙蓉菊植株上选择了菊花组培中常用的茎段和叶柄作为外植体进行初代培养,两者均能获得较高的愈伤诱导率。但是,由叶柄获得的愈伤组织经过30~40 d的生长,无法分化出芽,不利于下一步的继代培养;而茎段获得的愈伤组织在生长30 d左右即可顺利分化产生丛生芽。因此,芙蓉菊应选用植株中上部较为幼嫩的茎段为其最佳外植体。
激素是诱导分化的关键物质,对组织培养的成败起着决定性的作用。不加任何激素时,芙蓉菊茎段作为外植体虽然可以分化,但是增殖系数较低,出芽后长势很弱,在生产中无明显应用价值。而在培养基中添加激素后,明显提高了茎段的增殖率。实验结果表明,在一定范围内提高6-BA的浓度,可以有效提高茎段的增殖系数。
在芙蓉菊的生根培养中,将其继代苗转接入MS培养基和常用的1/2MS培养基中进行生根培养。结果表明,在MS和1/2MS培养基中,芙蓉菊均有较高的生根率,其中1/2MS培养基中生根率达到86.1﹪。
[1] 吴月亮,蒋细旺,孙 磊,等. 菊花2个品种高效再生体系的建立[J].西南林学院学报, 2007,27(2):50-52.
[2] 王丽华,王永清,陈文德,彭培好.菊花组织培养技术体系研究[J].安徽农业科学,2005,33(8):1416-1417.
[3] 陈俊愉.园林植物品种分类学[M]. 北京:高等教育出版社,2001.219-231.
[4] 蒋细旺,刘国峰,包满珠.菊花9个品种叶片和茎段快速高效再生体系的建立[J].华中农业大学学报, 2003,22(2):162-166.
[5] 陆 苗,蒋细旺,张启祥.地被菊不同基因型品种的再生研究[J].北方园艺,2008,(1):173-175.
[6] 中国科学院中国植物志编辑委员会. 中国植物志[M]. 1991,76(2):113.
[7] 黄有军, 夏国华,郑炳松,等. 芙蓉菊盐胁迫下的生长表现和生理响应[J]. 江西农业大学学报,2007,29(3):389-408.
[8] 黄泰康.现代本草纲目(下)[M].北京:中国医药出版社,2002:1981.
[9] 杨秀伟,吴 琦,邹 磊,等. 芙蓉菊中艾菊素和草蒿素结构的NMR信号表征[J].波谱学杂志,2008,25(1):117-127.
[10] 梅 忠.亚菊组织培养技术研究[J].北方园艺, 2009,(11):187-188.
[11] 刘青林,郑玉梅.花卉组织培养[M].北京:中国农业出版社,2003:89-95.
[12] 程广有.名优花卉组织培养技术[M].北京:科学技术文献出版社,2003.
[13] 陈玉华,吴坤林,陈之林,等. 影响非洲菊叶柄离体培养再生的因素[J].福建林业科技, 2006,(4):166-168.
[14] 冯 强,刘 宁,王 暾,等.不同自然光环境下土庄绣线菌的生理生态响应[J].中南林业科技大学学报,2010,30(9):27-31.
Study on techniques of fast multiplication for the tissue culture of Crossostephium chinense
CHEN Xue-juan1, WU Jue2, LI Xue-ke1, SUN Ming1,3, ZHANG Qi-xiang1,3
(School of Landscape Architecture, Beijing Forestry University, Beijing 100083, China; 2.Wuxi Hongyuan Landscape Construction Co.,Ltd., Wuxi 214000, Jiangsu, China; 3. China National Engineering Research Center for Floriculture, Beijing 100083, China)
By taking the stems with axillary buds and petioles as explants, the tissue culture of Crossostephium chinense was studied. The effects of different sterilization time, mediums for initial culture, multiplication culture and rooting culture were tested. The results show that the stems were the optimal explants, the best disinfection method was: the stems were treated with 75﹪ alcohol for 20 seconds and 0.1﹪ HgCl2for 2 minutes, the petioles were treated with 75﹪ alcohol for 20 seconds and 0.1﹪ HgCl2for 1 minute; the optimal initialgeneration medium was: the stems were treated with MS+0.1 mg/L NAA+2.0 mg/L 6-BA,the callus induction frequency was 80.6﹪,the stems were treated with MS+1.0 mg/L NAA+2.0 mg/L 6-BA, the callus induction frequency reached 83.3﹪; the subculture was conducted by taking the stems as the explants and with MS+0.2 mg/L NAA+2.0 mg/L 6-BA, thus obtaining the maximum increment coefficient. The rooting rate of subculture plantlet was 80.6﹪ in MS medium and 86.1﹪ in 1/2 MS medium.
Crossostephium chinense; tissue culture; techniques of fast multiplication; stem
S722.3+7;S682.11
A
1673-923X (2012)07-0100-05
2012-04-18
中央高校基本科研业务费专项(YX2011-32);十二五国家科技支撑计划课题(2012BAD01B07); 中央高校基本科研业务费专项(TD2011-27)
陈雪鹃(1984—),女,贵州贵阳人,博士研究生,主要从事花卉种质资源与育种研究;E-mail:janeta1018@163.com
张启翔(1956—),男,湖北黄冈人,教授,主要从事花卉种质资源与育种研究
[本文编校:吴 毅]
