蛇皮果基因组DNA提取及其RAPD条件优化
2012-12-27李建光李荣生李发根尹光天杨锦昌邹文涛
李建光,李荣生,李发根,尹光天,杨锦昌,邹文涛
(中国林业科学研究院 热带林业研究所,广东 广州 510520)
蛇皮果基因组DNA提取及其RAPD条件优化
李建光,李荣生,李发根,尹光天,杨锦昌,邹文涛
(中国林业科学研究院 热带林业研究所,广东 广州 510520)
以蛇皮果顶梢嫩叶为材料,比较了CTAB法、改良CTAB法、CTAB-free法和SDS法对基因组DNA的提取效果,并对蛇皮果RAPD反应体系进行优化。结果表明,CTAB法、改良CTAB法和CTAB-free法均能提取出蛇皮果基因组DNA,其中NaCl浓度为5 mol/L的改良CTAB法因可更有效地去除多糖及酚类物质,并能满足PCR扩增的要求而被认为是蛇皮果基因组DNA提取的最适方法;在15 μL的PCR扩增体系中,Mg2+、dNTPs和Taq DNA聚合酶的最优浓度分别为1.4 mmol/L、0.12 mmol/L和0.12 U/μL;PCR反应程序的最适退火温度为39 ℃。
蛇皮果;DNA提取;RAPD优化
蛇皮果Salacca zalacca (Gaertner) Voss ex. Vilm.(=S. edulis Reinw)为棕榈科Palmae蛇皮果属果树,具有果实外形奇异、果肉铁钙含量高、林下作业不晒和经营期长等优点,可在我国海南和云南热带地区栽培[1-2]。
有性繁殖是蛇皮果繁殖的重要方式,然而雌雄异株的蛇皮果通过有性繁殖生产的实生苗难以从形态上区分性别,而性别不分的实生苗造林后容易产生雌株分布不均、单产低和调整成本高等问题。因此蛇皮果实生苗性别鉴定是蛇皮果栽培亟需解决的问题之一。目前在银杏和大麻上已可利用基因组DNA分子标记技术鉴定实生苗性别[3-4],理论上基因组DNA分子标记技术也可用于蛇皮果实生苗性别鉴定。基因组DNA分子标记技术的首要工作是植株基因组DNA提取及其PCR扩增。然而目前如何提取蛇皮果基因组DNA及其PCR扩增却还不清楚。有鉴于此,本研究以蛇皮果叶片为材料,筛选出蛇皮果基因组DNA的提取方法和RAPD(Random Amplified Polymorphic DNA,随机扩增多态性DNA)反应体系最佳条件,从而为开发RAPD分子标记鉴定蛇皮果性别和蛇皮果分子生物学研究提供技术支撑。
1 材料与方法
1.1 采样
采样果林位于海南省定安县黄竹镇南海农场试验场,20世纪90年代中期种植,种源来自印度尼西亚。采集时间为2011年5月,共选择20棵长势健康的植株,采集植株中上部叶子的中上部新鲜的叶片,采下后用卫生纸除去表面灰尘及水分,每棵用塑料袋单独封装,一起用冰袋保鲜,带回实验室后在-70 ℃下保存。
1.2 基因组DNA提取方法
1.2.1 CTAB法
采用CTAB法进行蛇皮果叶片的总DNA提取,具体步骤如下:预先在10 mL离心管中加入4 mL 2% CTAB提取液(CTAB 20 g/L,NaCl 81.816 g/L,EDTA 9.306 g/L,Tris-HCl 12.114 g/L,pH 8.0),65 ℃保温。称取蛇皮果叶片1.2 g,剪碎,放入研钵,加液氮研磨至粉末状。将研磨好的粉末状叶样加入预热的提取液中,封口,65 ℃保温60 min,每隔10 min摇动1次。将样品在离心机上用11 000 r·min-1离心10 min,然后取上清液。往上清液中加入氯仿∶异戊醇(24∶1)混合液4 mL,摇匀,再11 000 r·min-1离心10 min,取上清液;重复1次本步骤。向上清液中加入4 ℃冷藏的2 mL异丙醇,轻轻晃动混匀,在-20 ℃下静置1 h以上。取冷冻液,11 000 r·min-1离心10 min,倒掉上清液,加入2 mL无水乙醇洗两次,洗后将管倒置于卫生纸上吸干,在真空浓缩仪中干燥5 min左右。加入1 mL 1×TE,溶解沉淀的DNA,弹动或震荡以充分溶解,放入冰箱备用。DNA浓度通过与100 bp DNA Ladder(购自Sangon公司)的500 bp片段亮度对比进行[5]。
1.2.2 改良CTAB法
改良的CTAB法是在2% CTAB提取液中加入了2% β-巯基乙醇和5% PVP-40,而且在加入4℃冷藏的2 mL异丙醇之前加入2 mL浓度为5 mol/L的NaCl,其它步骤与CTAB法相同。
1.2.3 CTAB-free法
CTAB-free法首先将研磨好的蛇皮果叶样加入到4 mL CTAB-free提取液(PVP 15 g/L,NaCl 81.816 g/L,EDTA 9.306 g/L,Tris-HCl 12.114 g/L,pH 8.0)和2% β-巯基乙醇中,在冰上冰浴10 min,然后7 000 r·min-1离心10 min,去掉上清液[6]。在沉淀中加入3% CTAB提取液,其它步骤与改良CTAB法相同。
1.2.4 SDS法
SDS法主要是将CTAB法中的提取液换成2% SDS提取液,其它步骤与CTAB法相同[7]。
1.3 PCR扩增方案的优化
1.3.1 扩增体系的优化因子
扩增体系的优化因子包括Mg2+浓度、dNTPs浓度和Taq DNA聚合酶浓度(见表1)。PCR扩增体系的优化以改良CTAB法提取的蛇皮果基因组DNA为材料,利用随机引物S2007、S2008、S2009、S2010、S2011、S2074、S2075、S2076、S2077、S2078、S2081、S2082、S2083、S2084、S2085进行(引物序列见表2,均购自Sangon公司)。15 μL扩增反应体系基本组成为:1.5 μL 10×缓冲液[Tris-HCl 100 mmol/L(pH 9.0)、KCl 100 mmol/L、NP-400.5 %、(NH4)2SO480 mmol/L]、0.2 mmol/L dNTPs、0.1 U/μL Taq DNA 聚 合 酶、1.8 mmol/L Mg2+、1.0 μmol/L RAPD 引物、12 ng DNA模板,补加ddH2O至15 μL。
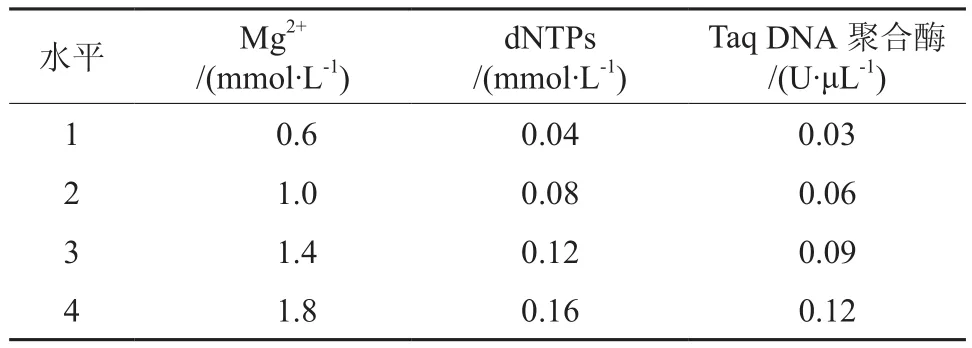
表1 蛇皮果PCR扩增体系的优化设计Table 1 The optimization design of salak PCR amplification system
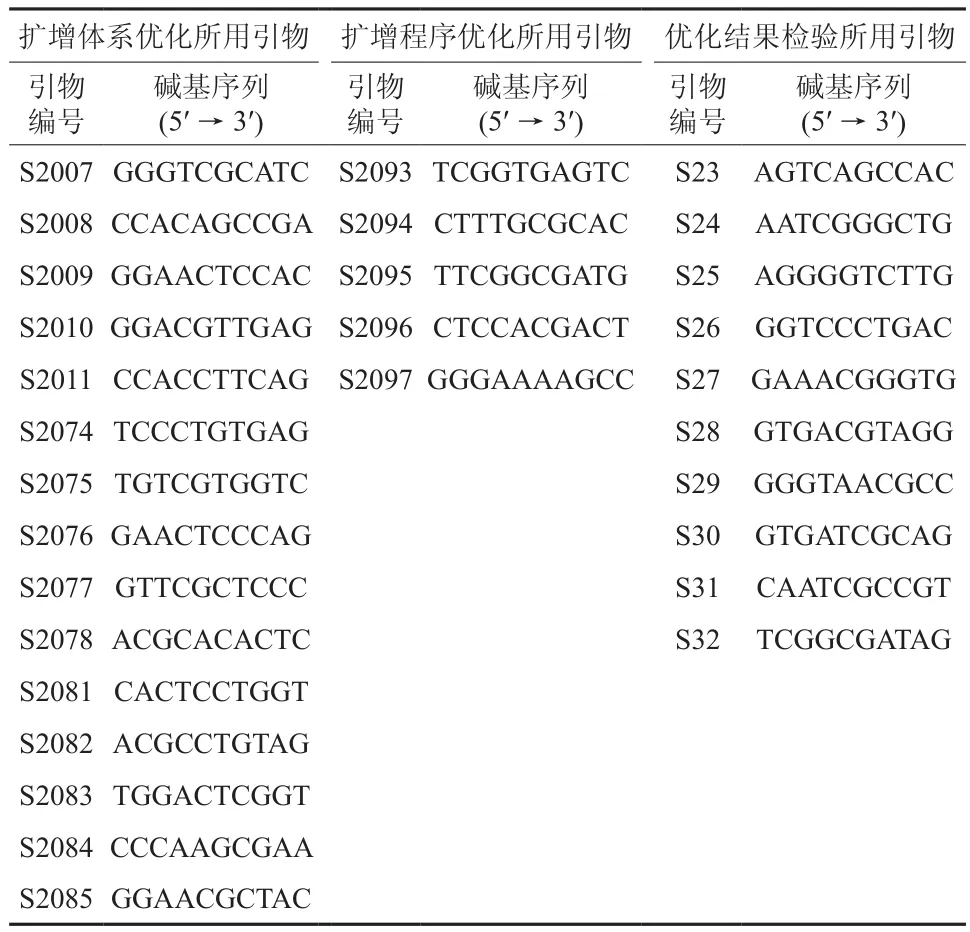
表2 蛇皮果基因组DNA扩增优化所用RAPD 随机引物名称及其碱基序列Table 2 The RAPD random primers and base sequences of this study
1.3.2 扩增程序的优化
PCR扩增程序的优化是在优化的扩增体系的基础上,以改良CTAB法提取的蛇皮果基因组 DNA为材料,利用 S2093、S2094、S2095、S2096和S2097共5个随机引物进行(引物序列见表2)。基本扩增程序为:94 ℃预变性2 min;再40个循环:94 ℃变性30 s,36 ℃退火30 s和72 ℃延伸2 min;最后72 ℃延伸10 min。扩增程序的优化主要是针对退火温度的调节,退火温度设置为34 ℃、36 ℃、38 ℃、40 ℃、42 ℃、44 ℃。PCR扩增仪为GeneAmp PCR System 2700(Applied Biosystem Co.) 。扩增产物用含有0.05 μL/mL Gold ViewTM(购自北京赛百盛基因技术有限公司)的1.2 %琼脂糖凝胶在0.5×TBE缓冲液中电泳分离检测,电泳结果通过WD-9403F紫外仪成像。
1.3.3 优化结果的检验
在完成1.3.1和1.3.2内容后总结出优化的扩增体系参数,利用蛇皮果1个DNA样品,采用该扩增体系和编号为S23-32的随机引物(引物序列见表2) 进行扩增,观察扩增后的电泳谱带,检验优化体系的适用性。
2 结果与分析
2.1 DNA提取方法
4种方法提取的DNA的电泳如图1所示。由图可以看出,改良CTAB法、CTAB-free法和CTAB法均能提取出蛇皮果的基因组DNA,而SDS法提取的效果较差。然而3种可提出基因组DNA的方法中,CTAB-free法跑出的条带比较分散,CTAB法跑出的条带有拖尾现象,而改良CTAB法提取的蛇皮果基因组DNA在质量和数量上均能满足大量PCR扩增的需要,可以作为优先选用的方法。

图1 蛇皮果不同方法提取的基因组DNA的电泳结果Fig. 1 Pattern of genome DNA by different methods
2.2 PCR扩增体系的优化
2.2.1 Mg2+的最佳浓度
不同Mg2+浓度扩增后的电泳结果见图2,图中11~15谱带比M除外的其它谱带清晰,其对应的Mg2+浓度为1.4 mmol/L,即此浓度为蛇皮果基因组DNA扩增体系中Mg2+的最佳浓度。
2.2.2 dNTPs最佳浓度
图3显示dNTPs 浓度在0.12 mmol/L产生的条带比较清晰,因而此浓度为蛇皮果基因组DNA扩增体系中dNTPs的最佳浓度。
2.2.2 Taq DNA聚合酶浓度
Taq DNA聚合酶浓度在0.09 U/μL时条带已经很清晰(见图4),但引物S2078在0.12 U/μL时才扩增出了条带,为了最大限度的扩增出条带将Taq DNA聚合酶浓度定在0.12 U/μL。
2.2.3 退火温度
对于PCR扩增程序中退火温度的调节(见图5),从图中可看到在较大片断(1 500 bp) 的扩增中,6个温度梯度的清晰度差异并不太大。而扩增出的较小片段中,38 ℃和40 ℃得到的条带更清晰些,取其中间值为39 ℃。
2.2.4 优化结果的检验
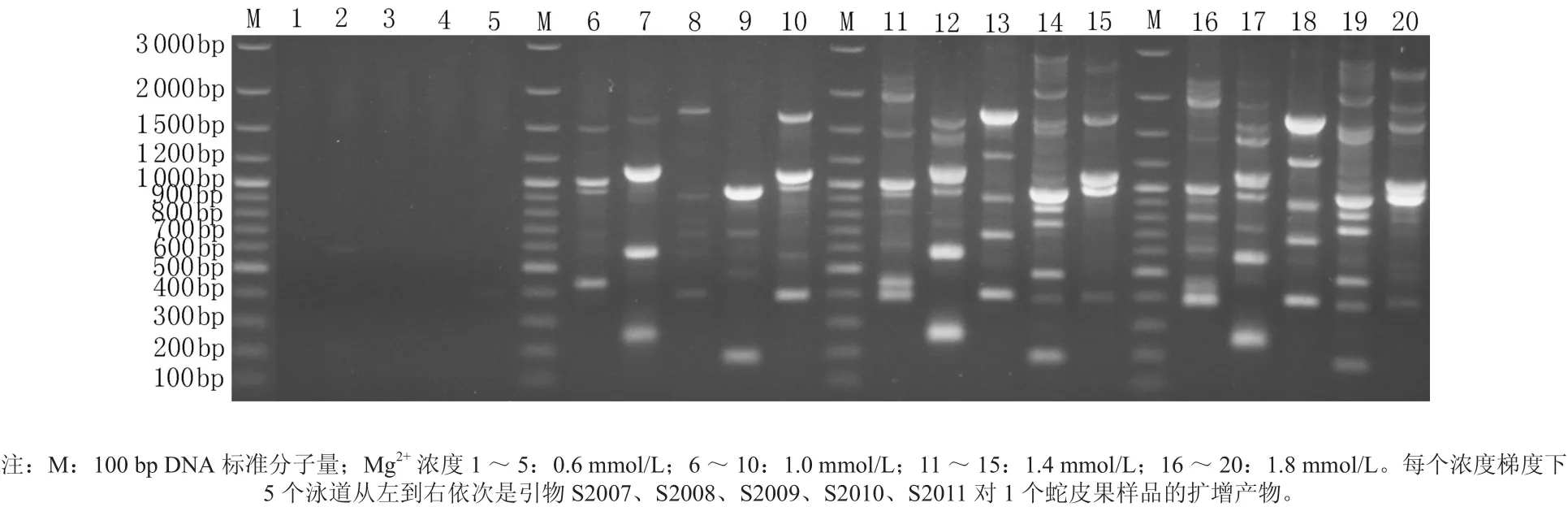
图2 不同Mg2+浓度的蛇皮果基因组DNA扩增体系扩增的DNA的电泳谱带Fig. 2 The RAPD PCR results with different concentrations of Mg2+
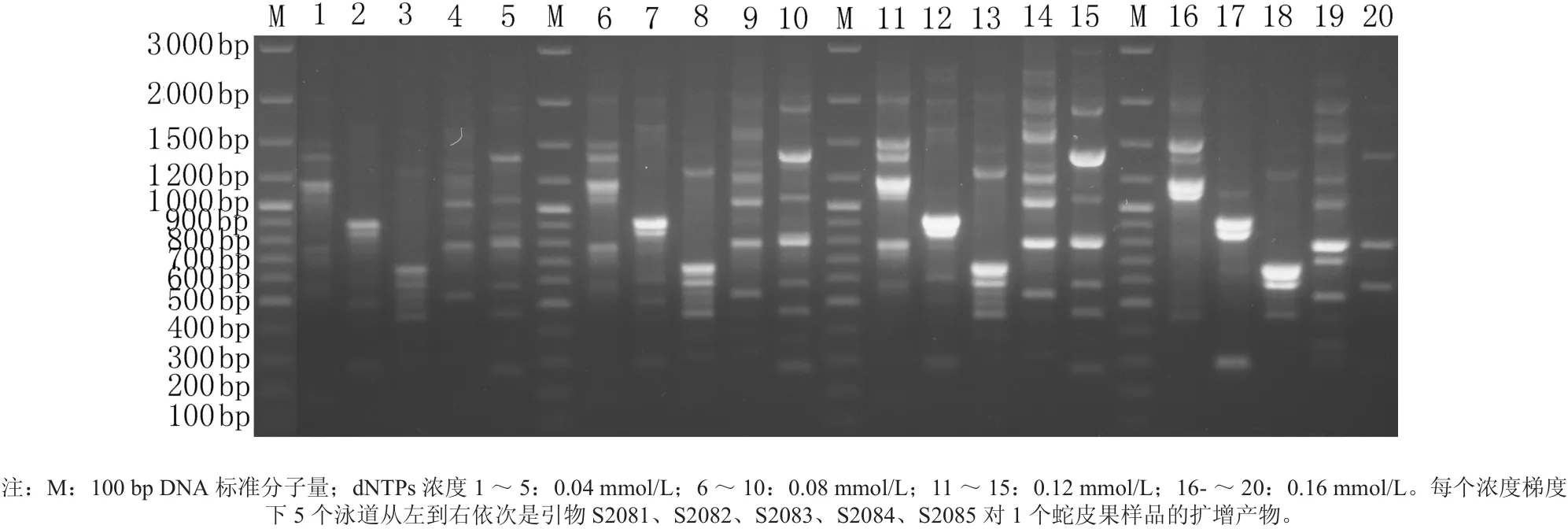
图3 不同dNTPs浓度的蛇皮果基因组DNA扩增体系扩增的DNA的电泳谱带Fig.3 The RAPD PCR results with different concentrations of dNTPs
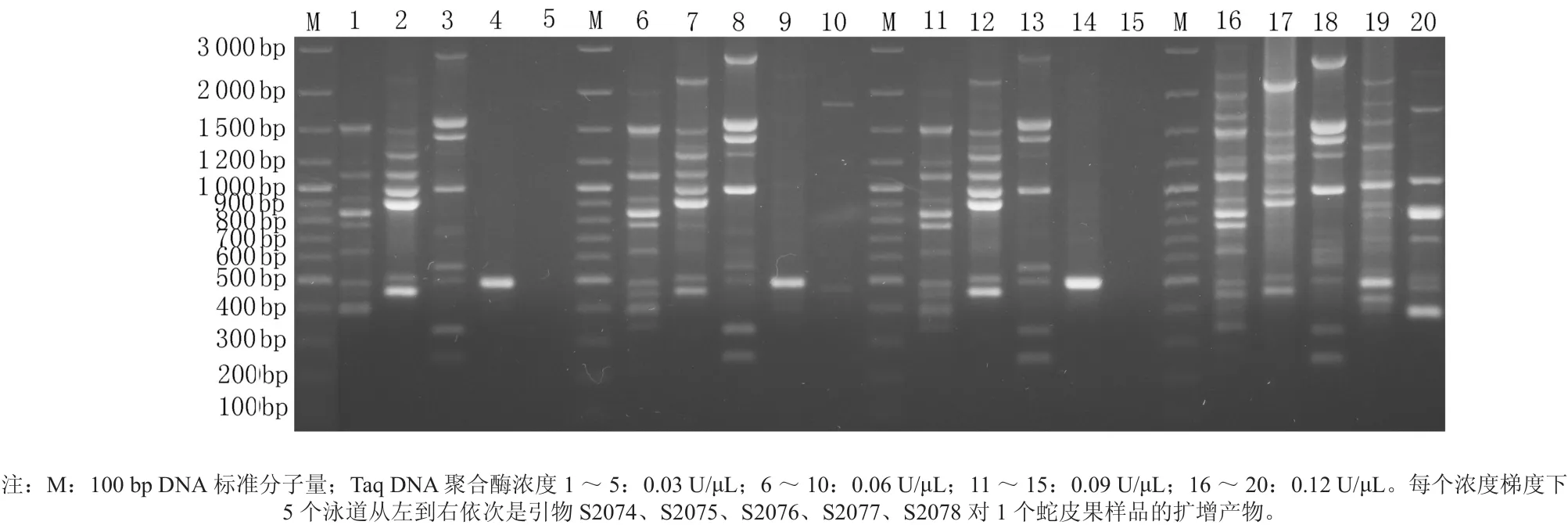
图4 不同Taq DNA聚合酶浓度的蛇皮果基因组DNA扩增体系扩增的DNA的电泳谱带Fig. 4 The RAPD PCR results with different concentrations of Taq DNA polymerase

图5 不同退火温度下蛇皮果基因组DNA扩增的DNA的电泳谱带Fig. 5 The RAPD PCR results with different annealing temperature
利用上述优化的扩增体系和扩增程序对蛇皮果1个样品10个随机引物的扩增表明(见图6),多数条带清晰,扩增背景比较干净,扩增片断的大小范围也较大。所以,最终确定蛇皮果RAPD技术的PCR扩增体系为15 μL体系:10×buffer 1.5 μL,0.12 mmol/L dNTPs,0.12 U/μL Taq DNA聚合酶,1.4 mmol/L Mg2+,1.0 μmol/L RAPD引物,12 ng DNA模板。PCR扩增程序为:94 ℃预变性2 min;再40个循环:94 ℃变性30 s,39 ℃退火30 s和72 ℃延伸2 min;最后72 ℃延伸10 min。
3 结论与讨论

图6 优化方案对10个随机引物PCR的DNA的电泳谱带Fig. 6 The RAPD PCR results of salak genomic DNA
目前,对基因组DNA提取方法研究报道很多,但较难解决的是多糖类物质的去除。由于多糖的许多理化性质与核酸相似,因此用氯仿抽提、选择性沉淀等常规方法不能有效地去除多糖。由于多糖可以抑制许多酶活性[8],有多糖污染的DNA样品纯度较低,无法顺利进行PCR扩增,因此必须尽量避免提取过程中的多糖污染。蛇皮果富含多糖和酚类物质,过多的多糖将影响后期PCR扩增效果,所以多糖的去除是本实验的关键步骤。本实验首先采用CTAB法和SDS法进行基因组DNA的提取,由于未采取去除多糖的措施,故所得DNA沉淀为一团胶状物,而且加入1×TE进行溶解DNA时需要很长的时间,通过电泳检测可以看出(见图1)受多糖和杂质的影响两种方法跑出的效果都不好,CTAB法的拖尾现象比较严重,而SDS法只有一条很模糊的条带。采用CTAB-free法提取的基因组DNA虽然无拖尾现象而且条带比较清晰,但由于在第一步除多糖的过程中同时也洗去部分的基因组DNA,从而造成基因组DNA量的减少,同时有少量DNA降解,造成跑出的电泳条带比较分散。改良的CTAB法首先在缓冲液中加入了β-巯基乙醇和聚乙烯基吡咯烷酮(PVP),β-巯基乙醇能抑制酚类物质的氧化,PVP作为酚类物质结合剂,可吸附多酚分子上的氢键,形成水不溶性复合物[9],从而有效的去除蛇皮果当中的酚类物质。同时,PVP作为澄清剂,具有吸附作用[10],能吸附多糖将其除去。提高NaCl浓度是去除多糖的一种有效方法,周诗捷等[11]对华南五针松成熟针叶提取基因组DNA时,将NaCl浓度提高到2 mol/L并取得较好的提取效果。但在本实验中只有将NaCl浓度提高到 5 mol/L 时才能有效去除多糖。通过上述分析以及电泳检测结果最终选用改良CTAB法作为蛇皮果的基因组DNA提取方法。
通过对蛇皮果RAPD反应体系优化的研究,有利于建立有效的扩增体系和扩增程序,为蛇皮果分子生物学研究提供技术支持。在扩增体系中,Mg2+浓度会影响到酶的活性、合成的忠实性、引物与模板的结合效率和退火温度等方面[12]。从试验设置的4个浓度梯度来看,随着Mg2+浓度的增加,PCR扩增所产生的条带越来越清晰,而且产生的带型也逐渐的增多。但是,当浓度增加到一定程度时会导致非特异性扩增和引物二聚体的形成。根据电泳检测的结果最终确定了Mg2+浓度为1.4 mmol/L。扩增体系中dNTPs浓度过高会导致Taq DNA聚合酶错误掺入,而且还会与反应混合液中的Taq DNA聚合酶竞争Mg2+,抑制酶的活性。所以dNTPs 浓度和Taq DNA聚合酶浓度需要达到一定的平衡状态。一般RAPD技术中PCR扩增的退火温度都在35℃~40℃之间[13],温度过高会抑制PCR扩增。但是Parasnis[14]研究番木瓜时使用的退火温度达到45℃,而且李发根等[15]对棕榈藤研究的退火温度也达到45℃,说明采用RAPD技术进行分子标记研究时,退火温度范围较大。本实验的退火温度从34℃到44℃设置了6个梯度,从电泳图中可以看出不同的退火温度之间的差异并不太大,这佐证了RAPD技术中PCR扩增程序退火温度适宜范围较广,也证明了RAPD反应在退火温度上具有较高的稳定性和可重复性。
致谢:中国林业科学研究院热带林业研究所研究员甘四明博士和硕士生于晓丽对本研究给予建议和实验协助,特此感谢!
[1] 李荣生,尹光天,曾炳山,等.印度尼西亚蛇皮果的开发利用[J].林业实用技术,2008,(6): 46-48.
[2] 胡建湘,郑玲丽.西双版纳引种栽培蛇皮果初报[J].亚热带植物科学,2004,33(3): 48–50.
[3] 王晓梅,宋文芹,刘 松,等.与银杏性别相关的RAPD标记[J].南开大学学报(自然科学版),2001,34(3): 116-117.
[4] 陈其军,韩玉珍,傅永福.大麻性别的RAPD和SCAR分子标记[J].植物生理学报,2001,27(2): 173-178.
[5] Doyle J J, Doyle D J. Isolation of plant DNA from fresh tissue[J].Focus,1990,12: 13-15.
[6] Zeng J, Zou Y P, Bai J Y, et al. Preparation of total DNA from“Recalcitrant Plant Taxa”[J].Acta Botanica Sinica,2002,44(6):694-697.
[7] Marmur J. Determination of DNA by formamide[J].Biochimica Biophysica Acta,1961,51: 32–36.
[8] Fang G, Hammar S, Grumet R. A quick and inexpensive method for removing polysaccharides from plant genomic DNA[J].Bio Techniques, 1992,13: 52-56.
[9] 罗志勇,周 钢,陈湘晖,等.高质量植物基因组DNA的分离[J].湖南医科大学学报,2001,26(2):178-180.
[10] 王卓伟,余茂德,鲁 成.PVP在桑叶总DNA提取中的应用[J].西南农业大学学报,2001,23(1):61-62.
[11] 周诗捷,曹福祥.华南五针松成熟针叶基因组 DNA的提取方法[J].中南林业科技大学学报,2010,30(5):97-100.
[12] 林万明.PCR技术操作和应用指南[M].北京:人民军医出版社,1993:7-14.
[13] 甘四明,施季森,白嘉雨,等.尾叶桉和细叶桉无性系的RAPD指纹图谱构建[J].南京林业大学学报,1999,23(1):11-14.
[14] Parasnis A S, Gupta V S, Tamhankar S A, et al. A highly reliable sex diagnostic PCR assay for mass screening of papaya seedlings[J].Mol. Breeding,2000,6(3): 337-344.
[15] 李发根,杨 华,尹光天,等.棕榈藤基因组DNA提取及RAPD反应条件探索[J].林业科学研究,2004,17(6): 824-828.
DNA extraction and RAPD Condition optimization for Salacca edulis Reinw
LI Jian-guang, LI Rong-sheng, LI Fa-gen, YIN Guang-tian , YANG Jin-chang, ZOU Wen-tao
(Research Institute of Tropical Forestry, Chinese Academy of Forestry, Guangzhou 510520, Guangdong, China)
∶ By taking the tender leaves on top-shoots of Salacca edulis as tested materials, the extraction effects of CTAB, improved CTAB, CTAB-free and SDS on the genomic DNA of salak were investigated and compared. And the reaction system of salak RAPD was optimized. The results show that CTAB, improved CTAB, CTAB-free all could extracted out genomic DNA from salak, of them,the improved CTAB with NaCl concentration of 5 mol/L could more effectively remove polysaccharides and polyphenols than the other two methods, and meet the requirement of PCR amplification, so it is the best method. The optimal concentrations of Mg2+, dNTPs, Taq DNA polymerase and the annealing temperature are 1.4 mmol/L、0.12 mmol/L, 0.12 U/μL and 39 ℃ respectively for the PCR progress for salak.
∶ Salacca edulis; salak; DNA extraction; RAPD optimization
S789.5
A
1673-923X(2012)06-0110-05
2012-01-17
中央级公益性科研院所基本科研业务费专项项目“蛇皮果栽后遮荫和灌溉技术研究”(编号:RITFKYYW2010-02);国家林业局948引进项目“蛇皮果栽培品种及配套栽培技术引进”(编号:2007-4-11)
李建光(1984—),男,河北廊坊人,硕士研究生,主要从事种苗培育理论与技术研究
李荣生(1975—),男,福建仙游人,博士,副研究员,主要研究蛇皮果和棕榈藤的种质资源收集及其评估、育种和培育理论及技术;E-mail:fjlrs@tom.com
[本文编校:罗 列]
