块菌多糖提取工艺优化及粗多糖抗氧化性的测定*
2012-12-25孔庆龙樊建赵天瑞
孔庆龙,樊建,赵天瑞
(昆明理工大学化学工程学院,云南昆明,650500)
块菌(Truffle)又称块菇、松露、无娘藤、猪拱菌等,属于子囊菌亚门块菌目块菌科块菌属,是地下真菌中的一个比较重要的子囊菌类群。子实体在土壤中生长,除个别种类在成熟时半露出土表外,大部分种类自始至终埋生于地下,是与树木共生的外生菌根型药食两用真菌[1-2]。块菌的主要活性成分有α-雄烷醇、神经酰胺、块菌多糖等[3-4]。研究表明:块菌多糖作为一种新的真菌多糖,具有水溶性好、毒性低、抑制肿瘤作用明显等特征,有望开发成抗肿瘤药物;此外,块菌多糖作为一种新的真菌多糖具有抗氧化、抗肿瘤、消炎等良好的生物活性,为保健品和药品的开发提供了新的原料[4-6]。现有的多糖提取方法主要是酸提法、碱提法、超声波辅助提取、酶辅助提取和水提法。酸提法会对多糖糖苷键造成破坏,碱提法会给后续的醇沉造成不良影响,超声波和酶辅助法操作过程复杂。本文对热水浸提法提取块菌多糖,并对其进行了抗氧化试验。
1 材料和方法
1.1 材料与仪器
印度块菌(Tuber indicum):昆明食用菌所提供,产自云南,冻藏备用。
苯酚、浓 H2SO4、95%乙醇、葡萄糖、甲醇、DPPH、Na2HPO4、NaH2PO4、铁氰化钾、三氯乙酸、三氯化铁、水杨酸、H2O2、FeSO4,均为分析纯。
手提式高速粉碎机,温嶺市大德中药机械有限公司;分析天平(AL204型),梅特勒-托利多仪器(上海)有限公司;恒温水浴锅(HH-4),金坛市杰瑞尔电器有限公司;循环多用真空泵(SHZ-D(Ⅲ)型),巩义市英峪予华仪器厂;TU1901型双光束紫外可见光光度计,北京普析通用仪器有限责任公司;RE-52AA旋转蒸发仪,上海亚荣生化仪器厂;飞鸽LXJ-ⅡB大容量离心机、TGL-16G冷冻离心机,上海安亭科学仪器厂。
1.2 实验方法
1.2.1 标准溶液的制备
准确称取无水葡萄糖0.100 0 g于100 mL容量瓶中定容,制得1 mg/mL的葡萄糖标准溶液,摇匀备用。
1.2.2 标准曲线的绘制
采用硫酸-苯酚法[7]用移液管分别吸取葡萄糖标准溶液2、4、6、8、10 mL,置于 50 mL 容量瓶中,加水至刻度,摇匀。再分别吸取上述溶液0.8 mL置于20 mL比色管中,以蒸馏水为空白对照,每个试管中加入新配制的5%的苯酚溶液0.8 mL,然后迅速加入浓硫酸5 mL,混合均匀后沸水浴30 min,冷却至室温。于490 nm波长处测定吸光度A,绘制标准曲线,得回归方程。
1.2.3 水提法块菌多糖的工艺流程
原料烘干→粉碎→过70目筛→称重→浸提→抽滤→滤液→真空浓缩至原体积1/4→过夜醇沉→离心→沉淀→真空干燥→粗多糖
1.2.4 样品测定
准确称取过筛后的粉末0.5 g,按设定提取时间、温度、液料比提取多糖,过滤取滤液定容至500 mL得到样品溶液,精确吸取样品溶液0.8mL,按1.2.2所述方法操作,将所测得的样液的吸光值带入回归方程中,计算得出多糖产量从而得到块菌多糖提取率。
1.2.5 单因素试验
在其他条件都相同的情况下,分别考虑水浴时间(1、1.5、2、2.5、3、3.5、4 h)、水浴温度(50、60、70、80、90、100℃)、液料比(10∶1、20∶1、30∶1、40∶1、50∶1、60∶1)3个因素对多糖提取率的影响。
1.2.6 响应面试验设计
由单因素试验确定的块菌多糖热水浸提法提取工艺的因素水平,利用Design Expert 8.0软件,采用中心组合试验Box-Benhnken设计方案[8-9]。以自变量A、B、C分别表示提取时间、提取温度、液料比3个单因素,以-1、0、1代表各因素的各水平值,按xi=(Xi-X0)/△X对自变量进行编码,xi为变量的编码值,Xi为变量的实际值,X0为中心点变量的真实值,△X为变量的变化步长,因素水平如表1所示。
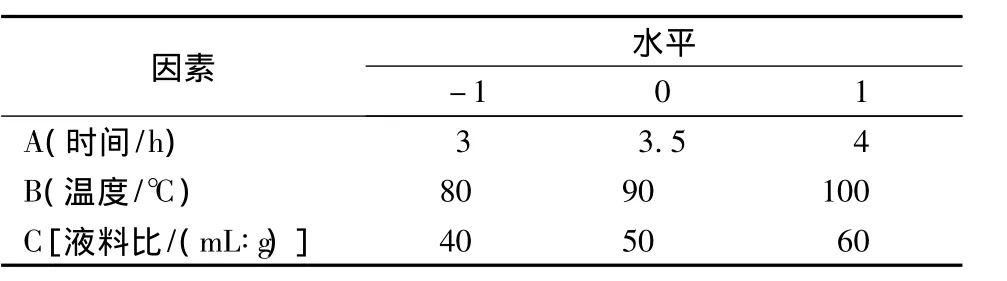
表1 响应面分析因素及水平
1.2.7 DPPH自由基清除能力测定
DPPH自由基清除能力测定参照Blois[10]的方法稍作修改。将块菌粗多糖配成不同浓度的溶液,分别取1mL不同浓度的多糖溶液至离心管中,再分别加入2mL 0.05mmol/L的 DPPH溶液,混合均匀,于25℃恒温避光反应30min,在517nm处测定吸光值Ax。同时以同体积甲醇和超纯水分别取代DPPH溶液和多糖样品作为调零,以同体积的超纯水代替多糖溶液作为空白对照组A0,并为了消除多糖溶液自身吸光值影响,以同体积甲醇代替DPPH作为样品对照组Ax0。清除率由下面公式得:
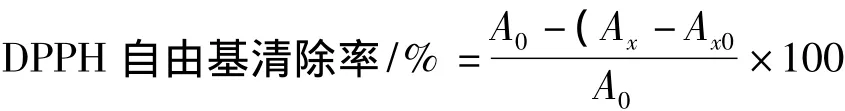
1.2.8 羟基自由基清除能力测定
羟基自由基清除能力测定参照Smirnff[11]的方法稍作修改。将块菌粗多糖配成不同浓度的溶液备用。在离心管中依次加入1mL 9 mmol/L FeSO4、1mL不同浓度的多糖溶液、1mL 9 mmol/L H2O2摇匀静置10 min,再加入1mL 9 mmol/L水杨酸乙醇溶液摇匀,于37℃保温 30 min,冷却至室温,5 000 r/min离心10min,取上清液在510 nm处测吸光值Ax。以等体积水代替多糖为空白对照组测吸光值A0,以等体积水代替水杨酸为样品对照组测吸光值AX0,蒸馏水调零。清除率由下面公式得:
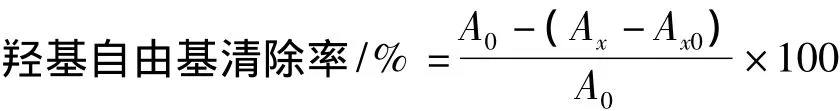
1.2.9 还原力测定
还原力测定参照Yen等[12]的方法修改。将块菌粗多糖配成不同浓度的溶液备用。在离心管中依次加入1 mL 0.2 mol/L pH 6.6的磷酸缓冲液、1 mL不同浓度的多糖溶液、1 mL 1%铁氰化钾溶液于50℃水浴20 min,再加入1 mL质量分数10%三氯乙酸,冰水冷却,5 000 r/min离心10 min,取上清液1 mL再加入1 mL超纯水和0.2 mL质量分数0.1%的三氯化铁,反应10 min后于700 nm处测吸光值。
2 结果与讨论
2.1 单因素对块菌多糖提取率的影响
影响块菌多糖提取率的因素有很多,如提取时间、提取温度、液料比等。在进行RSM分析前,应先进行单因素试验来确定试验因素与水平。
2.1.1 提取时间的影响
确定液料比为60∶1(mL∶g),提取温度为90℃,提取时间分别为 1、1.5、2、2.5、3、3.5、4 h。分别测定多糖含量,以时间为横坐标、多糖提取率为纵坐标绘制曲线,结果如图2所示。从图2可以看出,在1~4 h内多糖提取率随着时间的延长而明显提高,提取率在2 h前增加明显,之后趋于平缓,3.5 h后几乎持平。说明多糖的浸出过程与时间密切相关,时间过短,细胞溶胀性不好且多糖溶解不充分;时间过长,会使已经溶出的多糖结构的变化而使提取率降低。因此,为缩短工时减少能耗,所以选取3.5 h为响应曲面设计中时间因素3个水平的中间值。
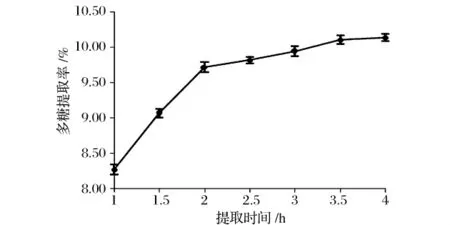
图2 提取时间对多糖提取率的影响
2.1.2 提取温度的影响
确定液料比为60∶1(mL∶g),提取时间为2 h,提取温度分别为 50、60、70、80、90、100℃。分别测定多糖含量,以提取温度为横坐标、多糖提取率为纵坐标绘制曲线,结果如图3所示。从图3知,在一定范围内提取温度与多糖提取率成正相关。在50~90℃内多糖提取率随温度的升高而显著增加,可能原因是随着温度的升高,细胞溶胀度增大,传质强化,从而使得多糖的溶出率增加。而在90℃以后的多糖提取率略有降低,可能原因是温度过高时粗多糖的糖苷键发生水解,多糖降解成单糖或寡糖,从而使粗多糖得率有所降低。考虑到高温可能对多糖结构和活性造成影响,且高温更加耗能,因此选取90℃为响应曲面设计温度因素3个水平中的中间值。
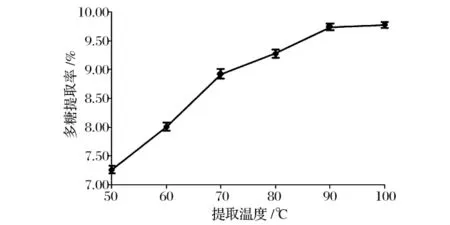
图3 提取温度对多糖提取率的影响
2.1.3 液料比的影响
确定提取温度为90℃,提取时间为3.5h,设定液料比(mL∶g)分别为 10∶1、20∶1、30∶1、40∶1、50∶1、60∶1。分别测定多糖含量,以液料比为横坐标、多糖提取率为纵坐标绘制曲线,结果如图4所示。从图4可以看出,当液料比为10∶1~30∶1时,多糖提取率随液料比的增加十分明显,在液料比为50∶1时提取率达到最高,而当液料比继续增加时多糖提取率变化并不明显,因此估计当液料比为50∶1时已经将多糖充分溶出。液料比较小不利于原料中多糖的溶出,而液料比过高不仅会增大试剂的消耗量,而且不利于后期的分离浓缩。综合考虑产品得率、试剂消耗及后续处理,选取50∶1(mL∶g)为响应曲面优化设计中液料比因素的中间水平。
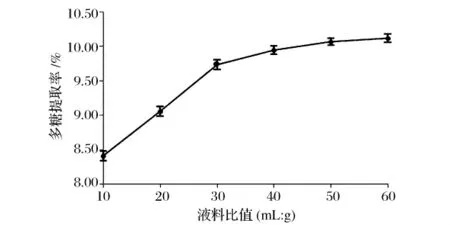
图4 液料比对多糖提取率的影响
2.2 响应面试验结果分析
2.2.1 响应面结果分析
利用Design Expert 8.0软件,采用中心组合试验Box-Benhnken设计方案方案,进行3因素3水平的响应曲面工艺优化试验。试验共设共15个试验点,包括12个析因点和3个中心点。结果如表2所示。其中试验号1~12是析因试验,试验号13~15是中心试验。利用Design Expert 8.0统计软件对表2试验数据进行回归分析,经回归拟合后,各因素与响应值的回归方程为:模型的方差分析见表3。
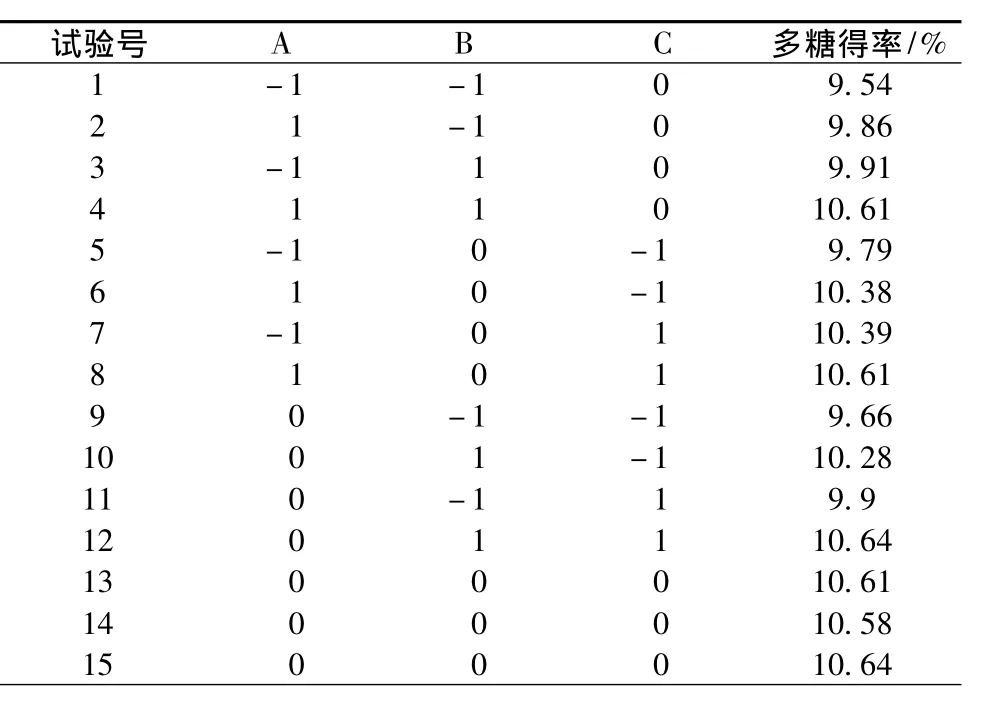
表2 响应面分析方案及试验结果
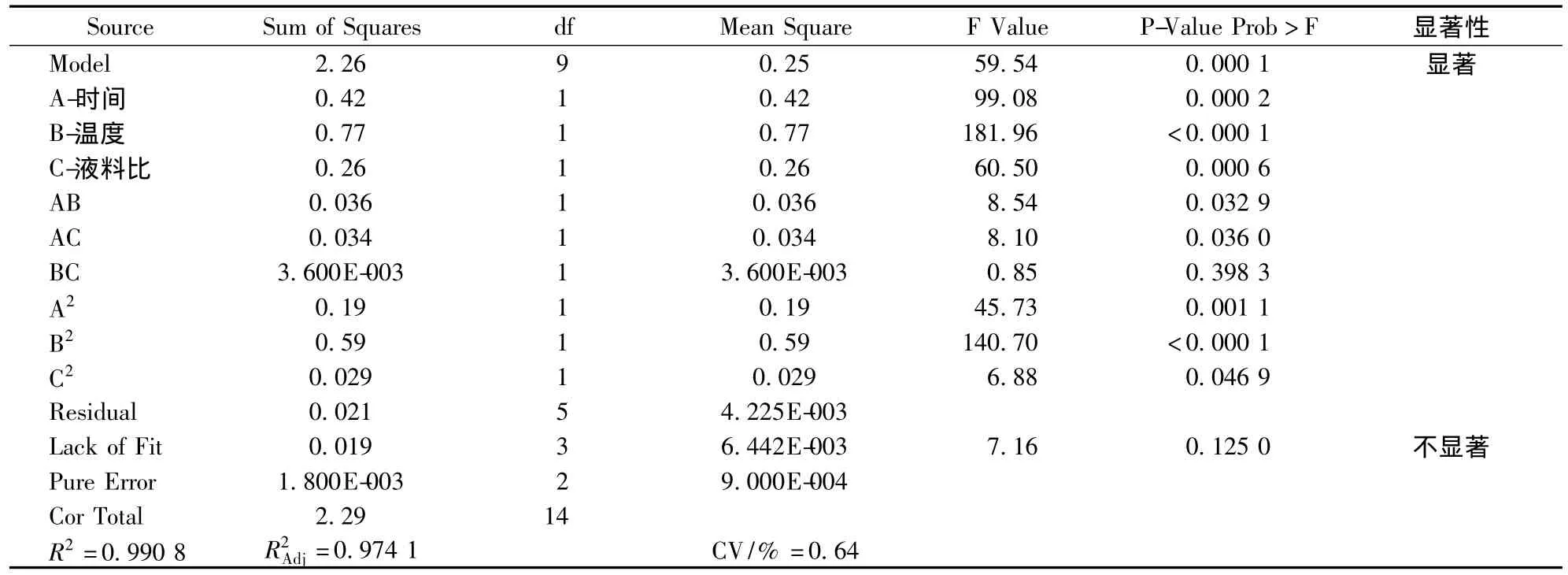
表3 变量方差分析表
由方差分析可知,模型的F值为59.54、P值为0.000 1,说明模型显著,失拟项F值为7.16说明差异不显著,未知因素对试验结果影响小。该模型的复相关系数平方R2=0.990 8,修正相关系数平方=0.974 1,变异系数CV/%=0.64,这说明该试验模型的拟合程度良好,能够很好地描述试验的结果,自变量和响应值之间呈现显著的线性关系,试验误差较小,模型方程可以很好地反映真实的试验值,可用此模型来分析和预测水提块菌多糖的工艺结果。同时能够得知 A、B、C、AB、AC、A2、B2、C2等 8 项试验因子对多糖提取率影响显著,且各试验因子对响应值的影响不是简单的线性关系。根据方差分析和回归方程,得到三维响应面曲面图,如图5所示。
由RSM得到的三维图形直观的反应了各个因素对响应值的影响,其形状也可以反应出交互作用的强弱。由图5可知在一定范围内块菌多糖的提取率随着提取时间和温度的升高而升高,两者交互作用显著,同时可以看出提取温度对提取率影响的显著性大于提取时间;在一定范围内块菌多糖的提取率随着提取时间和液料比的升高而升高,两者交互作用显著,且提取时间对提取率影响的显著性大于液料比;提取温度与液料比的交互作用效果不显著,且提取温度的影响显著性大于水料比。图5显示,3个因素对多糖提取率的影响以及各因素之间的交互影响与回归分析结果吻合。

图5 不同因素及其相互作用对块菌多糖提取率影响的响应曲面图
2.2.2 响应面的优化
通过软件优化器对热水浸提法提取工艺进行优化,得到块菌多糖提取的最佳工艺条件、理论最大提取率并进行验证。验证试验综合考虑实际情况和试验条件,选择工艺条件参数为提取时间3.7h,提取温度95℃,液料比59∶1(mL∶g),在此条件下进行3次平行试验,实际测得块菌多糖的提取率为10.73%、10.78%、10.75%,平均值为10.75%,与理论值的比较误差为0.06%。由此可见,应用RSM法得到的优化工艺参数是准确可靠的。
2.3 抗氧化能力
抗氧化能力使用EC50来进行评价。试验中的EC50值指当DPPH、羟基自由基清除率分别为50%时所需样品的浓度,还原力试验中700nm处吸光值为0.5时的样品浓度。
2.3.1 DPPH自由基清除能力及羟基自由基清除能力
DPPH自由基清除能力的结果如图6所示。研究结果表明块菌多糖具有清除DPPH自由基的活性,其清除能力呈现出剂量依赖性,随着提取物浓度的增加样品对DPPH的清除率也随之增加,当浓度达到5 mg/mL时清除率达到95%,其 EC50值为1.12 mg/mL。
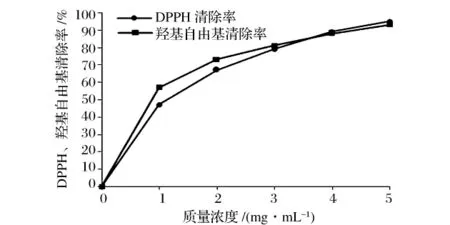
图6 块菌多糖DPPH和羟基自由清除能力
图6 还显示,块菌多糖具有清除羟基自由基的活性,其清除能力呈现出剂量依赖性,随着提取物浓度的增加样品对羟基自由基的清除率也随之增加,当浓度达到5 mg/mL时清除率达到93%,其 EC50值为0.73 mg/mL。
2.3.2 还原力
块菌多糖还原力测定结果如图7所示。研究结果表明块菌多糖具有一定的还原力,其还原能力呈现出剂量依赖性,随着提取物浓度的增加还原力也随之增加,其EC50值为2.46 mg/mL。

图7 块菌多糖的还原能力
3 结论
采用热水浸提法提取块菌多糖的工艺优化条件为:时间3.71 h,温度 94.68℃,液料比 58.66∶1(mL∶g)。综合考虑实际情况和试验条件,选择工艺条件参数为提取时间3.7 h,提取温度95℃,液料比59∶1(mL∶g)。在此条件下进行3次平行试验,实际测得块菌多糖的提取率平均值为10.75%,与预测值接近,证明试验设计及分析方法可靠。
通过对块菌抗氧化活性的研究,得知块菌有较强的DPPH自由基和羟基自由基清除能力和较好的还原能力。表明块菌多糖对人体的氧化损伤有一定的保护作用,为以后块菌相关关产品的开发提供了一定的参考和依据。
[1] Luard E.Truffles[M].Tennessee:Frances Lincoln Ltd,2006:1-176.
[2] Hall I R,Brown G T,Zambonelli A.Taming the Truffle[M].Portland,Oregon,USA:Timber Press,Inc,2007:1-304.
[3] 吴少华,陈有为,杨丽源,等.印度块菌的化学成分研究[J]. 中草药,2009,40(8):1 211-1 214.
[4] 刘长姣,于徊萍,李玉.块菌有效成分和活性研究进展[J]. 安徽农业科学,2012,40(4):2 017-2 019.
[5] Wang Sunan,Massimo F Marcone.The biochemistry and biological properties of the world's most expensive underground edible mushroomv Truffles[J].Food Research International,2011,44:2 567-2 581.
[6] 胡慧娟,李佩珍,林涛,等.块菌多糖对小鼠肿瘤及免疫系统的影响[J].中国药科大学学报,1994,25(5):289-292.
[7] Dubois M,Gilles K A,Hamilton J K,et al.Colorimetric method for determination of sugars and related substances[J].Anal Chem,1956,28:350.
[8] 王雪冰,赵天瑞,樊建.响应曲面法优化虎掌菌多糖提取工艺研究[J].西南大学学报:自然科学版,2011,33(7):146-151.
[9] 吴有炜.试验设计与数据处理[M].苏州:苏州大学出版社,2002:115-154.
[10] Blois M S.Antioxidant determinations by the use of a stable free radical[J].Nature,2002,26:1 199-1 200.
[11] Smirnoff N,Cumbes Q.Hydroxyl radical scavenging activity of compatible solutes[J].Phytochemistry,1989,28(4):1 057-1 060.
[12] Yen G C,Chen H Y.Antioxidant activity of various tea extract in relation to their anti-mutagenicity[J].Journal of Agricultural and Food Chemistry,1995,43(1):27-32.
