纳米级磁性阿霉素脂质体的制备及对人胃癌细胞的体外细胞毒作用*
2012-12-23纪金童黄曙光陶凯雄王国斌
肖 勇, 纪金童, 黄曙光, 陶凯雄, 王国斌
华中科技大学同济医学院附属协和医院胃肠外科,武汉 430022
将化疗药物进行脂质体包裹,到达局部组织后,化疗药物缓慢从脂质体内释放出来,可提高治疗效果和降低化疗中的副作用,是目前较为提倡的化疗方法。脂质体的粒子大小处于纳米级的范围,具有无毒、无免疫原性、可降解、缓释等特点。用脂质体作为抗癌药物载体,能降低药物毒性,保护被包封药物,具有良好的天然靶向性和通透性,在临床上已逐渐开展应用。
近年来,为了提高脂质体的靶向性,国内外进行了大量研究,开发出多种多样的靶向脂质体,为药物及基因的定向转移提供了有效手段,并为最终实现药物的体内控释开辟了广阔的前景。磁性脂质体(magneticliposomes,MLP)是近年来国内外大力研究的一种新的靶向制剂,这种制剂使药物同时具有生物功能、磁性靶向功能和治疗功能。磁性靶向给药系统是将药物和适当的磁性材料及必要辅料配制而成,在足够的体外磁场引导下,随血流运行,选择性地到达并定位于肿瘤靶区。药物以受控的方式从载体中释放,然后在肿瘤组织的细胞或亚细胞水平上发挥作用,故对正常组织无太大影响[1]。国内外学者就生物磁学用于恶性肿瘤的治疗进行了初步研究,认为恒定磁场具有抑制恶性肿瘤细胞增殖的作用,磁性毫微粒在足够强的外磁场作用下,可以引导负载药物在体内定向移动、定位浓集,从而达到提高药物治疗指数,降低药物毒副作用的目的[2-4]。磁性阿霉素脂质体因其具备的靶向性、低毒性和缓释性等特点日益受到各国学者的重视,本文就磁性阿霉素脂质体的制备进行研究,以期证实其具有生物功能、磁性靶向功能和治疗功能。
1 材料与方法
1.1 主要实验材料
盐酸阿霉素(DOX,深圳万乐制药有限公司);L-α-磷脂酰乙醇胺(L-α-PE),L-α-磷脂酰胆碱(L-α-PC),胆固醇(Chol),均为日本和光纯药工业株式会社产品;葡聚糖凝胶(Sephadex G-50,Pharmacia进口分装);其他实验试剂均为分析纯。人低分化胃腺癌MKN45细胞株购自中国科学院上海生物化学和细胞研究所。
RE-52C旋转蒸发器(河南巩义市英峪予华仪器厂),SHZ-D 型循环水式真空泵(河南巩义市英峪予华仪器厂),UV-260 紫外分光光度仪(日本岛津),原子吸收光谱分析仪(美国Warian 公司),JY92-II超声细胞粉碎机(宁波科生仪器厂),Zetapal无机粒度分析仪(Brookhaven instruments corporation)。
1.2 磁性阿霉素脂质体的制备
方法参见文献[5-8]。
1.2.1 阿霉素磁流体的制备 ①根据反应原理:Fe2++2Fe3++8OH-=Fe3O4+4H2O,用化学共沉淀法,得到粒径为10nm 左右的Fe3O4磁液,将阿霉素溶于制备好的磁液里备用。②按2∶1(V/V)的比例抽取氯仿/甲醇2mL 放入试管里,按7∶2∶1的比例精确称量L-α-磷脂酰乙醇胺、胆固醇、L-α-磷脂酰胆碱,加入试管,振荡溶解后进行超声粉碎,用氮气吹去一部分溶剂后加入茄形瓶进行真空下旋转蒸发直至在瓶壁形成一层薄膜。③抽取阿霉素磁液和0.5g玻璃珠加入茄形瓶里,旋涡振荡30min直至薄膜脱落后间断脉冲超声粉碎,静置12h完成封闭过程后进行离心,4 000g离心10min,取上清液。④将上清液引入Sephadex G-50层析柱分离未包封的阿霉素,用超微滤膜滤除大粒径的脂质体。
1.2.2 磁性阿霉素脂质体最佳制备工艺的确定 紫外分光法计算浓度的公式:A=K×C×L,其中A为吸光度,K 为吸收系数,L 为常规参数=1,C 是浓度,由此可知吸光度和浓度呈正比。在紫外分光光度仪上对阿霉素磁液进行扫描,可以看出在232.4 nm 处阿霉素磁液有最大吸收。将阿霉素磁液精密配制成50、25、10、5、1μg/mL 系列浓度,以232.4 nm 为测定波长测定各个标本的A 值,以浓度为横坐标、A 值为纵坐标制成标准曲线,可以看出阿霉素磁液在1~50μg/mL 浓度范围里的A 值(Y)与其浓度(X)成线性关系。线性回归方程为:X=25.37 Y-2.823,r=0.995 7。
利用正交实验设计确定最佳制备工艺。根据对文献的分析,本次实验排除了一些已经被证实的因素后选择5个因素进行实验设计。因为阿霉素磁液中磁性成分浓度和阿霉素的浓度呈正比关系,所以将这2个因素归为同一因素进行设计。结果为:蒸发前不对脂质溶剂进行超声粉碎,阿霉素磁液浓度0.5mg/mL,蒸发后对混合液超声粉碎20 min,脂水相体积比1∶1.5,为最佳的制备工艺。
将制作的磁性阿霉素脂质体通过Sephadex G-50层析柱分离并收集未包封的阿霉素磁液洗脱液,对阿霉素磁液洗脱液稀释成在以上线性方程范围的浓度,用紫外分光光度仪检测各个标本的A 值并代入线性回归方程式计算出它的浓度。在该条件下制备的脂质体平均包封率为(30.8±3.3)%。
1.3 纳米级磁性阿霉素脂质体体外细胞毒作用检测
取人胃癌肿瘤细胞悬液50μL(含瘤细胞1×105)分别加入96孔培养板中。按处置条件分为盐酸阿霉素(DOX)组和盐酸阿霉素脂质体(DOXLIP)组,每组设置5 种不同药物浓度(盐酸阿霉素DOX 浓度):0.1、0.2、0.4、0.8、2.0μg/mL,每孔加入20μL 相应浓度的实验药物,再加培养液至200 μL,每种条件设5个复孔。同时设置瘤细胞对照组及仅含完全培养液的空白组各5孔。均置于37℃、饱和湿度5%CO2培养箱中孵育1h,每孔再加入5 mg/mL MTT 继续培养4h后,弃去培养液,每孔加入DMSO 150μL,充分振荡,在自动酶标平板阅读仪570nm 处测定吸光度(A)值,计算抑制率。
1.4 统计学分析
所有统计分析均采用SPSS 12.0 统计软件完成,组间均数比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 磁性阿霉素脂质体的粒径大小及磁响应性
按最佳工艺分别制备9个磁性阿霉素脂质体样品,用蒸馏水稀释后用Zetapal无机粒度分析仪进行测定,经动态光散射处理软件处理,得到平均粒径为(293.4±20.6)nm。在原子力显微镜下磁性阿霉素脂质体呈圆形或椭圆形,直径分布为200 ~400 nm,显微电镜照片见图1。利用磁测仪测得其磁响应性为50.28emu。

图1 磁性阿霉素脂质体的电镜图Fig.1 The magnetic DOX nanoliposomes under the electronic microscopy
2.2 纳米级磁性阿霉素脂质体体外细胞毒作用
分别收集盐酸阿霉素组和盐酸阿霉素脂质体组各个浓度作用后的人胃癌肿瘤细胞悬液,在自动酶标平板阅读仪570nm 处测定吸光度值并计算抑制率,结果见图2。对数据进行统计分析证实,盐酸阿霉素及盐酸阿霉素脂质体在体外对人低分化胃腺癌MKN45细胞均有抑制作用,并随着药物浓度增高,抑制作用增强,二者在相同浓度下的抑制率相近,差异均无统计学意义(P>0.05)。说明盐酸阿霉素脂质体和盐酸阿霉素体外抗肿瘤能力相近。
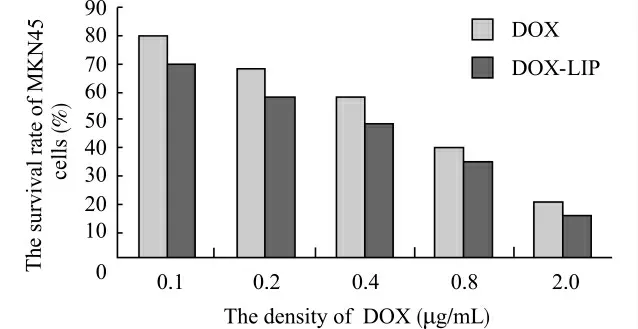
图2 MTT 法检测DOX 对胃癌细胞的抑制作用Fig.2 Inhibitory effect of DOX on MKN45cells detected by using MTT assay
3 讨论
体外研究表明[9-11],磁性阿霉素脂质体至少从3个方面发挥抗肿瘤效应:①具有良好的磁靶向性,选择性聚集于肿瘤组织,大大提高肿瘤组织内化疗药物的浓度;②脂质体包封的药物可缓慢释放,可在肿瘤组织中维持较长时间化疗药物的浓度,从而提高抗肿瘤效应;③磁性脂质体可在磁场作用下被磁化而相互聚集,栓塞肿瘤血管致肿瘤组织缺血缺氧,从而提高组织对化疗药物的敏感性。
近年来国外学者进行的动物实验证实[12]:按同一阿霉素浓度,在磁场的作用下静脉注射磁性阿霉素脂质体与单纯静脉注射阿霉素注射液的化疗效果有显著性差异,注射磁性阿霉素脂质体在有磁场作用和没有磁场作用下化疗的效果也有显著性差异;在磁场的作用下,注射磁性阿霉素脂质体后局部组织测得的阿霉素浓度是单纯注射阿霉素注射液的4倍,阿霉素脂质体利用其靶向性可以有效地治疗原发性肿瘤而减轻其他副作用。而且在交流磁场作用下可以有利于阿霉素脂质体的释放[13-14]。体外细胞毒实验表明,抗癌磁性脂质体对癌细胞具有很强的杀伤力,抗癌药物与磁性超微粒子连接后,对癌细胞的杀伤特异性增加。
磁性脂质体的疗效还与体外磁场、粒径大小、药物含量、稳定性及释药速率等因素有关,因此对其制备工艺的研究也非常重要。本次实验主要研究了磁性阿霉素脂质体的反相蒸发法制作工艺。经过正交分析得出最佳工艺为:蒸发前不进行超声粉碎、阿霉素的浓度为0.5 mg/mL、脂水相比为1∶1.5和蒸发后进行超声粉碎20 min。制作出的脂质体平均包封率为(30.8±3.3)%,平均粒径为(293.4±20.6)nm,达到纳米级标准。按本实验最佳方案用反相蒸发法制备的纳米级磁性阿霉素脂质体具有粒径小、磁响应性高和包封率高的特点,能满足进一步实验的要求。体外细胞毒实验表明在没有磁场作用下阿霉素和阿霉素脂质体体外抗肿瘤能力相近。后续研究中,我们将对阿霉素脂质体起效的相关影响因素进行探索,以进一步提升阿霉素脂质体的疗效,使之成为一种临床新型靶向治疗药物。
[1] Budinger T F,Lauterbur P C.Nuclear magnetic resonance technology for medical studies [J].Science,1984,226(4672):228-298.
[2] Fitzsimmons R J,Ryaby J T,Mohen S,et al.Combined magnetic fields increase insulin-lide,growth factor-2in TE-85human osteosarcona bone cell cultures[J].Endocrimo,1995,
[3] 136(7):3100-3106.
[3] Panyam J,Labhasetwar V.Biodegradable nanoparticles for drug and gene delivery to cells and tissue[J].Adv Drug Deliv Rev,2003,55(3):329-347.
[4] Rocha Fernanda M,de Pinho S C,Zollner R L.Preparation and characterization of affinity magnetoliposomes useful for the detection of antiphospholipid antibodies[J].J Magn Magn Mater,2001,225(1/2):101-108.
[5] 张灵芝.脂质体制备及其在生物医学中的应用[M].北京:北京医科大学中国协和医科大学联合出版社,1998:25-275.
[6] 陆彬.药物新剂型与新技术[M].北京:人民卫生出版社,1998.
[7] 常桂民,段芳龄,杨淑英,等.阿霉素脂质体的制备及包封率测定方法的研究[J].中国医院药学杂志,1999,19(6):328-331.
[8] Kubo T,Sugita T,Shimose S,et al,Targeted delivery of anticancer drugs with intravenously administered magnetic liposomes in osteosarcoma-bearing hamsters[J].Int J Oncol,2000,17(2):309-315.
[9] Kubo T,Sugita T,Shimose S,et al.Targeted delivery of anticancer drugs with intravenously administered magnetic liposomes in osteosarcoma-bearing hamsters[J].Int J Oncology,2000,17(2):309-315.
[10] Gabizon A,Price D C,Huberty J,et al.Effect of liposome composition and other factors on the targeting of liposomes to experimental tumors:biodistribution and imaging studies[J].Cancer Res,1990,50(19):6371-6378.
[11] Lübbe A S,Alexion C,Bergemann C.Clinical application of magnetic drug targeting[J].J Surg Res,2001,95(2):200-206.
[12] Kubo T,Sugita T,Shimose S,et al,Targeted systemic chemotherapy using magnetic liposomes with incorporated Adriamycin for osteosarcoma in hamsters[J].Int J Oncol,2001,18(1):121-125.
[13] Babincová M,Cicmanec P,AltanerováV,et al.AC-magnetic field controlled drug release from magnetoliposomes:design of a method for site-specific chemotherapy[J].Bioelectrochemistry,2002,55(1/2):17-19.
[14] 王华芳,胡豫,郑金娥,等.阿霉素纳米粒对白血病耐药细胞株K562/DOX 耐药逆转作用的研究[J].华中科技大学学报:医学版,2004,33(3):289-291.
