尼卡地平、尼莫地平和尼群地平毛细管电泳手性拆分研究
2012-12-22王园朝
蔡 诚,王园朝,邓 飞
(杭州师范大学材料与化学化工学院,有机硅化学及材料技术教育部重点实验室,浙江杭州 310036)
尼卡地平、尼莫地平和尼群地平毛细管电泳手性拆分研究
蔡 诚,王园朝,邓 飞
(杭州师范大学材料与化学化工学院,有机硅化学及材料技术教育部重点实验室,浙江杭州 310036)
文章以环糊精及其衍生物为手性试剂,研究了血管扩张型降压药盐酸尼卡地平、尼莫地平和尼群地平手性对映体拆分方法.采用区带毛细管电泳模式,以高磺化环糊精(HS-CD)为手性识别试剂,考察了手性试剂的类型、浓度及缓冲溶液pH值等对分离度的影响,确定了拆分尼卡地平、尼莫地平和尼群地平手性对映体的最佳条件.结果表明盐酸尼卡地平在HS-γ-CD手性选择剂存在下对映体获得基线分离,尼莫地平和尼群地平分别在HS-β-CD和HS-α-CD手性选择剂存在下对映体获得部分分离,并对其分离机理进行了初步探讨.
毛细管区带电泳;高磺化环糊精;手性对映体拆分;盐酸尼卡地平;盐酸尼莫地平;盐酸尼群地平
尼卡地平(Nicardipine,NCD)、尼莫地平(Nimodipine,NMD)和尼群地平(Nitrendipine,NTD)属第二代1,4-二氢吡啶类钙拮抗剂(DPHs),通过抑制细胞外Ca的内流、松弛血管平滑肌而起到降压作用,用于低、中度高血压病.结构中二氢吡啶环上的4位C为不对称碳原子(见图1),存在两个对映体,因在药理活性上存在着明显差异[1-2],对映体分离已引起人们广泛关注.目前对尼卡地平、尼莫地平和尼群地平的手性分离大多是利用HPLC方法,分离柱手性固定相主要有直链淀粉衍生物[3]、大环抗生素类[4]、多糖及纤维素类[5]、卵类粘蛋白[7]和卵类糖蛋白[8]等.毛细管电泳在手性分离方面具有一定的优势,其手性分离的关键是手性试剂的选择,环糊精因其特殊的空穴结构,广泛应用于手性物质的分离.在此选择羟丙基和高磺化两种类型环糊精衍生物为缓冲溶液手性添加剂,试验了上述3种结构类似药物对映体分离条件,基线分离了尼卡地平,部分分离了尼莫地平和尼群地平手性对映体,并对其分离机理进行了初步的讨论.
1 实验部分
1.1 仪器与试剂
Beckman P/ACE MDQ毛细管电泳仪,PDA检测器,32Karat软件(美国Beckman公司);熔融石英毛细管裸柱,60cm×50μm,有效长度为49cm(美国Beckman公司).
羟丙基-α,β,γ-环糊精(HP-α,β,γ-CD)(Fluka)、高磺化-α,β,γ-环糊精(HS-α,β,γ-CD)(Beckman);盐酸尼卡地平、盐酸尼莫地平和盐酸尼群地平对照品(中国药品生物制品检定所),配成浓度为1.0mg·mL-1的水溶液,1,3,6,8-pyrenetetrasulfonate(PTS)作标记物;其余试剂均为分析纯,水为去离子水.
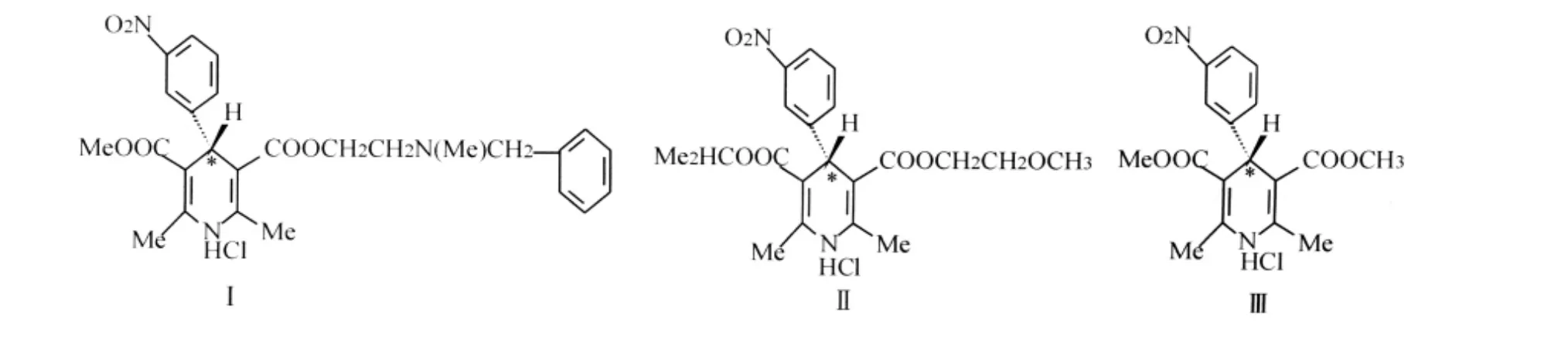
图1 尼卡地平(Ⅰ)、尼莫地平(Ⅱ)和尼群地平(Ⅲ)的化学结构图Fig.1 Chemical structures of Nicardipine(Ⅰ)、Nimodipine(Ⅱ)and Nitrendipine(Ⅲ)
1.2 实验方法
1.2.1 运行缓冲溶液的制备
于一小烧杯中取20%HS-α(β,γ)-CD水溶液5mL,水5mL和100mmol·L-1H3PO4溶液10mL,在pH计上用三乙胺调到所需pH值.即可得到含5%HS-α(β,γ)-CD的50mmol·L-1三乙胺磷酸盐缓冲溶液.使用前用0.22μm针筒过滤器过滤.
1.2.2 对照品溶液的制备
分别称取10.0mg盐酸尼卡地平、盐酸尼群地平,用少量甲醇溶解后,配成10mL的甲醇/水溶液,即得浓度为1.0mg·mL-1的贮备液,盐酸尼莫地平贮备液浓度为0.5mg·mL-1.置于冰箱中4℃保存.1.2.3 样品溶液的制备
分别取200μL浓度为1.0mg·mL-1盐酸尼卡地平、尼群地平和0.5mg·mL-1尼莫地平贮备液,加入2μL PTS混匀,置于仪器样品小管中即可.
1.2.4 毛细管柱处理方法
毛细管使用前用0.1mol·L-1NaOH溶液和水分别冲洗2min,运行缓冲溶液冲洗2min.两次进样间依次用0.1mol·L-1NaOH溶液、水和缓冲溶液各冲洗1min.
1.2.5 电泳条件
运行缓冲溶液含5%HS-α(β,γ)-CD的50mmol·L-1三乙胺磷酸盐(pH 2.5);工作电压:-15kV(反向电压);检测波长:200nm,柱温:25℃;3kPa压力进样4s.
2 结果与讨论
2.1 手性试剂的选择
实验分别选择了HP-α,β,γ-CD和HS-α,β,γ-CD为手性选择剂.在加正向分离电压(8-15kV)和pH6-9范围内,试验了HP-α,β,γ-CD对3种手性药物对映体的拆分效果,结果显示3种手性药物对映体均未获得明显的手性拆分,而在反相电压和低pH值条件下,HS-α,β,γ-CD对3种药物对映体的手性拆分都有明显的效果,只是分离程度表现不同.其中常温(25℃)下尼卡地平在HS-γ-CD中手性分离效果最好,但温度升高时,在HS-α-CD和HS-β-CD中也能获得较好的手性分离效果;尼莫地平只在HS-β-CD中手性分离效果最好;尼群地平只在HS-α-CD中手性分离效果最好.实验以尼卡地平为对象,选择HS-γ-CD为手性试剂,对实验条件进行了探讨.
2.2 缓冲溶液浓度及pH值对对映体分离度的影响
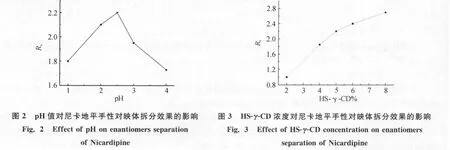
以HS-γ-CD为手性试剂,固定缓冲溶液pH值和磷酸盐浓度,分别以磷酸盐、磷酸盐-tris和磷酸盐-三乙胺进行试验,发现单纯的磷酸盐为运行缓冲溶液时电流较大,焦耳热效应明显,谱峰拓展峰形拖尾;磷酸盐-tris为缓冲溶液时,抑制了电流,使峰迁移时间过长,分离效果不理想;磷酸盐-三乙胺作缓冲溶液时,迁移时间适中,基线稳定,峰形好且分离效果好.在20~70mmol·L-1范围内,改变缓冲溶液浓度,表明在50mmol·L-1时,对映体分离效果最好.考虑到手性试剂与尼卡地平的充分作用,实验选择在较强酸性条件下进行,此时毛细管内壁硅羟基的离解被抑制,基本消除了电渗流,溶质主要依赖于自身电泳速度迁移.试验了pH值从1~4范围内变化对RS的影响,见图2.当pH值较小时,一方面环糊精试剂与尼卡地平作用力加强,使分离变好,另一方面分离时间加长,使谱峰拓宽,分离度减小;当pH值较大时,毛细管壁硅羟基部分离解,有吸附现象基线不好,分离效果变差;当pH为2.5时,基线稳定,且RS最好.故选择50mmol·L-1三乙胺磷酸盐(pH2.5)为运行缓冲溶液.
2.3 HS-γ-CD浓度对对映体分离度的影响
HS-γ-CD浓度对盐酸尼卡地平对映体分离度(RS)的影响见图3.随着选择剂HS-γ-CD浓度的增大,分离度增加,但同时离子强度增加,焦耳热效应增大.当HS-γ-CD%<5%(W/V)时,试剂与尼卡地平作用力较弱,而且此时缓冲体系粘度较小,迁移时间变短,导致分离不完全;当HS-γ-CD%>5%(W/V)时,浓度对分离度影响程度减弱,浓度太高,缓冲体系粘度较大,分离时间变长,峰形变宽.因此选择5%HS-γ-CD为最佳手性试剂浓度.
2.4 分离电压对对映体分离度的影响
柱温为25℃时,分离电压在10~25kV范围内进行实验,发现当分离电压大于20kV时,因焦耳热效应的影响,谱峰变宽,尼卡地平未能达到基线分离;而当电压低于15kV时,分离时间变长,峰形拖尾,实验选择15kV为最佳分离电压.
2.5 分离谱图
最佳条件下,盐酸尼卡地平、盐酸尼莫地平和盐酸尼群地平分别在HS-γ-CD、HS-β-CD和HS-α-CD手性选择剂存在下的对映体分离谱图(如图4所示).尼卡地平的两个手性对映体在HS-γ-CD中获得了基线分离,而尼莫地平和尼群地平均未获得基线分离.

图4 尼卡地平(a)、尼莫地平(b)和尼群地平(c)的手性对映体拆分电泳图Fig.4 Chiral seperation electropherogram of Nicardipine(a)、Nimodipine(b)and Nitrendipine(c)
2.6 手性识别机理讨论
一般认为环糊精对分子手性拆分的机理主要有两个方面,其一是环糊精杯状结构内腔尺寸大小的空间匹配作用,其二是环糊精外缘端-OH与手性分子间的氢键作用.但在以前的研究中,笔者发现在低pH值条件下叔胺类药物与高磺化环糊精之间还存在一定的静电引力作用,有时静电引力作用对手性对映体的拆分起着决定性的作用[9].该实验中尼卡地平、尼莫地平和尼群地平分别在HS-γ-CD、HS-β-CD和HS-α-CD中获得较好的手性拆分效果,这是环糊精与客体空间匹配作用的结果.但尼卡地平在升温条件下(35℃),以HS-α(β)-CD为手性选择剂时,也可获得好的拆分效果,而其它两种物质没有此现象.这是因为含有叔氨基的尼卡地平,酸性条件下能获得一个质子成为季胺盐而带正电,可与高磺化环糊精中-SO-3产生静电引力作用.温度较高时,分子运动速率加快,主客体间的空间匹配和氢键作用影响减弱,静电引力作用在手性对映体拆分中起主要影响作用.
[1]Jamali F,Mehvar R,Pasutto FM.Enantioselective aspects of drug action disposition:therapeutic pitfalls[J].J Phram Sci,1989,78(9):695-715.
[2]Mast V,Fischer C,Mikus G,etal.Use of pesudoracemic nitrendipine to elucidate the metabolicsteps for stereoselective disposistion of nitrendipine enantiomers[J].Br J Clin Pharmacol,1992,33(1):51-54.
[3]陈仲益,姚彤炜,曾苏.CHIRALPAK AD柱在14种药物手性分离中的应用[J].中国药学杂志,2007,42(7):544-547.
[4]李凌云,钱宝英,高如瑜,等.万古霉素手性固定相分离几种药物对映体[J].分析测试学报,2003,22(6):83-85.
[5]宫丽,贺浪冲,任文艳,等.尼群地平对映体在Chiralcel OJ柱上的拆分特性研究[J].中国药业,2006,15(3):23-24.
[6]邹公伟,郑琦,胡冠九,等.高效液相色谱中的纤维素衍生物手性固定相[J].分析化学,1995,23(4):466-473.
[7]Ohkubo T,Uno T,Sugawara K.Enantiomer separation of dihydropyridine derivative calcium antagonists by high-performance liquid chromatography with chiral stationary phases[J].J Chromatogr,1994,659(2):467-471.
[8]傅强,贺浪冲.卵类糖蛋白手性柱拆分钙离子拮抗剂尼卡地平对映体[J].分析化学,2005,33(12):1779-1782.
[9]王园朝,金瑛芝,罗经文.10种手性药物对映体毛细管电泳拆分方法及机理探讨[J].分析科学学报,2009,25(1):21-25.
Study on the Enantiomeric Separation of Nicardipine,Nimodipine and Nitrendipine by Capillarary Electrophoresis
CAI Cheng,WANG Yuan-chao,DENG Fei
(College of Material,Chemistry and Chemical Engineering,Key Laboratory of Organosilicon Chemistry and Material Technology of Ministry of Education,Hangzhou Normal University,Hangzhou 310036,China)
Enantioseparation methods of antihypertensive vasodilator nicardipine,nimodipine and nitrendipine were studied using cyclodextrin and its derivatives as chiral reagents.Many factors such as the type of chiral reagent and its concentration,pH of buffer on resolution(Rs)were investigated using high sulfonated cyclodextrin(HS-CD)as chiral recognition reagent with capillary zone electrophoresis,and the optimized conditions of enantioseparation of nicardipine hydrochloride,nimodipine and nitrendipine were defined.The results indicate that nicardipine hydrochloride,nimodipine and nitrendipine are well separated with chiral reagent HS-γ-CD,HS-β-CD and HS-α-CD respectively.The paper discussed their separation mechanisms.
capillary electrophoresis;highly sulfated cyclodextrins;enantioseparation;nicardipine;nimodipine;nitrendipine
R917
A
1674-232X(2012)02-0122-04
11.3969/j.issn.1674-232X.2012.02.006
2011-04-13
浙江省自然科学基金项目(Y406237);浙江省科技厅科技计划项目(2007F70051).
王园朝(1965—),男,教授,主要从事分子光谱及毛细管电泳分析方法研究.E-mail:wangyc1819@126.com
