加丽素红中角黄素在鸡体内的药代动力学研究
2012-12-20杨兰兰徐昆龙何梦恒史崇颖
田 洋 杨兰兰 徐昆龙* 肖 蓉 李 栋 何梦恒 史崇颖
(1.云南农业大学食品科学技术学院,昆明 650201;2.云南农业大学动物科学技术学院,昆明 650201)
加丽素红为瑞士罗氏公司生产的化学合成类饲料着色剂,有效成分为10%的角黄素[1],主要用于增加家禽皮肤、脚胫、蛋黄以及水产动物体表、肌肉组织的色泽,已被广泛应用在我国蛋禽饲粮和三黄鸡饲粮中,使用率达到60%左右[2]。国内市场上出现的“红心蛋”就是由于饲粮中添加了加丽素红致使蛋黄呈现诱人的红色。随着一些报纸、网站等新闻媒体对“红心蛋”各种评论的不断升温,加丽素红在饲料中使用的安全性引起了消费者的高度关注[3]。
角黄素(又叫斑蝥黄,斑蝥黄质,canthaxanthin)为一种非维生素A原酮式类胡萝卜素,分子式为C40H52O2,相对分子质量为 564.9,化学名称为β,β'- 胡萝卜素 -4,4'- 二酮[4-5]。2008 年我国农业部公布的第1 126号文件中允许使用的8种着色剂中包含角黄素,并规定了适用范围为家禽[6]。近年来,角黄素作为饲料着色剂滥用现象日益严重,其危害性引起了各国的高度重视,揭示角黄素在动物体内的代谢动力学参数是产生、决定或阐明其毒性大小的基础。目前国内外关于角黄素在动物体内药代动力学特征的研究较少,且大部分集中在虹鳟鱼等水产动物上,关于对其在家禽体内的药代动力学特征却鲜见报道。
本研究利用药物代谢动力学的方法,通过不同时间测定鸡血清中角黄素的质量浓度,求出相应的药物代谢动力学参数,从而阐明其在鸡体内的药物代谢动力学特征,以期为加丽素红在毒理学方面的研究及其在畜牧养殖业中合理使用提供科学依据。
1 材料与方法
1.1 试剂与药品
加丽素红,含10%角黄素,瑞士罗氏公司;角黄素标准品,批号CA10947000,纯度为96.0%,德国 Dr.Ehrenstorfer公司;甲醇、乙腈、正丙醇、正己烷、N,N-二甲基甲酰胺、无水硫酸钠均为色谱纯。
1.2 仪器
Vortex genius 3旋涡混匀器,德国IKA公司;3-30K冷冻离心机,德国Sigma公司;TH2-320台式恒温振荡器,上海精宏实验设备有限公司;Waters2695高效液相色谱仪附紫外检测器,美国Waters公司;HR2864飞利浦三合一搅拌器,荷兰皇家飞利浦电子公司;SB3200超声波清洗仪,美国伯明斯顿公司;BUCHI R-200旋转蒸发仪,瑞士BUCHI公司;T-4002电子分析天平,美国丹佛仪器公司。
1.3 试验动物
选用12只健康的19周龄海兰白壳蛋鸡为研究对象,平均体重为(1.25±0.09)kg,购买于云南昆明某鸡场。在封闭的动物房,饲养于雏鸡笼中,自由饮水和采食。
1.4 试验饲粮
基础饲粮为玉米-豆粕型,其组成及营养水平见表1。
1.5 给药及样品采集
加丽素红悬液经口灌胃给予鸡的剂量为9.6 mg/kg BW,给药前禁食12 h,自由饮水。采血时间分别为给药后的 1、2、4、6、8、10、12、24、36、72 h,翅静脉采血,血样置于刻度试管中,放置成斜面,放入 37℃水浴锅中作用 30 min,然后以4 000 r/min离心10 min,即得血清。血清样品置-20℃冰箱中保存备用。
1.6 样品处理
准确吸取血清1.0 mL于50 mL离心管中,加入30 mL乙腈和3 g无水硫酸钠,旋涡混匀1 min,振荡10 min,超声1 min,然后以3 000 r/min离心5 min,将上清液移入预置有20 mL正己烷的分液漏斗中,混匀后静置分层;收集下层乙腈相。按上述步骤对离心管中残留物每次用20 mL乙腈再重复提取2次,合并3次提取乙腈相,加入5 mL正丙醇,于40℃以下旋转蒸发浓缩至干。
准确吸取5 mL乙腈,至于旋转蒸发瓶内,超声1 min,充分混匀内容物置于测定瓶内,经0.45μm微孔滤膜过滤后直接上机测定。

表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet(air-dry basis) %
1.7 数据处理
将试验所得血药浓度数据采用中国药理学数学专业委员会编制的3P97药物代谢动力学程序软件,在微机上进行曲线拟合,以Akaike’s信息数据的最小信息准则(AIC)值、残差平方和(Re)和拟合度(r2)为标准确定最佳房室模型,并计算出药物代谢动力学参数。试验数据均以平均值±标准差表示。
2 结果与分析
2.1 鸡血清中角黄素质量浓度的测定结果
鸡口服给予加丽素红后角黄素在血清中的质量浓度测定结果见表2。同时测定了不同鸡血清中的角黄素质量浓度,其结果标准差较小,说明加丽素红中角黄素在不同鸡体内的代谢过程较为稳定。

表2 鸡口服给予加丽素红(9.6 mg/kg BW)后角黄素在血清中的质量浓度Table 2 Canthaxanthin concentration in serum of chickens following oral administration of Carophyll Red at a dose of 9.6 mg/kg BW
2.2 加丽素红中角黄素的血药浓度-时间曲线
鸡口服给予加丽素红后角黄素在其体内的血药浓度 -时间曲线见图1。可知,鸡口服9.6 mg/kg BW加丽素红后,首先进入吸收相,给药后1 h可检测到角黄素,在0~10 h,血清中角黄素浓度迅速上升,达峰时间为10 h,峰浓度为(0.362±0.015)μg/mL;随后进入消除相,在10~24 h,血清中角黄素浓度迅速下降到(0.108±0.005)μg/mL,在 24 ~72 h,下降变得缓慢。
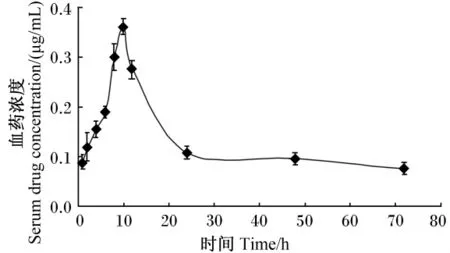
图1 鸡口服给予加丽素红后角黄素在其体内的血药浓度-时间曲线Fig.1 Serum drug concentration-time curve of canthaxanthin concentration in serum of chickens following oral administration of Carophyll Red
2.3 房室模型的选择
为验证房室数,本试验用Akaike’s信息数据法的AIC值、Re和r2的方法对于一室及二室的契合程度进行了比较(表3)。可知,一室与二室模型比较后的Re值以一室为小,r2值以一室为大,AIC值以一室为小,因此3种方法均表明鸡口服加丽素红后角黄素的血药浓度-时间数据属一室模型。

表3 3种方法对角黄素一室及二室契合程度的比较Table 3 Comparison one-compartment model to two-compartment model with three methods
2.4 药代动力学参数
用3P97药动学软件对各时间点血清中角黄素质量浓度进行数据处理后发现(表4),加丽素红经鸡口服后,角黄素在鸡体内的代谢过程可按一室模型一级动力学拟合,其理论方程为C=0.471(e-0.036- e-0.190),药代动力学的主要参数为:吸收半衰期 t1/2(Ka)=(3.643 ±0.205)h,消除半衰期 t1/2(Ke)=(19.263 ±1.312)h,达峰时间Tmax=(10.795 ± 1.007)h,达 峰浓度 Cmax=(0.259±0.048)μg/mL,血药浓度 - 时间曲线下面积 AUC=(10.607 ±1.029)μg/(mL·h),总体清除率 CLB=(0.905 ±0.076)L/(kg·h),表观分布容积 Vd=(2.515±0.133)L/kg。结果表明角黄素在鸡体内吸收迅速,较快达到峰浓度,分布广泛,消除较慢。

表4 鸡口服给予加丽素红后其角黄素的药代动力学参数Table 4 Pharmacokinetic parameters of canthaxanthin in chickens following oral administration of Carophyll Red
3 讨论
角黄素作为一种饲料着色剂被广泛用于我国蛋鸡饲料中,主要增加鸡的脚胫、皮肤以及蛋黄的颜色,使其呈现鲜艳的诱人色泽,增加其商业价值。本试验选用19周龄已经产蛋的海兰蛋鸡(产蛋的平均周龄为18周)为研究对象,符合角黄素在家禽养殖业中的实际使用情况,因此对于阐明角黄素在鸡体内的药代动力学特征更具有现实意义。
Nierenberg[7]和 Sapuntzakis 等[8]报道了血清中类胡萝卜素的含量比血浆中类胡萝卜素的含量高了10%,为了提高试验过程的准确性和精密度,应选用鸡的血清来进行试验。
本试验中所得的血药浓度-时间数据经3P97软件分析处理,分别按一室、二室模型进行模拟,根据AIC值、Re值和r2值,确定鸡口服加丽素红后,角黄素在体内的代谢过程符合一级吸收一室模型。Gobantes等[9]报道了加丽素红经口服给予虹鳟鱼后,角黄素在其体内也符合一级吸收一室模型,这说明角黄素在不同的动物体内代谢方式基本相似,都为一级吸收一室模型。
Tmax是指药物经血管外给药吸收后达到药峰浓度所需的时间,是反映药物在体内吸收速率的一个重要指标,与吸收速率常数相比,它能更直观和准确地反映出药物的吸收速率,因此更具有实际意义[10]。鸡单剂量口服给予加丽素红后血清中角黄素质量浓度的最高峰出现在10 h,而在虹鳟鱼和牛的动物体内达峰时间分别为12和8 h,在人体内达峰时间为 6 h[9,11-13],这说明角黄素在鸡体内的吸收速率要快于虹鳟鱼,而慢于牛和人,这可能与动物的种属有很大关系,但其他的因素也可能会影响这一结果,比如给予药物的剂型、动物的生长环境(pH和温度)以及能够使动物生理状态发生变化的外界因素等[9]。
t1/2(Ka)是指药物经口服后消化道吸收了药物1/2所需要的时间;t1/2(Ke)是指药物在体内消除1/2所需要的时间,即血药浓度下降1/2所需要的时间。角黄素在鸡体内的t1/2(Ka)比在虹鳟鱼中的t1/2(Ka)低了27.29%,而t1/2(Ke)却比虹鳟鱼的t1/2(Ke)高了52.52%[9],说明角黄素在鸡体内吸收迅速,但是消除半衰期却慢于虹鳟鱼;同时Choubert等[14]研究发现角黄素经静脉注射到虹鳟鱼体内后的消除速度要比经口服给予虹鳟鱼后的消除速度快约4倍,这可能是由于口服给药后角黄素要经过胃肠道的吸收后才进入血液循环,延长了角黄素在鸡体中滞留的时间。
药物消除是指促使药物由体内丧失(代谢和排泄)的各种过程的总和。角黄素作为一种非维生素A原的类胡萝卜素在鸡体内不能合成维生素A,本试验中未发现角黄素发生降解的现象,提示角黄素在鸡体内的消除可能大部分是通过排泄方式完成的,这与文献报道的角黄素经口服后在动物体内只有3% ~8%被吸收、粪便排泄是主要的消除途径(比如猴子中85%~89%的角黄素经粪便排出体外)的研究结果[15]相一致。
CLB是指体内诸消除器官在单位时间内消除药物的血浆容积,是肝脏、肾脏、肺脏以及其他消除途径消除率的总和,与动力学模型无关。在描述药物消除中,CLB考虑到表观分布容积和消除半衰期两者的变化,是一个比消除半衰期更有用的药物消除测量指数[16-18]。本试验中角黄素在鸡体内的CLB为0.905 L/(kg·h),而虹鳟鱼中角黄素的CLB为0.0173 L/(kg·h),说明角黄素在鸡体中的总体清除速率要高于虹鳟鱼。但由图1可知,角黄素经口服灌胃后,在10~24 h,血清中角黄素浓度迅速减少,而24 h后其浓度在血清中清除非常缓慢,基本维持稳定。综合分析,角黄素在鸡体内的消除速度较慢。
Vd值是指体内药物总量待平衡后,按测得的血浆药物浓度计算时所需的体液总体积。它的大小可以反映药物分布的广泛程度。如果药物在体内均匀分布,当Vd值大于1.0 L/kg时,则药物的组织浓度高于血浆浓度,药物在体内分布广泛,或者组织蛋白对药物有高度结合[10,17]。本试验中经口服给予鸡角黄素后发现,Vd值(2.515 L/kg)约高于虹鳟鱼中Vd值的12倍,这一结果提示了角黄素在鸡体内分布可能非常广泛。Tyczkowski等[19]的报道也验证了这一推论,他们研究发现角黄素经口服给予鸡后能够在空肠、大肠、血清、肝脏、脚趾、肌肉、脂肪、皮肤、卵巢等组织器官中检出。
AUC与吸收后体循环的药量成正比例,它反映进入体循环药物的相对量,是计算生物利用度的 基 础 数 值[10]。 本 试 验 中 AUC 为10.607μg/(mL·h),明 显 低 于 虹 鳟 鱼 中 的52.9μg/(mL·h),但由于给药剂量、剂型等因素不同,所以还不能说明鸡体中角黄素的吸收率一定低于虹鳟鱼。要比较角黄素在不同动物体内的吸收率还需要计算经静脉注射后角黄素的AUC值,从而求出生物利用率进行比较。
4 结论
加丽素红经鸡口服后,角黄素在鸡体内的代谢过程符合一级吸收一室模型,且具有吸收迅速、较快达到峰浓度、在组织器官中分布广泛、体内消除速度较慢等特点。
[1] 张克英,陈代文,袁中彪.加丽素黄与加丽素红对肉鸡脚胫和胴体着色程度的影响[J].饲料博览,2000,(1):6 -8.
[2] 张院萍.红心蛋到底好不好[J].中国牧业通讯,2005(13):86-87.
[3] 杨振海.饲料着色剂已成为必需的饲料添加剂[J].中国饲料,2004(7):4-6.
[4] 汪洪涛,徐学明,金征宇.角黄素的性质与开发应用[J].粮食与饲料工业,2003(6):31 -32.
[5] BAKE R T M.Canthaxanthin in aquafeed applications:is there any risk?[J].Trends in Food Science and Technology,2001,12(7):240 -243.
[6] 张华,杨鑫,马莺,等.饲料中角黄素的高效液相色谱法测定[J].分析测试学报,2008,27(7):785-787.
[7] NIERENBERG D W.Determination of serum and plasma concentrations of retinol using high performance liquid chromatography[J].Journal of Chromatography,1984,311(2):239 -248.
[8] SAPUNTZAKIS M,BOWEN P E,KIKENDALL J W,et al.Simultaneous determination of serum retinoland various carotenoids:their distribution in middleaged men and women[J].Journal of Micronutrient A-nalysis,1987,3:27 -45.
[9] GOBANTESI,CHOUBERT T G,LAURENTIE M,et al.Astaxanthin and canthaxanthin kinetics after ingestion of individual doses by immature rainbow trout oncorhynchus mykiss[J].Journal of Agricultural and Food Chemistry,1997,45(2):454 -458.
[10] 王广基.药物代谢动力学[M].北京:化学工业出版社,2005:95-97.
[11] BIERER T L,MERCHEN N R,ERDMAN JW.Comparative absorption and transport of five common carotenoids in preruminant calves[J].The Journal of Nutrition,1995,125(6):1569 -1577.
[12] GARTNER C,STAHL W,SIES H.Preferential increase in chylomicron levels of xanthophylls lutein and zeaxanthin compared to beta-carotene in the human[J].International Journal for Vitamin and Nutrition Research,1996,66(2):119 -125.
[13] KOSTIC D,WHITE W S,OLSON J A.Intestinal absorption,serum clearance and interactions between lutein andβ-carotenewhen administered to human adults in separate or combined oral doses[J].The American Journal of Clinical Nutrition,1995,62:604 -610.
[14] CHOUBERT G,CRAVEDI J P,LAURENTIE M.Pharmacokinetics and bioavailabilities of 14C-keto-carotenoids,astaxanthin and canthaxanthin,in rainbow trout,Oncorhynchus mykiss[J].Aquaculture Re-search,2005,36(15):1526 -1534.
[15] EFSA Panel on Food Additives and Nutrient Sources Added to Food(ANS).Scientific opinion on the re-evaluation of canthaxanthin as a food additive[J].EFSA Journal,2010,8(10):1852 - 1894.
[16] 梁文权.生物药剂学与药物动力学[M].北京:人民卫生出版社,2007:12-23.
[17] 夏盖尔,吴幼玲,余炳灼.应用生物药剂学与药物动力学[M].北京:化学工业出版社,2006:35-78.
[18] 苏成业,韩国柱.临床药物代谢动力学[M].北京:科学出版社,2003:30-35.
[19] TYCZKOWSKI J K,HAMILTON P B.Absorption,transport and deposition in chicken of lutein diester,a carotenoid extracted from marigold petals[J].Poultry Science,1986,65:1526-1531.
