不同硒源及水平对肉鸡组织硒含量及抗氧化功能的影响
2012-12-20田金可AhmadHussain
田金可 Ahmad Hussain 李 伟 高 尚 王 恬
(南京农业大学动物科技学院,南京 210095)
硒作为谷胱甘肽过氧化物酶(GSH-Px)的重要组分,是机体中一种必需的微量元素,它在细胞中的抗氧化作用类似于维生素E[1]。此外,硒在机体内还参与细胞和体液免疫及内分泌激素的调节[2]。在现代养殖业中,动物补硒一直使用的是价格低廉的无机硒源[以亚硒酸钠(SS)为主]。但是它的生物利用率较低,毒性较大,而且动物排泄的硒易造成土壤和环境的污染[3]。甚至诸多报道认为,无机硒可能有过氧化特性[4-5]。因此,生物利用率更高、毒性更小的有机硒的应用受到了越来越多的关注。酵母硒(SY)就是其中一种,早在2001年就被美国食品和药物管理局(FDA)批准用于猪饲粮中。有研究表明,动物饲粮中添加有机硒不但能够降低硒排泄量,而且能够增加动物体组织中硒的沉积量[1]。近年来,关于不同硒源对畜禽生产性能、组织硒沉积量、抗氧化功能及肉品质影响的报道较多,然而对不同硒源的比较应用效果的研究较少。为此,本试验旨在研究并比较肉鸡饲粮中添加不同硒源(亚硒酸钠和酵母硒)及水平对机体组织硒含量和抗氧化功能的影响,并探讨较低水平的有机硒替代无机硒的可行性。
1 材料与方法
1.1 试验材料
亚硒酸钠(分析纯),硒含量为45.5%,天津市化学试剂研究所产品;酵母硒,硒含量为1 000 mg/kg,武汉新华扬生物股份有限公司提供。
AFS-310双道原子荧光光度计,北京科创海光仪器有限公司生产;全波长酶标仪,美国Thermo Scientific公司生产;智能样品处理器,北京莱伯泰科仪器有限公司生产。
1.2 试验设计与饲粮配制
选用1日龄健康、体重相近(P>0.05)的爱拔益加(AA)肉仔鸡600只,按单因子完全随机设计分为5组,每组6个重复,每个重复20只鸡。对照组(Cont):饲喂基础饲粮(不添加硒,测得硒含量为0.11 mg/kg);试验1组(SS组):饲喂基础饲粮+0.30 mg/kg硒(以亚硒酸钠形式);试验2组(SYⅠ组):饲喂基础饲粮+0.20 mg/kg硒(以酵母硒形式);试验3组(SYⅡ组):饲喂基础饲粮+0.30 mg/kg硒(以酵母硒形式);试验 4组(MS组):饲喂基础饲粮 +0.30 mg/kg混合硒(0.15 mg/kg亚硒酸钠 +0.15 mg/kg 酵母硒)。试验期42 d,期间共进行2次称重(21和42 d),称重前1天18:00断料(不断水),第2天06:00空腹称重和结料,分别计算平均日采食量(ADFI)、平均日增重(ADG)和料重比(F/G)。
基础饲粮参照NRC(1994)标准配制,其组成及营养水平见表1。

表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of basal diets(air-dry basis) %
每千克饲粮提供 One kilogram of the diets contained the following:Fe 60 mg,Cu 7.5 mg,Zn 65 mg,Mn 110 mg,I 1.1 mg,杆菌肽锌 bacitracin zinc 30 mg,VA 4 500 IU,VD31 000 IU,VE 30 IU,VK 1.3 mg,VB12.2 mg,VB210 mg,VB310 mg,氯化胆碱 choline chloride 400 mg,VB550 mg,VB64 mg,生物素 biotin 0.04 mg,VB111 mg,VB121.013 mg。
1.3 饲养管理
饲养试验在南京康欣禽业有限公司进行。试验前对雏舍及器具进行冲洗和烧碱水喷雾消毒,福尔马林和高锰酸钾(每立方米加30 mL福尔马林、15 g高锰酸钾)熏蒸12 h,净化1周后开始试验。试验鸡采用笼养,自由采食和饮水,喂料遵循少喂勤添的原则。1~14 d温度控制在32~34℃,以后每周下调2℃,直至26℃。12 h光照周期(06:00—18:00光照)。
1.4 样品的采集与制备
分别于试验第21天和第42天06:00(此前停饲12 h,自由饮水)每个重复随机抽取1只鸡,称重后颈静脉采血,收集于加有肝素钠的试管中,4℃、3 500 r/min离心10 min制备血浆,-20℃保存备用。立即将鸡只放血致死(注意要放血完全),迅速剖开腹腔取出肝脏,剥离胸肌,装入自封袋中。将肝脏和胸肌制成10%的组织匀浆液,于-20℃冰箱保存。
1.5 测定指标及方法
1.5.1 抗氧化功能指标的测定
血浆和肝脏中GSH-Px活性测定采用二硫代硝基苯甲酸法;总超氧化物歧化酶(T-SOD)活性测定采用黄嘌呤氧化酶法;总抗氧化能力(T-AOC)测定采用菲啉比色法;过氧化氢酶(CAT)活性测定采用钼酸铵比色法;丙二醛(MDA)含量测定采用硫代巴比妥比色法。上述指标的测定均采用商业化的试剂盒(南京建成生物工程研究所提供),操作按试剂盒说明书进行。
1.5.2 组织硒含量的测定
参照GB/T 13883—2008的方法处理样品并定容,同时分别用超纯水和硒标准液做空白对照和标准参照物对照,利用氢化物发生-原子荧光光谱法测定饲粮、血浆、肝脏、肌肉中硒含量。
1.6 数据处理
采用SPSS 16.0统计软件进行数据分析。所有数据均以平均值±标准误表示。用one-way ANOVA比较各组间的差异。采用最小显著极差法(LSD)对差异显著的数据进行多重比较。
2 结果
2.1 不同硒源及水平对肉鸡生长性能的影响
从表2可以看出,与对照组相比,饲粮添加0.30 mg/kg的有机硒(SYⅡ组)显著降低了肉鸡前期(1~21 d)的ADFI(P<0.05);较对照组及无机硒组(SS组),饲粮添加各水平有机硒(SYⅠ、SYⅡ和MS组)均显著降低了全期(1~42 d)的ADFI(P <0.05或 P <0.01);同时,各添加有机硒组后期(22~42 d)的ADFI也有降低趋势(P>0.05)。虽各试验组肉鸡的ADG及F/G均无显著变化(P>0.05),但F/G均在一定程度上低于对照组;其中,前期SS组和SYⅡ组、后期及全期SYⅠ组和MS组的F/G均较低。
2.2 不同硒源及水平对肉鸡组织硒含量的影响
就前期而言,与对照组相比,SYⅠ组和SYⅡ组肉鸡血浆中的硒含量均显著提高(P<0.05),SYⅠ组肉鸡肝脏中的硒含量显著提高(P<0.05);较对照组与SS组,MS组、SYⅠ组和SYⅡ组肉鸡胸肌中的硒含量分别提高了107.69%、123.08%和176.92%(P <0.01);而较 SYⅠ组与MS组,SYⅡ组肉鸡胸肌中的硒含量也显著提高了(P<0.01)。在试验后期,与对照组、SS组和MS组相比,SYⅠ组和SYⅡ组肉鸡血浆中的硒含量均显著提高(P<0.01或P<0.05);较对照组和 SS组,MS组、SYⅠ组和SYⅡ组肉鸡肝脏中的硒含量也显著提高(P<0.01或 P<0.05);后期胸肌中硒含量的变化规律与前期一致,较对照组和SS组,MS组、SYⅠ组和SYⅡ组肉鸡胸肌中的硒含量均显著提高(P<0.01),且3组中SYⅡ组含量最高。然而,与对照组相比,饲粮中添加0.30 mg/kg的无机硒均未显著影响各组织的硒含量(P>0.05)。
2.3 不同硒源及水平对肉鸡抗氧化功能的影响
由表4可以看出,就前期而言,与对照组相比,SS组和SYⅠ组肉鸡肝脏T-SOD的活性显著提高(P<0.01);SYⅡ组肉鸡血浆GSH-Px的活性及肝脏T-SOD的活性提高也达到了显著水平(P<0.05);而MS组的各抗氧化指标均无显著变化(P>0.05)。同样在前期,与SS组相比,SYⅠ组肉鸡血浆T-SOD的活性显著提高(P<0.05);SYⅡ组肉鸡血浆T-SOD和GSH-Px的活性均显著提高(P<0.05);MS组肉鸡血浆GSH-Px的活性显著提高(P<0.05),但肝脏T-SOD的活性却显著降低了(P<0.05)。在试验后期,较对照组,SS组肉鸡血浆及肝脏GSH-Px的活性均显著提高(P<0.01或P<0.05);SYⅠ组肉鸡血浆及肝脏GSHPx的活性也均显著提高(P<0.01),血浆MDA的含量显著降低(P<0.05);SYⅡ组肉鸡血浆及肝脏GSH-Px的活性均显著提高(P<0.05或 P<0.01),血浆MDA的含量也显著降低(P<0.05);而MS组肉鸡肝脏 GSH-Px(P<0.01)和 CAT(P<0.05)的活性也均显著提高,血浆MDA的含量显著降低(P<0.01)。而与SS组相比,仅 MS组肉鸡血浆MDA含量显著降低(P<0.05)。与MS组相比,SYⅠ组肉鸡血浆GSH-Px的活性也显著提高(P <0.05)。

表2 不同硒源及水平对肉鸡生长性能的影响Table 2 Effects of different selenium sources and levels on growth performance of broilers

表3 不同硒源及水平对肉鸡组织硒含量的影响Table 3 Effects of different selenium sources and levels on selenium content in tissue of broilers
3 讨论
3.1 不同硒源及水平对肉鸡生长性能的影响
本研究发现,添加有机硒显著降低了全期肉鸡ADFI,而各试验组对ADG及F/G均未产生显著影响,表明添加有机硒在一定程度上可以节约饲料量,降低生产成本。关于硒能改善肉鸡生长性能的报道,多见于改善其F/G。Wang等[6]研究发现,添加0.2 mg/kg的无机硒或酵母硒均显著降低了肉鸡的F/G;也有报道认为有机硒不但能显著降低F/G,还能显著提高肉鸡的体重[7];夏枚生等[8]也报道,饲粮添加 0.4 ~1.0 mg/kg 硒(纳米硒、亚硒酸钠)时,纳米硒组肉鸡生长性能显著高于亚硒酸钠组。然而,也有诸多研究认为,饲粮添加不同硒源均未对肉鸡的生长性能产生显著影响[9-10]。这也可能是由试验动物、试验条件等不同造成的。
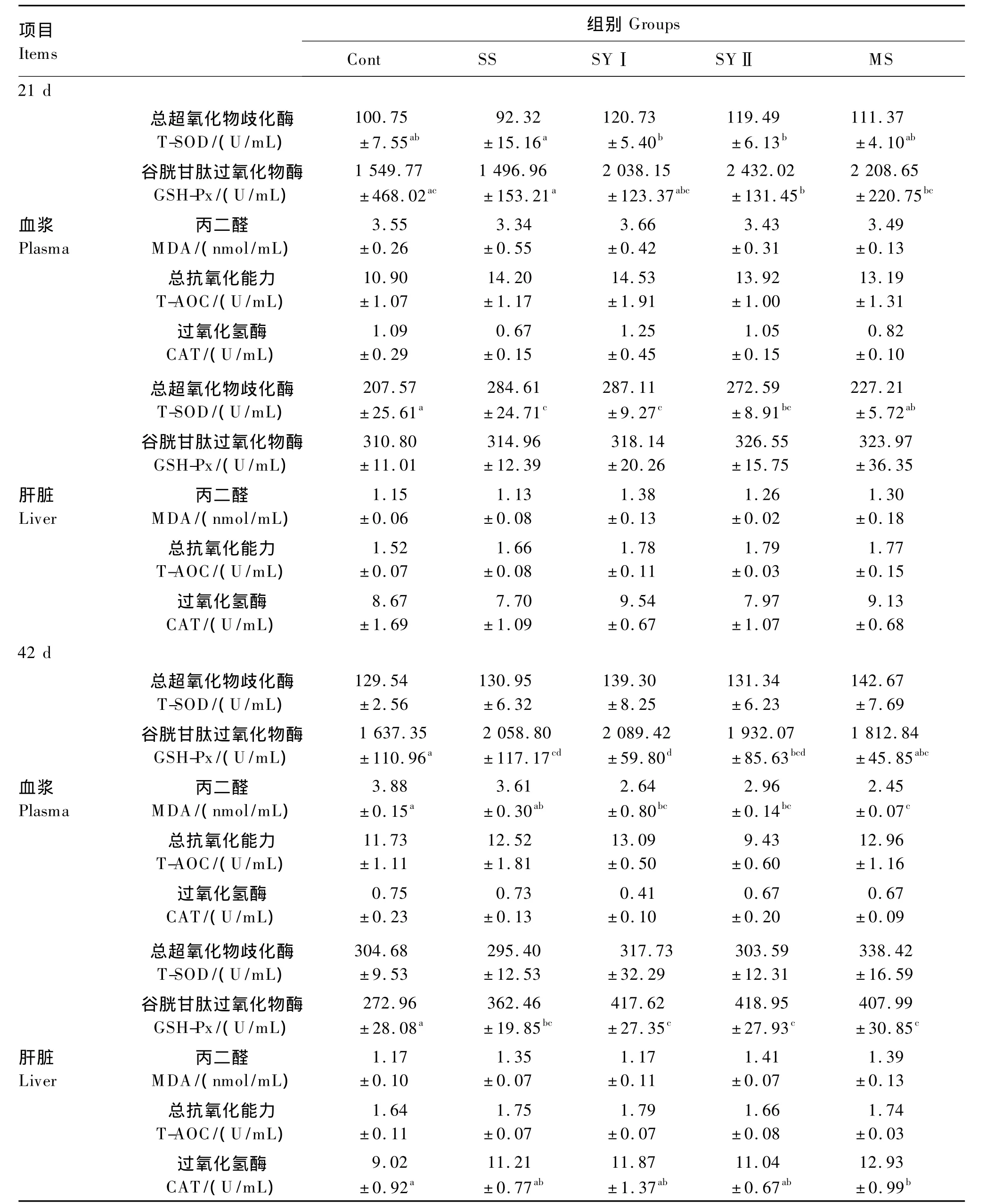
表4 不同硒源及水平对肉鸡抗氧化功能的影响Table 4 Effects of different selenium sources and levels on antioxidant capacity of broilers
3.2 不同硒源及水平对肉鸡组织硒含量的影响
本试验中,饲粮添加有机硒不同程度地提高了各组织硒含量,而无机硒则没有这样的效果。Wang 等[9]在罗斯肉鸡饲粮中添加 0.15 mg/kg 的无机硒或硒代蛋氨酸,结果表明,较无机硒,有机硒显著提高了肉鸡血清、肝脏及胸肌中的硒含量。Ševcˇíková 等[11]也报道,与对照组相比,饲粮添加0.3 mg/kg的酵母硒显著提高了肉鸡肝脏和胸肌中的硒含量。在其他动物(育肥猪、羔羊、肉牛)的试验[12-14]中也得到了类似的结果。这说明有机硒的生物利用率较无机硒高,而就其机理而言,这应该与不同硒源的代谢途径有关。有报道认为:在无机硒的代谢途径中,仅有很少量的无机硒结合入体蛋白中,大多数未能用于合成硒蛋白的硒则进入肾脏,最终排出体外;而有机硒中的硒与含硫氨基酸类似,在蛋白质的合成中硒代氨基酸常常替代含硫氨基酸而结合入蛋白质中,因此有机硒(酵母硒、硒代蛋氨酸等)能增加机体总硒的贮存量,为硒在组织中的贮存提供了一个硒库,硒以有机的形式贮存[15]。本试验中添加有机硒极显著提高了胸肌中的硒含量,这与Pan等[16]在罗曼蛋鸡上得到的结果相类似。有机硒能显著提高肌肉或鸡蛋中硒的含量,这也为提高人类硒的摄入量、改善硒的补充水平提供了可行的措施[17]。
3.3 不同硒源及水平对肉鸡抗氧化功能的影响
机体的抗氧化体系由酶促体系和非酶促体系共同组成。酶促抗氧化体系主要包括GSH-Px、谷胱甘肽还原酶(GSH)、超氧化物歧化酶(SOD)和CAT等,非酶促抗氧化体系主要有维生素E、胡萝卜素、维生素C、蛋氨酸和乳铁蛋白等[18-19]。硒在酶促抗氧化体系中扮演了重要角色,并通过具有酶功能的含硒蛋白、硒核酸等发挥作用。本试验结果显示,饲粮添加硒对机体的酶促体系发挥抗氧化功能起到了促进作用。MDA是自由基触发脂质过氧化物反应生成的终产物,它能使含氨基的蛋白质、核酸、脑磷脂等失活,其含量可反映机体脂质过氧化的程度,间接反映细胞的受损程度[20]。本试验中各添加有机硒组肉鸡后期血浆MDA的含量显著降低。Wang等[6]报道,饲粮添加不同硒源(亚硒酸钠、酵母硒)均显著提高了肉鸡血浆和肝脏GSH-Px的活性,且较添加相同水平的无机硒,各添加有机硒组肉鸡的血浆GSH-Px的活性也显著提高;夏枚生等[8]在岭南黄肉鸡的研究中也发现纳米硒组肉鸡全血GSH-Px的活性显著高于亚硒酸钠组;这均与本试验的结果相一致。Mikulski等[21]报道,较对照组和添加同水平的无机硒组,饲粮添加0.3 mg/kg酵母硒显著提高了8周龄火鸡全血T-SOD的活性,与本试验结果也是相符的。Zhan等[12]对育肥猪的试验研究表明,0.3 mg/kg的不同硒源均显著提高了猪肝脏和肌肉中GSH-Px的活性,显著降低了MDA的含量,且有机硒效果更好。在本试验中,饲粮中添加0.20 mg/kg的酵母硒在提高血浆抗氧化能力方面显著好于0.30 mg/kg的无机硒,而混合硒在后期对肝脏CAT活性有显著提高,说明了混合硒改善了肝脏清除过氧化氢等有害自由基的能力。
4 结论
①饲粮添加有机硒显著降低了肉鸡全期ADFI,改善了肉鸡的抗氧化功能;与无机硒相比,有机硒的效果更好。
②饲粮添加各水平有机硒不同程度地提高了肉鸡各组织硒含量。
③ 饲粮添加0.20 mg/kg的有机硒替代0.30 mg/kg无机硒,在改善肉鸡的生长性能、提高组织硒含量和抗氧化功能方面是可行的。
[1] KIM Y Y.Differences in biological activity and metabolism of selenium due to its chemical form[J].Animal Science and Technology(Korea),2000,42(6):835-848.
[2] SURAI P.Selenium in poultry nutrition 2.Reproduction,egg and meat quality and practical applications[J].World’s Poultry Science Journal,2002,58:431-450.
[3] HOFFMAN D J.Role of selenium toxicity and oxidative stress in aquatic birds[J].Aquatic Toxicology,2002,57:11-26.
[4] SPALLHOLZ J E.On the nature of selenium toxicity and carcinostatic activity[J].Free Radical Biology and Medicine,1994,17:45-64.
[5] SPALLHOLZ JE,PALACE V P,REID T W.Methioninase and selenomethionine but not Se-methylselenocysteine generate methylselenol and superoxide in an in vitro chemiluminescent assay:implications for the nutritional carcinostatic activity of selenoamino acids[J].Biochemical Pharmacology,2004,67:547-554.
[6] WANG Y B,XU B H.Effect of different selenium source(sodium selenite and selenium yeast)on broiler chickens[J].Animal Feed Science and Technology,2008,144:306-314.
[7] MAHMOUD K Z,EDENS F W.Influence of organic selenium on hsp70 response of heat-stressed and enteropathogenic Escherichia coli-challenged broiler chickens(Gallus gallus)[J].Comparative Biochemistry and Physiology Part C:Toxicology& Pharmacology,2005,141:69-75.
[8] 夏枚生,张红梅,胡彩虹,等.纳米硒对肉鸡生长和抗氧化的影响[J].营养学报,2005,27(4)307-310.
[9] WANG Y X,ZHAN X A,ZHANG X W,et al.Comparison of different forms of dietary selenium supplementation on growth performance,meat quality,selenium deposition,and antioxidant property in broilers[J].Biological Trace Element Research,2011,143(1):261-273.
[10] PAYNE R L,SOUTHERN L L.Changes in glutathione peroxidase and tissue selenium concentrations of broilers after consuming a diet adequate in selenium[J].Poultry Science,2005,84:1268-1276.
[11] ŠEVCˇÌKOVÁ S,SKRˇIVAN M,DLOUHÁ G,et al.The effect of selenium source on the performance and meat quality of broiler chickens[J].Czech Journal of Animal Science,2006,51:449-457.
[12] ZHAN X A,WANG M,ZHAO R Q,et al.Effects of different selenium source on selenium distribution,loin quality and antioxidant status in finishing pigs[J].Animal Feed Science and Technology,2007,132:202-211.
[13] JUNIPER D T,PHIPPSR H,RAMOS-MORALESE,et al.Effects of dietary supplementation with selenium enriched yeast or sodium selenite on selenium tissue distribution and meat quality in lambs[J].Animal Feed Science and Technology,2009,149:228-239.
[14] JUNIPER D T,PHIPPSR H,RAMOS-MORALESE,et al.Effect of dietary supplementation with seleniumenriched yeast or sodium selenite on selenium tissue distribution and meat quality in beef cattle[J].Journal of Animal Science,2008,86:3100-3109.
[15] 丁文杰,戴晋军,杨志龙,等.富硒猪肉的研究进展[J].饲料与畜牧:新饲料,2008,7:55-57.
[16] PAN C L,HUANG K H,ZHAO Y X,et al.Effect of selenium source and level in hen’s diet on tissue selenium deposition and egg selenium concentrations[J].Journal of Agricultural and Food Chemistry,2007,55:1027-1032.
[17] VIGNOLA G,LAMBERTINI L,MAZZONE G,et al.Effects of selenium source and level of supplementation on the performance and meat quality of lambs[J].Meat Science,2009,81:678-685.
[18] TEMPLE N J.Antioxidants and disease:more questions than answers[J].Nutrition Research,2000,20:449-459.
[19] FANG Y Z,YANG S,WU G Y.Free radicals,antioxidants,and nutrition[J].Nutrition,2002,18:872-879.
[20] 高建忠,黄克和.动物硒蛋白研究进展[J].畜牧与兽医,2004,36(7):39-42.
[21] MIKULSKI D,JANKOWSKI J,ZDUÑCZYK Z,et al.The effect of selenium source on performance,carcass traits,oxidative status of the organism,and meat quality of turkeys[J].Journal of Animal and Feed Science,2009,18:518-530.
