铁硫化物/石墨烯纳米复合材料溶剂热法一步合成*
2012-12-17杜高辉
曹 宇, 郭 丽, 信 心, 杜高辉
(浙江师范大学物理化学研究所,先进催化材料省部共建教育部重点实验室,浙江金华 321004)
近年来,由于纳米材料的特殊性质及其在生产和生活中的重要应用,引起了人们的研究热潮.具有3d价电子壳层结构的过渡金属硫化物一般都为黄铁矿结构,它们通常具有良好的光学、电学和磁学性能,能够广泛地应用于高能量密度电池和太阳能光电材料,因而受到普遍的重视[1].其中,铁硫纳米材料已经引起人们的广泛关注.硫化铁是一个非常复杂的体系,存在许多不同摩尔比的物相组成,可简写为Fe1-xS和Fe1+xS.FeS2(pyrite)是一种很好的光电和光伏材料[2],也是一种具有潜在应用价值的太阳能电池材料,具有合适的禁带宽度(0.95 eV)和较高的光吸收系数[1,3].Fe7S8纳米材料具有高的导电性、高的热电势和强大的霍尔效应[4-5].另外,具有单斜、三角和六角晶系结构的Fe7S8纳米材料,由于其有趣的铁磁性和复杂的晶体结构而被研究者所关注[6-8].
目前,Fe1-xS纳米材料的合成方法主要有水热法[9]、热分解法[10]、化学气相沉积法[11]和溶剂热法[12]等.其中,溶剂热法因具有反应条件温和、产物纯度高、分散性好、工艺简单等优点而被广泛应用.在溶剂热法中,溶剂已不是单一的一种,而是所有的适合充当反应介质的有机液体,可以是极性的有机溶剂,也可以是非极性的有机溶剂;有机溶剂不仅是传递压力的介质,而且还能起到矿化的作用.这大大扩大了其应用范围.同时,因有机溶剂本身的特性,如极性、络合性能等,在溶剂热技术中也可起到奇特的效果.1997年,Sheldfick等[13]对溶剂热体系在新材料制备领域的重要地位和作用做了系统的阐述,指出:在离子交换剂、新功能材料及亚稳态结构材料的合成方面,溶剂热技术具有广阔的应用前景.
2004年,英国 Manchester大学的 Geim 等[14]通过一种简单的微机械剥离法制备了单原子厚度的石墨片——石墨烯,这种由单层碳原子紧密堆积而成的二维蜂窝状晶格结构的碳质材料,不仅表现出很高的结晶度,而且异乎寻常地稳定.这一发现立刻引起了全世界的关注.石墨烯具有许多优异的性能:杨氏模量(约1 100 GPa)、热导率(约5 000 J/(m·K·s))、载流子迁移率(2×105cm2/(V·s))、比表面积(理论计算值为2 630 m2/g),还具有量子霍尔效应、铁磁性等[15].石墨烯具有完美的二维周期平面结构,可以作为复合材料的理想组合成分.同时,石墨烯独特的结构和优良的物理、化学性能,与其他材料复合可赋予材料优异的性质.如:提高材料的机械性能和导电性能;提高材料在储能、催化、光电、传感器等方面的应用性能[16].
目前,铁硫化物纳米材料及石墨烯基纳米复合材料已被广泛研究,但以溶剂热法一步合成铁硫化物/石墨烯纳米复合材料的研究还未见相关报道.本文用乙醇、邻二氯苯为溶剂,硫磺粉及二茂铁为原料,采用溶剂热法成功地一步合成了FeS2/石墨烯、Fe7S8/石墨烯纳米复合材料,并研究了二茂铁与硫磺粉的摩尔比与溶剂对产物组成和形貌的影响.
1 实验部分
1.1 铁硫化物/石墨烯纳米复合材料的制备
按摩尔比为1∶2称取二茂铁和硫磺粉,将其置入容积为100 mL的聚四氟乙烯内衬的反应釜中,加入60 mL无水乙醇,超声5 min使其充分混合.然后将反应釜密封,置于200℃ 烘箱中反应80 h,将釜取出,自然冷却至室温,过滤,将沉淀物用无水乙醇反复洗涤,直至滤液为无色,于60℃干燥12 h,得到黑色粉末状固体即为样品A.用同样的方法,仅改变原料配比或溶剂:二茂铁和硫磺粉的摩尔比为1∶2.5,无水乙醇为溶剂,所得产物为样品B;二茂铁和硫磺粉的摩尔比为1∶2,邻二氯苯为溶剂,所得产物为样品C.
1.2 性能表征
用荷兰Philips公司PW3040/60 X-射线粉末衍射仪(Cu Kα,λ=0.154 16 nm)分析所得样品的晶体结构;利用日本Hitachi公司S-4800场发射扫描电子显微镜观察样品的表面形貌;使用透射电子显微镜(日本电子公司,JEM-2100F)对产物的形貌、尺寸和微观结构进行分析;使用英国Renishaw公司RM1000激光拉曼光谱仪对样品的石墨化程度进行分析.
2 结果与讨论
2.1 X射线衍射分析
图1为样品A,B和C的X射线衍射图.从图1(a)和图1(c)可以看出:当二茂铁与硫磺粉的摩尔比为1∶2时,样品A和C的特征衍射峰(111),(200),(210),(211),(220)和(311)与FeS2的标准图谱(JCPDS 79-0617)一致,说明此样品为 FeS2;石墨烯在2θ为23°附近出现衍射峰,这与石墨的特征衍射峰C(002)相近,衍射峰较宽,强度较弱,这可能是由于FeS2的存在导致石墨晶体结构的完整性下降、无序度增加所致.即当二茂铁与硫磺粉的摩尔比为1∶2时,合成所得样品为FeS2/石墨烯复合材料.图1(c)中硫化铁的衍射峰强度较大,峰较窄,说明以邻二氯苯为溶剂合成的FeS2颗粒尺寸较大.随着硫磺粉加入量的增加(二茂铁与硫磺粉的摩尔比为1∶2.5),产物发生了变化(见图1(b)):样品B的特征衍射峰(200),(203),(206),(220),(035)和(046)与Fe7S8的标准图谱(JCPDS 76-2308)完全吻合,说明此样品为Fe7S8;因Fe7S8的特征衍射峰强度很大,使石墨烯在2θ为23°附近的衍射峰不明显.

图1 3个样品的X射线衍射图
2.2 扫描电子显微分析

图2 3个样品的扫描电子显微照片
图2 为不同条件下合成的铁硫化物/石墨烯纳米复合材料的低倍和高倍扫描电子显微照片.从图2可以看出3个样品明显的片状结构.样品A和B的形貌相似,但样品C与它们有着较大的差异.这可能与所用溶剂乙醇和邻二氯苯的极性(乙醇>邻二氯苯)有关.从图2可以看出:样品A和样品B都是由纳米片堆叠而成,在低倍扫描电子显微镜下没有规则的形状;而样品C是由纳米片堆叠而成的均匀球状结构.
2.3 透射电子显微分析

图3 样品A的透射电镜及傅立叶变换图

图4 样品B的透射电镜及傅立叶变换图
图3 ~图5分别为样品A,B和C的低分辨率和高分辨率透射电子显微镜(TEM和HRTEM)成像及其快速傅立叶变换(FFT)图.从图3和图5可以看出:当二茂铁与硫磺粉的摩尔比为1∶2(样品A和C)时,合成的石墨烯片较薄,FeS2粒径约为5~20 nm,且均匀分布于石墨烯表面;以乙醇为溶剂时合成的石墨烯为片状,分散性好;而以邻二氯苯为溶剂时合成的石墨烯为由石墨烯片堆叠而成的球状结构,不易分散;通过高分辨率透射电子显微镜及傅立叶变换分析,证实颗粒产物为立方晶系FeS2,与X射线衍射分析结果一致.而当二茂铁与硫磺粉的摩尔比为1∶2.5、乙醇为溶剂时,形成的铁硫化物颗粒(样品B,见图4)分布于石墨烯表面,且合成的石墨烯较厚;样品的透射电子显微形貌和扫描电子显微图是一致的,通过高分辨率透射电子显微镜及傅立叶变换分析,证实块状结晶纳米颗粒为六角晶系Fe7S8.
2.4 拉曼光谱分析
拉曼光谱是碳材料分析与表征的重要工具之一,通过图中特征峰的位置与强度可判断碳材料(如石墨烯和碳纳米管)的结构特征.图6是样品A,B和C的拉曼光谱图,可以看出:样品C有2个明显的特征峰,一个位于1 574 cm-1附近(G峰),是石墨碳sp2结构的特征拉曼峰;另一个位于1 340 cm-1附近(D峰),是石墨碳的缺陷或无序态的特征峰,表明石墨烯结构中有一部分sp2杂化碳原子转化成了sp3杂化结构,即石墨层中的C ═ C双键被破坏;G峰与D峰的相对强度可以反应出样品的石墨化程度,也表示sp2/sp3杂化碳原子比[17].样品A和B的D峰向高波数段偏移,反映了以乙醇为溶剂所得样品A和B的石墨化程度优于样品C.由于所使用的溶剂热法反应温度低及与复合相硫化铁之间的相互作用,因而总体上拉曼峰较宽,说明材料中缺陷较多.

图5 样品C的透射电镜及傅立叶变换图
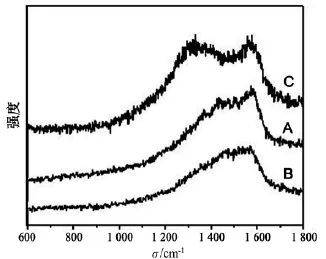
图6 样品A,B,C的拉曼光谱图
3 结论
采用溶剂热法,通过调节原料配比和改变溶剂,成功制备了FeS2/石墨烯和Fe7S8/石墨烯纳米复合材料.实验表明,原料配比影响产物的结构组成,溶剂影响产物的形貌.二茂铁与硫磺粉的摩尔比为1∶2时所得产物为FeS2/石墨烯复合材料;当二茂铁与硫磺粉的摩尔比为1∶2.5时,所得产物为Fe7S8/石墨烯纳米复合材料.用乙醇为溶剂时所合成的石墨烯为片状,而用邻二氯苯为溶剂所合成的石墨烯为纳米片堆叠而成的球状.该方法具有合成温度低、工艺简单、产率高等特点,为一步合成石墨烯复合材料提供了新途径.
[1]Ennaoui A,Fiechter S,Pettenkofer C,et al.Iron disulfide for solar energy conversion[J].Solar Energy Materials and Solar Cells ,1993,29(4):289-370.
[2]Wadia C,Alivisatos A P,Kammen D M.Materials availability expands the opportunity for large-scale photovoltaics deployment[J].Environ Sci Technol,2009,43(6):2072-2077.
[3]Ferrer I J,Nevskaia D M,de las Heras C,et al.About the band gap nature of FeS2as determined from optical and photoelectrochemical measurements[J].Solid State Commun,1990,74(9):913-916.
[4]Bither T A,Bouchard R J,Cloud W H,et al.Transition metal pyrite dichalcogenides.High-pressure synthesis and correlation of properties[J].Inorg Chem,1968,7(11):2208-2220.
[5]Assaly R N.Experimental investigation of a homogeneous dielectric sphere as a microwave lens[J].Can J Phys,1958,36(10):1430-1435.
[6]Yue G H,Yan P X,Fan X Y,et al.Characterization of the single crystalline iron sulfide nanowire array synthesis by pulsed electrodeposition[J].J Appl Phys,2006,100(12):124313.
[7]Sato K.Magnetizing process of pyrrhotite crystal in high magnetic field[J].J Phys Soc Jpn,1966,21(4):733-737.
[8]Fan Li,Franzen H F.Ordering,incommensuration,and phase transitions in pyrrhotite:partⅡ:a high-temperature X-ray powder diffraction and thermomagnetic study[J].J Solid State Chem,1996,126(1):108-120.
[9]Nath M,Choudhury A,Kundu A,et al.Synthesis and characterization of magnetic iron sulfide nanowires[J].Adv Mater,2003,15(24):2098-2101.
[10]Lai H Y,Chen C J.Shape-controlled synthesis of iron sulfide nanostructures via oriented attachment mechanism[J].J Cryst Growth,2009,311(23/24):4698-4703.
[11]Soon J M,Goh L Y,Loh K P,et al.Highly textured,magnetic Fe(1+x)S nanorods grown on silicon[J].Appl Phys Lett,2007,91(8):084105.
[12]Wu R,Zheng Y F,Zhang X G,et al.Hydrothermal synthesis and crystal structure of pyrite[J].J Cryst Growth,2004,266(4):523-527.
[13]Sheldrick W S,Wachhold M.Solventothermal synthesis of solid-state chalcogenidometalates[J].Angew Chem Int Ed Eng,1997,36(3):206-224.
[14]Geim A K,Novoselov K S.The rise of grahene[J].Nat Mater,2007,6(3):183-191.
[15]Geim A K.Graphene:status and prospects[J].Science,2009,324(5934):1530-1534.
[16]Kamat P V.Graphene-based nanoarehiteetures.Anehoring semieonductor and metal nanoparticles on a two-dimensional carbon support[J].J Phys Chem Lett,2010,1(2):520-527.
[17]Ferrari A C,Robertson J.Interpretation of Raman spectra of disordered and amorphous carbon[J].Phys Rev B,2000,61(20):14095-14107.
