肺癌患者外周血白细胞端粒DNA相对长度检测*
2012-12-17谭善娟王丁丁
王 娜,周 舫,谭善娟,王丁丁
郑州大学公共卫生学院劳动卫生学教研室 郑州450001
△女,1976年4月生,硕士,讲师,研究方向:职业性肺癌,E-mail:wefngqiao@zzu.edu.cn
目前,在世界范围内,肺癌居癌症的发病率与死亡率之首[1],且发病和死亡年龄有年轻化的趋向[2],已成为一个重要的公共卫生问题。端粒是真核细胞中线性染色体末端的非编码DNA 重复系列以及与之相连的端粒结合蛋白功能复合体,用以维护染色体的完整性和稳定性,防止染色体降解和融合[3],并能够使分裂后的子代细胞准确获得完整的遗传信息。相关研究[4-5]表明端粒缩短、端粒调节的稳态失衡可能为肺癌发生的重要机制之一,端粒过短引起的染色体不稳定在人类癌症发展中的作用是端粒研究的一个热点问题。作者应用Real Time PCR 方法检测了肺癌患者和健康人外周血白细胞端粒DNA 相对长度,以探讨其与肺癌的关系。
1 对象与方法
1.1 研究对象 病例组为郑州大学第一附属医院确诊的肺癌患者54例,术前未经任何抗癌治疗,均排除患有其他肿瘤,年龄36~74(59.6±9.5)岁,男37例,女17例;对照组为同期于该院体检科进行体检且结果显示健康者,共77 人,年龄23~83(44.0±12.5)岁,男56 人,女21 人。
1.2 实验标本的收集和保存 所有研究对象取空腹静脉抗凝血2 mL,采用天根生化科技有限公司的人外周血DNA 提取试剂盒提取新鲜血液基因组DNA,-20℃保存备用。
1.3 外周血白细胞端粒DNA 相对长度的测定分别选择nRP 作为端粒DNA 的测定引物,选择GAPDH 作内参,运用Primer 5.0 软件设计引物。nRP 上游引物序列5’-CAGCAAGTGGGAAGGTG TAATCC-3’,下游引物序列5’-CCCATTCTATCAT CAACGGGTACAA-3’; GAPDH 上游引物序列5’-TACTAGCGGTTTTACGGGCG-3’,下游引物序列5’-GAACAGGAGGAGCAGAGAGCGA-3’; 引 物 由 生 工生物工程(上海)有限公司设计并合成。采用SYBR Green ⅠReal Time PCR 技术检测外周血白细胞端粒DNA 相对长度。PCR 反应体系:2×SYBY qPCR Master Mix 10 μL,上、下游引物各0.5 μL,模板DNA 2 μL。反应条件:95℃预变性10 min;95℃变性15 s,61℃退火和延伸1 min,共40 个循环。根据阴性对照调整阈值和基线以确定各个标本的Ct 值。每个样本的端粒DNA 和内参基因均设2 个平行样并取均值作为该样本端粒DNA 和内参基因的Ct 值,每一轮PCR 反应均设一个阴性对照。采用2-ΔΔCt法计算端粒相对长度。
1.4 统计学处理 采用SPSS 12.0 处理数据。应用两独立样本的t 检验比较2组端粒DNA 相对长度的差异;以肺癌为因变量,以是否吸烟、年龄及端粒DNA 相对长度为自变量建立非条件logistic 回归模型,进行多因素分析。其中吸烟者定义为每天吸烟1 支,持续半年以上(WHO)[6];年龄以55 岁为分界点分为两层;端粒相对长度根据对照组百分位数P33和P66从短到长分为3 层(T1:<P33,T2:P33~,T3:≥P66),以T3 层为参考水平,设置两个哑变量。检验水准α=0.05。
2 结果
2.1 调查对象的基本资料 见表1。病例组与对照组相比,年龄差异有统计学意义,将年龄以55 岁为分界点分为两层;2组性别分布差异无统计学意义。
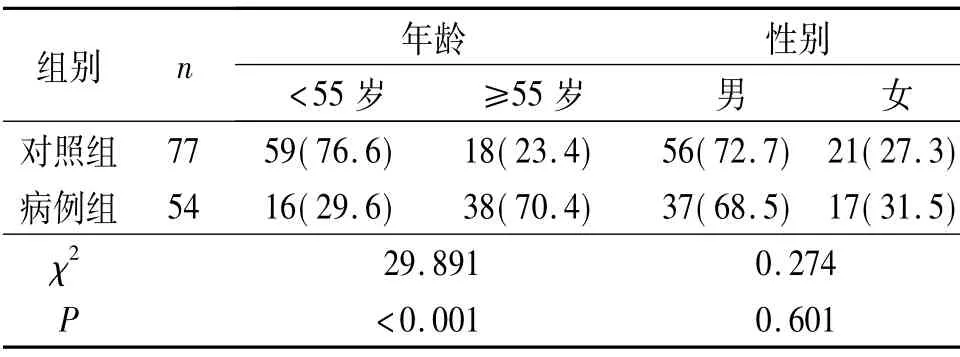
表1 调查对象的基本资料例(%)
2.2 病例组与对照组外周血白细胞端粒DNA 相对长度比较 由于2组年龄分布不均衡,分别对病例组与对照组内不同年龄组间端粒相对长度进行比较,结果见表2。根据表2结果,合并两个年龄段的数据,结果显示,与对照组(3.86±1.46)相比,病例组外周血白细胞端粒DNA 相对长度(3.43±0.87)缩短,差异有统计学意义(t=2.093,P=0.038)。
2.3 Logistic 回归分析结果 首先分别对年龄、吸烟、端粒DNA 相对长度进行单因素logistic 回归分析,结果显示年龄、吸烟及端粒DNA 相对长度均纳入logistic 回归方程当中。进一步将3 者纳入logistic 回归模型进行多因素分析,结果显示,吸烟、年龄≥55 岁、T1 及T2 端粒DNA 相对长度较短均可能与肺癌发生危险度增高有关。见表3。
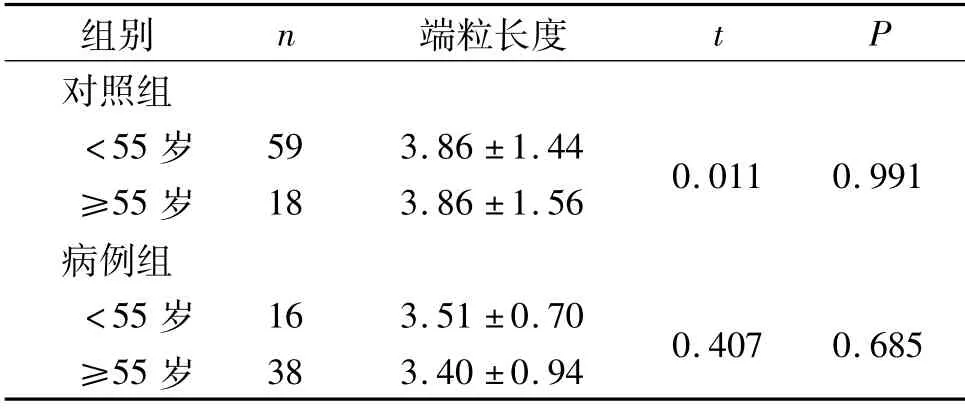
表2 各组不同年龄外周血白细胞端粒DNA 相对长度比较

表3 多因素logistic 回归分析结果
3 讨论
端粒在维护真核细胞染色体的完整性和稳定性中起着重要作用。相关研究[4-5]表明,端粒稳态失衡是肺癌发生的最主要机制之一,但有关端粒长度与肺癌关系的研究还存在很大的分歧。许多研究[7-9]报道端粒缩短在肿瘤的发病中起着重要的作用。端粒持续缩短可使染色体发生融合,从而导致染色体不稳定以及基因表达发生变化,使细胞永生化,导致肿瘤的发生。也有研究[10-11]发现许多肿瘤细胞在增殖过程中随着细胞的分裂,其端粒并不缩短,甚至延长,从而使细胞逃避衰老和死亡,获得无限增殖的能力。
该研究结果显示肺癌患者外周血白细胞端粒DNA 长度短于对照组;非条件logistic 回归分析结果显示,吸烟、年龄及端粒DNA 相对长度均为肺癌发生的危险因素,将吸烟和年龄调整后,发现人群患肺癌危险度随着端粒DNA 相对长度的缩短而增加,表明端粒DNA 相对长度缩短可能与肺癌有关。
目前关于外周血端粒DNA 相对长度与肺癌关系的研究较少,结论存在着一定的矛盾。Wentzensen 等[12]的Meta 分析结果显示,外周血白细胞端粒DNA 相对长度缩短可能与肺癌危险性增高有关;Jang 等[13]用确诊的肺癌患者242例和与之匹配的健康对照242例建立logistic 回归模型,结果显示短端粒与长端粒相比患癌危险性增高; 而Shen 等[11]做的一项关于外周血白细胞端粒长度与肺癌关系的前瞻性研究结果显示,长端粒是肺癌发生的一个危险因素。相对于前瞻性研究来说,病例对照研究存在着较大的选择偏倚,另外由于该研究的样本量较小,可能对结果产生一定的影响。
总之,该研究显示端粒DNA 相对长度缩短可能与肺癌的发生有关。端粒长度与年龄、有害因素接触、肿瘤类型及分期等多种因素有关,另外还受端粒酶及端粒结合蛋白的影响,在进行端粒与肺癌研究时应充分考虑这些问题。今后需结合端粒在肺癌发生发展中的作用机制以及端粒酶的作用,扩大样本量深入研究。
[1]Zhou W,Christiani DC.East meets West:ethnic differences in epidemiology and clinical behaviors of lung cancer between East Asians and Caucasians[J].Chin J Cancer,2011,30(5):287
[2]Reddy C,Chilla D,Boltax J.Lung cancer screening:a review of available data and current guidelines[J].Hosp Pract (Minneap),2011,39(4):107
[3]O’Donovan A,Pantell MS,Puterman E,et al.Cumulative inflammatory load is associated with short leukocyte telomere length in the health,aging and body composition study[J].PLoS One,2011,6(5):e19687
[4]Prescott J,Kraft P,Chasman DI,et al.Genome-wide association study of relative telomere length[J].PLoS One,2011,6(5):e19635
[5]Deng W,Tsao SW,Guan XY,et al.Distinct profiles of critically short telomeres are a key determinant of different chromosome aberrations in immortalized human cells:whole-genome evidence from multiple cell lines[J].Oncogene,2004,23(56):9090
[6]Steliga MA,Dresler CM.Epidemiology of lung cancer:smoking,secondhand smoke,and genetics[J].Surg Oncol Clin N Am,2011,20(4):605
[7]Raynaud CM,Jang SJ,Nuciforo P,et al.Telomere shortening is correlated with the DNA damage response and telomeric protein down-regulation in colorectal preneoplastic lesions[J].Ann Oncol,2008,19(11):1875
[8]Londono-Vallejo JA.Telomere instability and cancer[J].Biochimie,2008,90(1):73
[9]Hsu CP,Ko JL,Shai SE,et al.Modulation of telomere shelterin by TRF1[corrected]and TRF2 interacts with telomerase to maintain the telomere length in non-small cell lung cancer[J].Lung Cancer,2007,58(3):310
[10]耿志华.端粒酶与肺癌的诊断和预后[J].国外医学:呼吸系统分册,2002,22(1):1
[11]Shen M,Cawthon R,Rothman N,et al.A prospective study of telomere length measured by monochrome multiplex quantitative PCR and risk of lung cancer[J].Lung Cancer,2011,73(2):133
[12]Wentzensen IM,Mirabello L,Pfeiffer RM,et al.The association of telomere length and cancer:a meta-analysis[J].Cancer Epidemiol Biomarkers Prev,2011,20(6):1238
[13]Jang JS,Choi YY,Lee WK,et al.Telomere length and the risk of lung cancer[J].Cancer Sci,2008,99(7):1385
