UPLC-UV法测定不同产地青蒿中青蒿素的含量
2012-12-09刘吉华余伯阳
向 文,李 琳,刘吉华*,余伯阳,2
青蒿素是由我国科学工作者,自主研发并在国际上注册的为数不多的一类新药之一。1971年屠呦呦等人在中国传统医药宝库中,发现并分离得到了具有抗疟疾活性成分 -青蒿素(Artemisinin,QHS),开创了人类抗疟之路的一个新的里程碑,挽救了数百万人的生命,并于2011年9月23日获得国际医学大奖-美国拉斯克(临床研究奖)[1]。青蒿素是从菊科植物黄花蒿(Artemisia annua L.)中提取得到的一种新型倍半萜内酯的化合物,具有高效、快速、低毒的抗疟活性,尤其对具有抗氯喹能力的脑疟和急性疟有效[2]。
近年来对青蒿素类成分的研究表明,青蒿素除了独特的抗疟作用外,该类药还具抗寄生虫、抗真菌、抗卡氏肺孢子虫肺炎、抗心率失常、平喘及自身免疫调节等多种疗效[3]。同时,青蒿素及其衍生物以其独特的抗肿瘤机制和高效、低毒的抗肿瘤活性受到广泛关注[4]。
通过化学合成获得青蒿素已报道[5],但由于其具有多个手性碳原子,使得合成步骤非常复杂,产率低、成本高,工业化生产很难实现。所以目前药用青蒿素主要从黄花蒿植株中提取获得[6]。因此,方便、快捷、准确检测青蒿中青蒿素的含量对青蒿的选种培育、青蒿素类药物生产及研究都具有重要意义。
1 材料与方法
1.1 实验材料
供试品青蒿药材分别采自重庆酉阳基地、安徽安庆和桐城、湖北恩施和赤壁吉林四平、山西太原、山东泰安和安丘、江苏南京等10个地区,经中国药科大学刘吉华教授鉴定。采集地上部分,阴干并粉碎后过60目筛,备用。
青蒿素对照品(批号:100202-200603)购自中国药品生物制品检定所;乙腈 (色谱纯,美国TEDIA),纯水(自制),石油醚,甲醇,乙醇,丙酮,氯仿,乙酸乙酯(分析纯,南京化学试剂厂)
1.2 实验仪器
UPLC-1290色谱仪(安捷伦公司),Agilent 1260 DAD检测器,KQ-100型超声波清洗器(昆山超声仪器有限公司),低温离心机(BACKMAN公司),RIOS-Elix纯水器(Millipore公司)
1.3 实验方法与结果
1.3.1 色谱条件
色谱柱:Agilent Eclipse Plus C18(2.1 mm ×50 mm,1.8μm);流动相:乙腈-水(45∶55);流速:1.0 mL/min;柱温:28℃;检测波长:200 nm;进样体积:1μL。
1.3.2 标准曲线的绘制
精密称取0.5 g青蒿素对照品,置于容量瓶中加甲醇定容到50 mL,摇匀,即为10 mg/mL的对照品溶液。
精密量取 0.1,0.2,0.4,0.6,1.0,2.0,4.0,6.0,10.0 mL置10 mL的容量瓶中,用甲醇稀释到刻度,摇匀,过0.22μm的滤膜,取续滤液1uL进样。以峰面积值A对进样量C进行线性回归,测定结果得标准曲线:A=109.41C+6.7 026,R2=0.9 993(n=9)。结果表明,进样量在0.10 117-10.117 μg范围内,青蒿素的峰面积与进样量有良好的线形关系(见图1)。
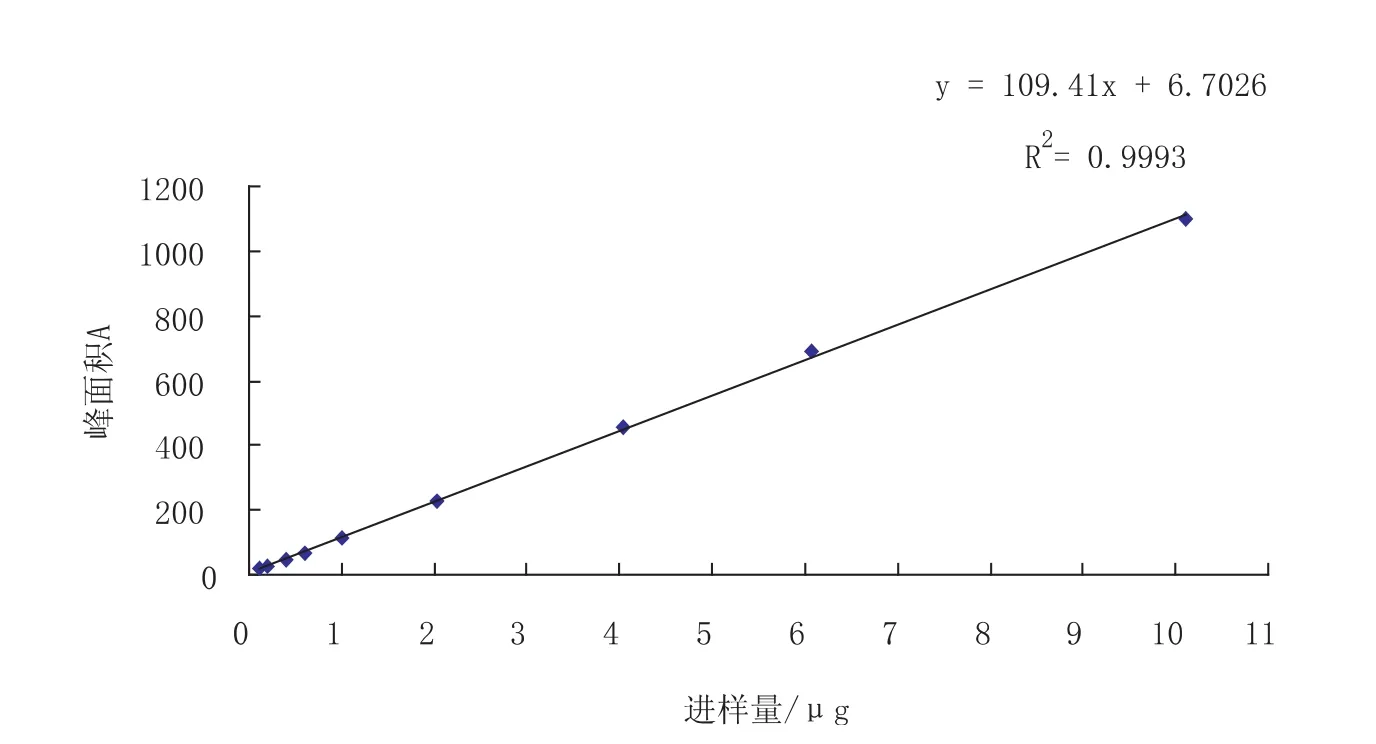
图1 青蒿素的标准曲线

图2 青蒿素的UPLC-UV色谱图
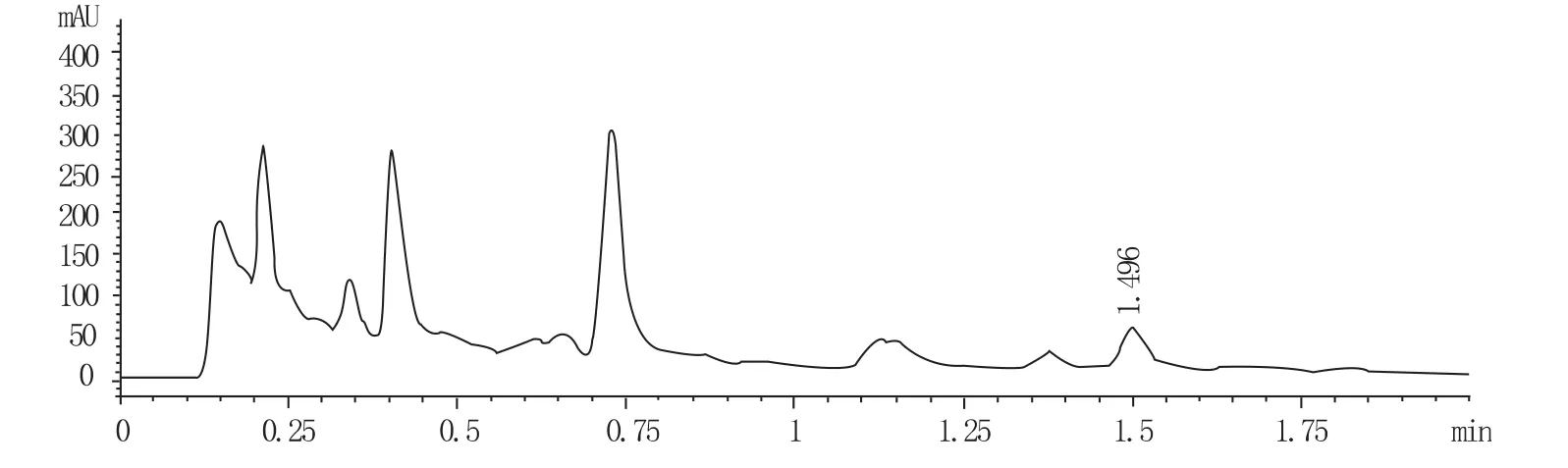
图3 基地(酉阳)药材的UPLC-UV色谱图
1.3.3 供试品的制备
精密称取10种不同产地的药材粉末0.3 g(每组3个平行),置10 mL离心管中,加入5 mL的丙酮,称量并记录,超声提取30 min,取出后补足损失,离心(4 000 r/min,10 min)取上清2mL,挥干溶剂,用乙腈定容到1 mL,过0.22μm滤膜,取续滤液待用,即为供试品溶液。
1.3.4 不同产地药青蒿中青蒿素的含量测定
将上述1.3.3制备所得的“供试品溶液”,进UPLC分析,并根据峰面积计算出药材中的青蒿素的含量(见表1)。
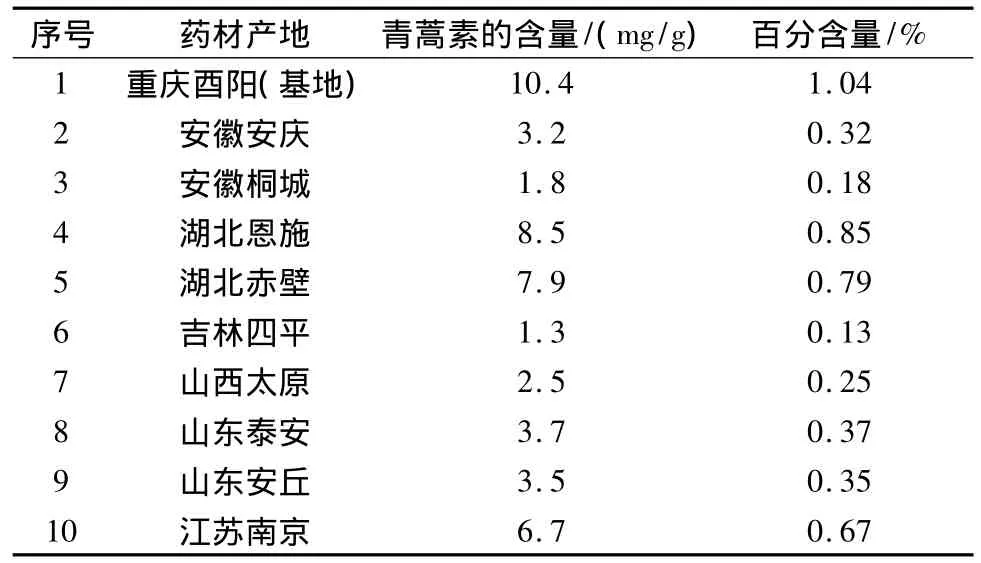
表1 不同产地青蒿中青蒿素含量的比较
1.3.5 精密度
取同一供试品溶液,连续进样6次,每次1μL,测得峰面积值,计算RSD为1.7%。
1.3.6 稳定性
取同一供试品溶液,分别于0,2,4,8,12 和 24 h进样,测得其峰面积值,计算RSD为2.1%。
1.3.7 重复性
精密称取同产地药材粉末6份,每份为0.3 g,按“供试品溶液制备”项下操作,测定并计算青蒿素含量,6次测定值的RSD为2.3%,重现性良好。
1.3.8 加样回收率
采用加样回收法,取已知含量的同产地(基地)6份,每份0.15 g,精密称定,分别精密加入适量青蒿素,按“供试品溶液制备”项下操作,测定并计算青蒿素的回收率,结果回收率为99.3%,RSD为2.6%。
2 讨论
(1)本实验考察了6种常用溶剂提取效率的影响,选择了石油醚、甲醇、乙醇、丙酮、氯仿、乙酸乙酯为提取溶剂进行考察,结果表明丙酮提取效果较好,故选择丙酮为提取溶剂。
(2)青蒿素等倍半萜类化合物大多紫外吸收很弱,本实验采用末端吸收UPLC法测定青蒿中青蒿素的含量,同时选择在200 nm,205 nm,209 nm 3个波长处进行含量测定。结果显示,青蒿素在200 nm处的灵敏度较高且稳定。
由于甲醇在紫外的末端也有一定吸收,为避免流动相的干扰,所选用的流动相为乙腈/水系统。
(3)根据实验结果显示,不同产地的青蒿药材中青蒿素的含量差异很大,青蒿素的含量测定方法的改进有助于提高青蒿药材质量的监控。自青蒿素发现以来,关于青蒿素含量测定的方法很多[7]。95版药典第一次收录,采用紫外分光光度法检测青蒿素的含量[8],ELSD-HPLC法亦常用于青蒿素的含量测定[9-10],柱前衍生化-HPLC法是也较常用的方法[11-13]。但是该方法样品处理过程复杂,衍生试剂的浓度和加入量,反应温度和时间,流动相缓冲盐的种类和比例等因素都能对分析结果造成一定的影响。
与传统的HPLC相比,UPLC的速度、灵敏度及分离度都比HPLC要高[14]。本实验方法的特点在于样品的处理简单,适用于快速、准确地处理大批量的样品,分析过程中受干扰因素较少,减少多步操作从而降低分析过程中人为因素带来的误差。从经济角度来看,该方法大大缩短了分析周期、节约了人力物力、分析相同数量样品所有溶剂量也大大减少了。
[1] Tu Youyou.The discovery of artemisinin(qinghaosu)and gifts from Chinese medicine[J].Nature Medicine,2011,10(17):1217-1220.
[2] 张积强,陈强,刘宗桥.抗疟新药青蒿素的研究[J].陕西化工,1981,16(1):65-66.
[3] 谭涛,秦宗会,谭蓉.青蒿素类药物的药理作用研究进展[J].中国药业,2009,18(3):63-64.
[4] 钱海洪,胡义德.青蒿素类药物抗肿瘤作用机制的研究进展[J].中华肿瘤防治杂志,2006,13(11):867-869.
[5] Lapkin A A,Plucinski R K,Cutler M,et al.Comparative assessment of technologies for extraction of artemisinin[J].Journal of Natural Products,2006,69(11):1653-1664.
[6] Yada J S,Bbu R S,Sabitha G.Total synthesis of artemisinin[J].Archive Org Chem,2003,3:125-139.
[7] 张犇,邹婷,王剑文.青篙素检测方法的研究近况[J].抗感染药学,2008,5(4):201-204.
[8] 国家药典委员会.中华人民共和国药典(二部)[S].北京:化学工业出版社,1995:345.
[9] 惠玉虎,何锦伟,杨朝昆,等.HPLC-ELSD法测定黄花蒿提取物中青蒿素[J].中草药,2006,37(7):1020-1021.
[10] 张东,杨岚,屠呦呦,等.HPLC-UV-ELSD法同时测定青蒿中青蒿素、青蒿乙素和青蒿酸的含量[J].药学学报,2007,42(9):978-981.
[11] 刘丽芳,王茜,李海燕,等.柱前衍生-RP-HPLC法测定青蒿中青蒿素的含量[J].中国野生植物资源,2004,23(6):60-62.
[12] 张伟,秦民坚,王国凯.衍生化条件的优化及不同产地青蒿中青蒿素含量的柱前衍生化-HPLC法测定[J].植物资源与环境学报,2011,20(1):88-90.
[13] 刘金磊,李典鹏,韦霄,等.黄花蒿中青蒿素含量RP-HPLC法测定[J].广西植物,2007,27(5):808-810.
[14] 金高娃,章飞芳,薛兴亚,等.超高效液相色谱在复杂体系中药介离介析中的应用[J].世界科学技术-中医药现代化,2006,8(3):106-111.
