酶洗法制备兔组织工程气管支架的周期研究
2012-12-09李建忠张志培汪健吴凡金岩韩勇姜涛闫小龙倪云峰赵晋波李小飞
李建忠 张志培 汪健 吴凡 金岩 韩勇 姜涛 闫小龙 倪云峰 赵晋波 李小飞
组织工程同种异体气管移植是当前气管外科领域研究的重点。已有报道用酶洗法制备猪气管支架,但实验尚存在诸多不确定因素[1],国内外尚未有用酶洗法制备兔气管支架研究的相关报道。本实验探讨酶洗法制备兔气管支架的适宜周期,为研究组织工程同种异体气管移植提供实验依据。
1 材料与方法
1.1 主要试剂与仪器
脱氧胆酸钠(北京奥博星生物技术有限责任公司),脱氧核糖核酸酶-Ⅰ(DNase-Ⅰ)(Roche公司,德国),两性霉素 B(Amresco公司,美国),青霉素(哈药集团制药总厂),蔡司正置显微镜Axioskop 40(ZEISS公司,德国),钨灯丝扫描电镜VEGA3 LMH(Tescan公司,捷克),电子实验机(Shimadzu公司,日本)。
1.2 实验动物与分组
健康新西兰兔24只,体质量2.5~3.0 Kg,雌雄不限,购自第四军医大学实验动物中心。随机等分为4 组(n=6)。A 组,对照组,新鲜气管;B、C、D 组,实验组,气管分别经过2、3、4个周期的处理。
1.3 气管支架制备方法
耳缘静脉空气栓塞致死,无菌条件下取出气管,迅速剥离气管上的疏松结缔组织。经含有1%青霉素、1%两性霉素B的PBS缓冲液冲洗3~4min后,A组气管浸泡在4℃的PBS缓冲液中准备检测;B、C、D组气管冲洗后均置入4℃纯净水中浸泡48 h。取出后在含有4%脱氧胆酸钠生理盐水中浸泡3 h,PBS冲洗3~4min。然后在含有2000 KU/LDNase-Ⅰ的生理盐水中浸泡3 h,B、C、D组分别如此循环2、3、4个周期,处理好的标本浸泡在4℃的PBS溶液中准备检测。
1.4 检测方法
将处理后的气管参照 Macchiarini[2]生物力学检测标准进行完整气管力学检测;取长约0.5 cm气管环于中性福尔马林固定24h,行脱水、浸蜡、包埋、切片处理后,HE染色后组织学观察;取长约1.5 cm气管环以戊二醛固定后,扫描电镜超微结构观察。
1.5 统计学方法
2 结果
2.1 生物力学检测
生物力学检测显示:各组气管长度均数不相等,差异无统计学意义(P>0.05)。组间两两比较显示,D组最大拉伸力、破裂力、变异率均小于A组、B组、C组,差异显著(P<0.05);而 A 组、B 组、C 组两两比较,差异没有统计学意义(P>0.05)。(表1)
表1 气管支架生物力学比较Table 1.Comparison of biomechanics on trachea among 4 groups()

表1 气管支架生物力学比较Table 1.Comparison of biomechanics on trachea among 4 groups()
变异率(%)对照组 A 5.02±0.604.465±0.65 0.645±0.072 9.64±0.48 202±8实验组 B 4.98±0.574.425±0.55 0.535±0.082 9.48±0.50 198±10实验组 C 4.96±0.584.375±0.45 0.525±0.064 9.58±0.52 197±9实验组 D 5.10±0.612.855±0.30*0.350±0.042*9.86±0.46142±18*组 别 气管长度(cm)最大拉伸力(N) 破裂力(N) 破裂点(cm)
2.2 组织学观察
HE染色显示:A组气管黏膜上皮组织可见大量完整的黏膜上皮细胞;B组气管黏膜上皮组织见部分完整黏膜上皮细胞;C组、D组气管黏膜上皮细胞未见完整的黏膜上皮细胞(图1)。

图1 组织学观察(HE,400×)Fig.1 Histological observation of tracheas(HE,400×)
2.3 扫描电镜观察
扫描电镜显示A、B、C组的气管支架胶原纤维间有残存的细胞基质,胶原纤维较粗;D组的气管支架未见细胞基质,胶原纤维较细(图2)。
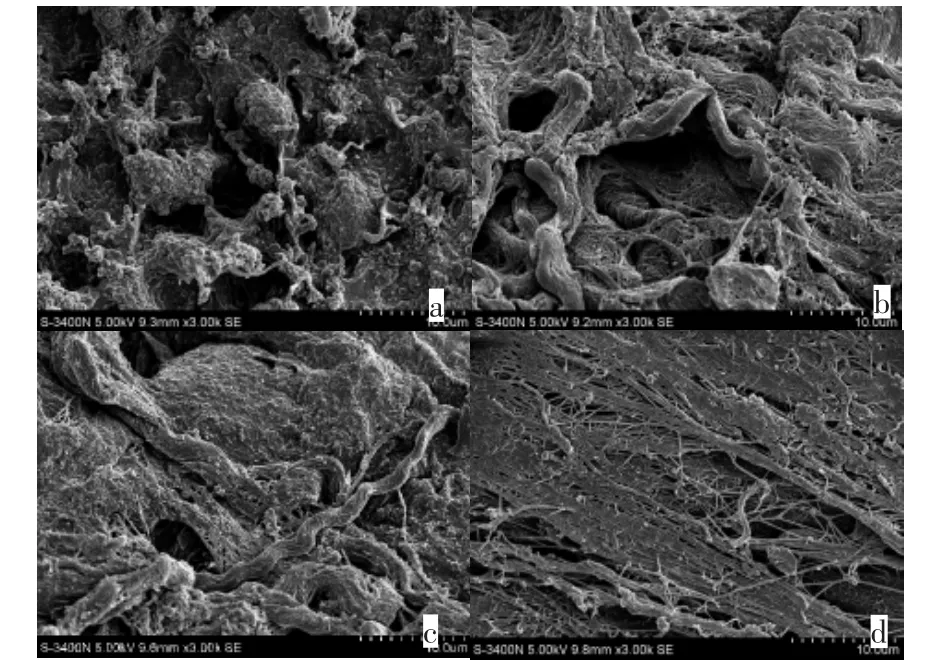
图2 扫描电镜观察:(SEM,3000×)Fig.2 Ultrastructure observation by SEM(SEM,3000×)
3 讨论
全球首例组织工程同种异体左主支气管成功移植[3]后,组织工程同种异体气管移植已成为气管重建领域的研究热点,但尚未有组织工程同种异体气管移植的相关报道。气管支架的构建和再细胞化是构建组织工程同种异体气管的主要制约因素。气管支架既需有理想的去抗原效果、生物力学性能,又需最大限度地保持细胞外基质的完整性,以达到支架支撑效果,并有助于同种异体成软管细胞和气管黏膜上皮细胞的再细胞化。
在深低温冷冻法[4-5]、玻璃化液冷冻法[6-7]及酶洗法[1-3]三种主要制备气管支架的方法中,酶洗法越来越受到关注。本研究采用酶洗法分别处理3个实验组2、3、4个周期,制备气管支架,并与未处理气管进行比较。生物力学结果比较显示,处理3个周期的气管支架的最大拉伸力、破裂力和变异率显著大于处理4个周期的气管支架。实验证明处理周期太短则有完整的黏膜上皮细胞残存,不能有效去除气管的抗原性,处理周期太长则损坏细胞外基质,影响气管支架的再细胞化。综上所述,采用4%脱氧胆酸钠及2000 KU/L DNase-Ⅰ处理兔气管3个周期,既具有理想的去抗原效果、生物学性能,又最大限度地保持了细胞外基质的完整性,适于构建兔组织工程同种异体气管。
[1]Go T,Jungebluth P,Baiguero S,et a1.Both epithelial cells and mesenchymal stem cell derivedchondrocytes contribute to the survival of tissue-engineered airwaytransplants in pigs[J].Thorac Cardiovasc Surg,2010,139(2):437-443.
[2]Macchiarini P,Baiguera S,Jungebluth P,et a1.Tissue engineered human tracheas for in vivo implantation[J].Biomaterials,2010,31(34):8931-8938.
[3]Macchiarini P,Jungebluth P,Go T,et al.Clinicaltransplantation of a tissue-engineered airway[J].Lancet,2008,372(9655):2023-2030.
[4]闫小龙,李小飞,刘勇.深低温冷冻对rhBMP-2诱导犬气管移植体软骨再生的影响[J].第四军医大学学报,2005,26(2):160-163.
[5]Autissier A,Le Visage CL,Pouzet C,et a1.Fabrication of porous polysaccharide-based scaffolds using a combined freeze-drying/cross-linking process[J].Acta Biomater,2010,6(9):3640-3648.
[6]史宏灿,徐洪,吴俊,等.玻璃化冷冻同种异体气管移植动物模型的建立[J].中华外科杂志,2008,46(20):1589-1590.
[7]Xu H,Shi HC,Zhang WF,et a1.An experimental research on cryopreserving rabbit trachea by vitrification[J].Cryobiology,2009,58(2):225-231.
