CD204阴性人脂肪来源细胞体外成软骨潜能的初步研究
2012-12-09丁金萍孙恒赟陈谨君张文杰刘伟曹谊林周广东
丁金萍 孙恒赟 陈谨君 张文杰 刘伟 曹谊林 周广东
软骨组织工程技术出现至今,关于种子细胞的研究从未间断,并且始终是一个核心问题。软骨细胞是构建软骨最理想的种子细胞,但软骨细胞来源有限,取材创伤大,大量扩增后又极易发生老化与去分化[1]。骨髓基质干细胞是研究较多的成体干细胞,但由于骨髓穿刺给患者带来一定痛苦,而且细胞获得量小,在临床应用中受到一定的限制。因此,如何获得来源广泛、数量充足、功能良好,且具有软骨分化潜能的细胞,是解决软骨组织工程种子细胞问题的关键。自Zuk等[2]成功分离培养出具有多向分化潜能的脂肪组织来源干细胞(ADSCs)以来,将其作为软骨组织工程种子细胞的研究越来越多。但通常所称的ADSCs是一群混杂细胞群[2],其中一些脂肪前体细胞、内皮细胞、成纤维细胞等会影响ADSCs构建软骨的成功率和均质性。我们的前期研究通过单细胞克隆培养及软骨定向诱导技术,将具有克隆形成能力的ADSCs分为具有和不具有软骨分化潜能的两类克隆群,再结合基因芯片技术筛选出与软骨分化潜能相关的表面膜蛋白;以此表面标志为基础,进一步结合细胞分选,以及体外软骨定向诱导技术,有可能找到适合组织工程软骨构建的ADSCs的新标志。本研究就是基于基因芯片初筛所得的CD204(巨噬细胞清道夫受体)在两类不同克隆群差异表达的结果,探讨以CD204作为细胞分选标志,研究分选后细胞体外成软骨能力。
1 材料与方法
1.1 实验材料及仪器
10 cm培养皿,离心管,0.22 μm针孔过滤器(Falcon公司);低糖及高糖 DMEM培养液,MesenPRO RSTMMedium,青链霉素原液,0.25%胰蛋白酶(Gibco公司);0.25%氯霉素(上海交通大学附属第九人民医院自制);Ⅰ型胶原酶(Serva公司);地塞米松、ITS+(Sigma公司);Isotype鼠 IgG2B-PE 抗体, 鼠抗人 CD204-PE 抗体,TGF-β3,IGF,BMP-6(R&D公司);鼠抗人Ⅱ型胶原单克隆抗体,辣根过氧化物酶标记的羊抗鼠二抗(Dako公司);倒置相差显微镜(Nikon公司);流式细胞分选仪(Beckman-coulter公司)。
1.2 脂肪来源干细胞的分离及原代培养
脂肪组织来源于18~35岁要求行抽脂术的健康成年人2例,供体无传染病及内分泌疾病,平均抽脂吸出物800 mL。
分离抽脂术后抽吸物的脂质部分约800 mL,用0.25%氯霉素和生理盐水冲洗,用0.075%Ⅰ型胶原酶与脂质成分等体积置于50 mL离心管,37℃恒温摇床反复震荡消化40min。1500 r/min离心5min,去上清,低糖DMEM培养液重悬后100 μm金属滤器过滤,1500 r/min离心5min,吸除上清液,沉淀重悬后按2×104cells/cm2密度接种于培养皿内,置于CO2培养箱内培养16 h后进行流式细胞分选。
1.3 流式细胞分选
标本制备:原代细胞贴壁16 h后,用0.25%胰酶消化,单细胞滤器过滤,离心弃上清,PBS重悬,分blank组、isotype-PE组和 CD204-PE组,4℃孵育40min,PBS洗涤 3次,加 500μL PBS待上机。分选后的细胞用MesenPRO RS培养液按2×104cells/cm2密度接种于培养皿内,置于37℃、5%CO2、100%饱和湿度的培养箱内培养。
1.4 体外定向成脂、成骨分化
成脂诱导分化:取CD204+和CD204-的第2代细胞,胰蛋白酶消化,调整细胞密度到3000 cells/cm2。48 h后更换成脂诱导液DMEM培养基(含10%胎牛血清,0.5 mM异丁基甲基黄嘌呤,1 μM地塞米松,10 μM胰岛素,200 μM吲哚美辛),完全培养基组作为阴性对照。每3天更换培养液,定向诱导分化10 d后,行油红O染色,观察诱导分化结果。
成骨诱导分化:分别取分选扩增后的第2代CD204+和CD204-细胞,胰蛋白酶消化,将细胞密度调整到 3000 cells/cm2。48 h后更换成骨诱导DMEM培养基(含10%胎牛血清,50 μg/mL维生素C,0.1 μM 地塞米松,10 μM β-磷酸甘油钠), 完全培养基组作为阴性对照。每3天更换培养液,定向诱导分化14 d后,行茜素红染色,观察诱导分化结果。
1.5 细胞pellet培养及成软骨诱导
分别取CD204+和CD204-的第2代细胞,0.25%胰酶消化后,常规1500 r/min离心5min,MesenPRO RSTM培养液重悬后细胞计数,按0.5×106个细胞接种至15 mL离心管中,1080 r/min,37℃离心5min,即置于37℃、5%CO2、100%饱和湿度的培养箱内培养。
细胞pellet静置培养3 d后,每个15 mL离心管底可见细胞形成球状,此时即可更换成软骨诱导液。成软骨诱导液配方:高糖DMEM,1×ITS+,10 ng/mL TGF-β3, 10 ng/mL BMP-6, 50 ng/mL IGF-1, 0.1 μM地塞米松,50 μg/mL 维生素 C,40 μg/mL 脯氨酸。成软骨诱导4周后,进行大体观察和HE、Safranin O等组织学染色,以及Ⅱ型胶原免疫组化染色。
2 结果
2.1 分选后细胞形态学观察
脂肪来源细胞贴壁16 h后经流式分选,分别获得CD204+和CD204-两类细胞。CD204-组细胞3~4h后开始贴壁生长,24h后逐渐伸展开来,细胞呈成纤维细胞样,5 d后达到90%融合状态,并呈极性生长。CD204+细胞6~8 h开始贴壁生长,1~2 d伸展开来,细胞呈成纤维细胞样,7~10 d后达到90%融合状态(图 1)。
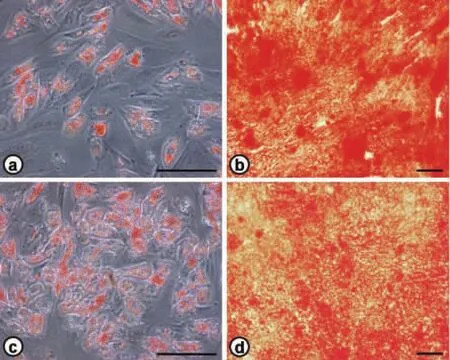
图2 脂肪来源干细胞成脂、成骨诱导分化(刻度:100 μm)Fig.2 ADSCs differentiation toward adipose lineage and osteogenic lineage(bar:100 μm).

图3 细胞pellet大体观Fig.3 Gross view of cell pellet
2.2 脂肪来源干细胞成脂、成骨分化
成脂诱导分化:经流式分选后,两组细胞形态类似成纤维细胞,长梭形,成脂诱导分化10 d后,细胞形态明显改变,从长梭形逐渐变圆,油红O染色阳性,且CD204+细胞具有更强的成脂潜能(图2)。
成骨诱导分化:CD204+和CD204-细胞被成骨诱导分化14 d后,茜素红染色示成骨细胞及钙沉积被红染,且CD204-细胞具有更强的成骨潜能(图2)。
2.3 细胞pellet大体及组织学检测
细胞pellet大体观:可见CD204-组形成了具有瓷白色透明软骨样外观的pellet,直径约2 mm,触之具有一定的弹性,而CD204+组外观微黄,触之柔软,直径约1 mm(图3)。
组织学和组织化学检测:HE染色可见CD204-pellet组形成明显软骨陷窝样结构,内有细胞核,周围有紫染的胞外基质沉积,而CD204+pellet未形成陷窝结构。Safranin O染色可见CD204-组具有软骨特异性基质染色,提示细胞外基质中含有丰富的蛋白多糖沉积。Ⅱ型胶原免疫组化染色结果与HE相符(图 4)。
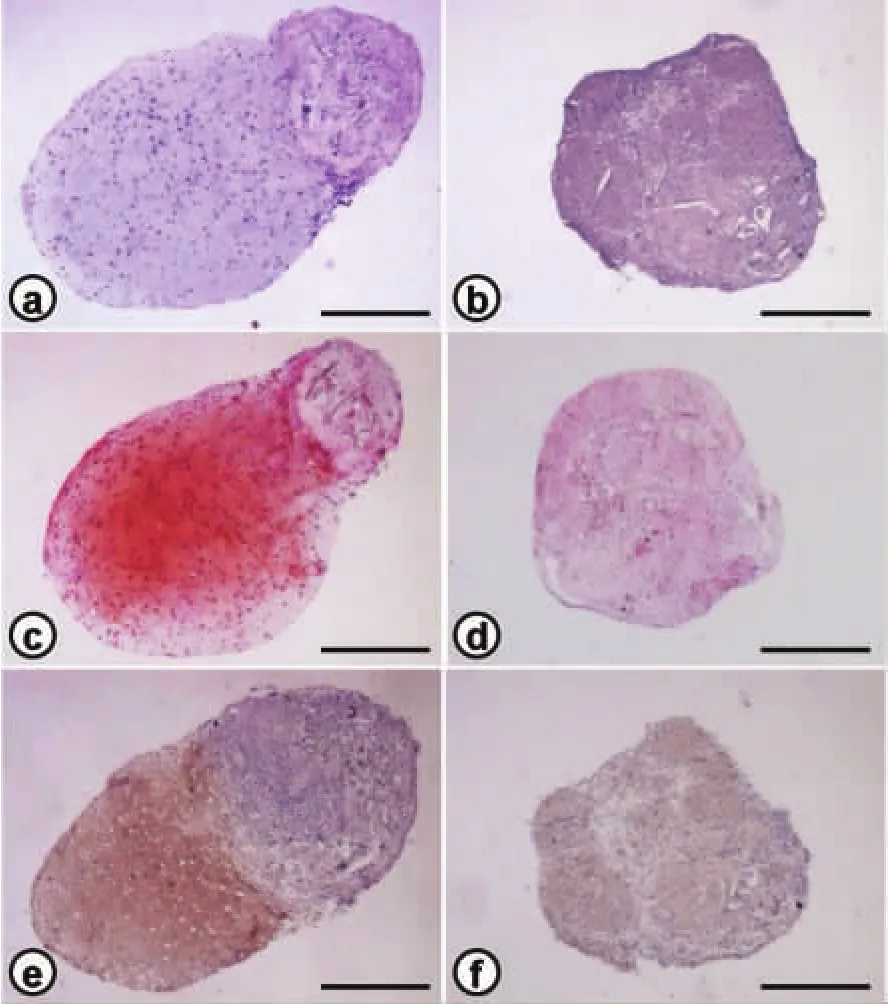
图4 pellet组织学检测(标准:100 μm)Fig.4 Histological observation of cell pellets(bar:100 μm).
3 讨论
脂肪来源干细胞(ADSCs)增殖能力强,具有向骨、软骨、脂肪、肌肉等组织多向分化的潜能,且细胞来源丰富,取材创伤小,是构建软骨组织的良好的种子细胞。然而,ADSCs是一混杂细胞群[2-4],包括脂肪前体细胞、成纤维细胞、内皮细胞、平滑肌细胞等,会干扰组织工程化软骨的构建。近年的研究显示,脂肪来源细胞中具有成脂、成骨、成软骨分化潜能细胞的比例存在很大差别,其中具有成软骨潜能的干细胞所占比例很低[5]。蒋婷等[6]应用已知干细胞表面标志CD105进行流式分选,发现CD105+细胞比CD105-细胞具有更好的成软骨潜能,但CD105+细胞构建的软骨组织均质性仍然欠佳。因此,我们尝试寻找与软骨潜能密切相关的表面标志。
前期基因芯片结果提示,CD204是ADSCs中与成软骨潜能关系较为密切的表面标志之一。本实验首次应用CD204作为表面标志,对ADSCs中具有成软骨潜能的细胞进行分离纯化,并对其干细胞特性及成软骨能力进行了初步探讨。结果显示,CD204-细胞比CD204+细胞具有更强的成软骨能力。该结果提示我们,脂肪来源细胞中具有成软骨潜能的干细胞主要存在于CD204-细胞中。但该结果与基因芯片分析结论大相径庭,可能是因为单细胞克隆体外扩增过程中细胞表型和特性发生较大改变。同时,CD204-细胞pellet组大体观和组织学结果显示pellet大部分形成了软骨样组织,但仍有小部分呈纤维化,提示CD204-细胞并非是一个非常均质的细胞群体,需要开展进一步的相关研究。
CD204是A类巨噬细胞清道夫受体蛋白,能调节细胞黏附、吞噬并在参与脂质代谢、防御外界病原微生物入侵等各种生理和病理方面起重要作用[7-10]。CD204通常被认为是M2型巨噬细胞的标志,常被用来区分M2型和M1型巨噬细胞。而M2型巨噬细胞被公认为在纤维化的早期阶段会释放大量促炎症因子和纤维调节因子,如TGF-β等,从而促进组织纤维化的发生[13]。将CD204缺失的老鼠暴露在二氧化硅的环境中,其炎症反应低下,IL-1β、TNF-α、IL-6等炎症因子产生减少,肺纤维化发生率下降[11-12],这些现象提示CD204在炎症的产生及纤维化的发生中有重要作用。另外,M2型巨噬细胞还与血管化过程和创伤修复过程密切相关[13,14]。同时,肥胖症患者中,巨噬细胞分泌的炎症因子(如TNF-α),能刺激脂肪细胞释放更多的金属基质蛋白酶,包括MMP1、MMP3、MMP9、MMP10、MMP12 和 MMP19 等[15]。 另有研究显示,脂肪组织中的巨噬细胞是通过脂肪前体细胞转变而来,在脂肪组织中的多少与年龄、性别和肥胖程度等有关[12]。
综上所述,CD204在炎症的发生及纤维化、血管化过程及创伤修复过程中有重要作用,这些可能是导致本实验中CD204+细胞不能被诱导形成软骨细胞的重要因素。通过流式分选去除约10%的CD204+细胞后,CD204-细胞诱导成软骨细胞的效果明显提高,且CD204-细胞pellet能被诱导成较均质的软骨。然而,经过分选纯化后的CD204-细胞中并不是所有细胞都具有成软骨潜能。因此,要真正将这部分细胞用于特定组织的构建与缺损修复,还需要进一步深入研究。
[1]Arevalo-Silva CA,Cao YL,Weng YL,et al.The effect of fibroblast growth factorand transforming growth factor-β on porcine chondrocytes and tissue-engineered autologous elastic cartilage[J].Tissue Eng,2001,7(1):81-88.
[2]Zuk PA,Zhu M,Mizuno H,et al.Multilineage cells from human adipose tissue:implications for cell-based therapies[J].Tissue Eng,2001,7(2):211-228.
[3]Yoshimura K,Shigeura T,Matsumoto D,et al.Characterization of freshly isolated and cultured cells derived from the fatty and uid portions of liposuction aspirates[J].Cell Physiol,2006,208(1):64-76.
[4]刘凯,吕晓杰,周广东,等.原代脂肪基质细胞增殖前后细胞表面标志变化的研究[J].组织工程与重建外科,2006,2(3):128-130.
[5]张英,周广东,杨平,等.脂肪来源细胞体外增殖规律及定向诱导分化研究[J].分子细胞生物学报,2006,39(2):152-162.
[6]Jiang T,Liu W,Lu X,et al.Potent in vitro chondrogenesis of CD105 enriched human adipose-derived stem cells[J].Biomaterials,2010,31(13):3564-3571.
[7]J zefowski S,Arredouani M,Sulahian T,et al.Disparate regulation and function of the class A scavenger receptors SR-AI/II and MARCO[J].J Immunol,2005,175(12):8032-8041.
[8]Husemann J,Loike JD,Anankov R,et al.Scavenger receptors in neurobiology and neuropathology:their Role on microglia and other cells of the nervous system[J].Glia,2002,40(2):195-205.
[9]Komohara Y,Terasaki Y,Kaikita K,et al.Clearance of apoptotic cells is not impaired in mouse embryos de-cient in class a scavenger receptor types I and II(CD204)[J].Dev Dyn,2005,232(1):67-74.
[10]Mosser DM.The many faces of macrophage activation [J].Leukoc Biol,2003,73(2):209-212.
[11]Beamer CA,Holian A.Scavenger receptor class A type I/II(CD204)null mice fail to develop fibrosis following silica exposure [J].Am J Physiol Lung Cell Mol Physiol,2005,289(2):186-195.
[12]Ortega E,Xu X,Koska J,et al.Macrophage content in subcutaneous adipose tissue:associations with adiposity,age,inflammatory markers,and whole-body insulin action in healthy Pima Indians[J].Diabetes,2009,58(2):385-393.
[13]Higashi-Kuwata N,Jinin M,Makino T,et al.Characterization of monocyte/macrophage subsets in the skin and peripheral blood derived from patients with systemic sclerosis[J].Arthritis Res Ther,2010,12(4):R128.
[14]Yi H,Yu X,Gao P,et al.Pattern recognition scavenger receptor SRA/CD204 down-regulates Toll-like receptor 4 signalingdependent CD8 T-cell activation [J].Blood,2009,113(23):5819-5828.
[15]O'Hara A,LIim FL,Mazzatti DJ,et al.Microarray analysis identifies matrix metalloproteinases(MMPs)as key genes whoseexpression is up-regulated in human adipocytes by macrophage-conditioned[J].Pflugers Arch,2009,458(6):1103-1114.
