从2型糖尿病发病机制看DPP-4抑制剂的疗效优势
2012-12-08华中科技大学同济医学院附属同济医院内分泌科胡蜀红余学锋
华中科技大学同济医学院附属同济医院内分泌科 胡蜀红 余学锋
目前2型糖尿病的流行的日趋严重,亚洲国家包括中国在内近年糖尿病的发展速度已经超过西方发达国家[1],在20岁以上的中国人群中年龄标化的糖尿病患病率为9.7%,而糖尿病前期的比例高达15.5%[2]。UKPDS研究表明早期严格控制血糖可以明显减少2型糖尿病的各种并发症以及降低死亡率[3]。
2型糖尿病胰岛B细胞功能进行性减退
2型糖尿病的发病机制复杂,是遗传因素和环境因素共同作用的结果。不同人种、不同地域和不同生活习惯的人群发病各部相同。其关键的发病机制是胰岛素抵抗驱动下胰岛B细胞功能进行性衰竭的疾病。2型糖尿病的危险人群(包括2型糖尿病高危种族,2型糖尿病患者的一级亲属,肥胖、高脂血症高血压患者等)胰岛素抵抗的早期可通过代偿性分泌相对较多的胰岛素来维持糖耐量正常(NGT),当B细胞代偿能力开始下降就表现为糖尿病前期,即糖耐量异常(IGT)和/或空腹血糖受损(IFG)。随着胰岛素抵抗的持续性存在,B细胞代偿能力进一步下降,血糖进一步升高,即发生临床糖尿病。在2型糖尿病的发生和发展的病理生理机制方面,尽管资料还不十分充分,也有资料显示东西方人群可能有差异,即东方人群胰岛素分泌功能较西方人群差,例如美国SWAN研究表明日裔和华裔绝经前和绝经早期女性非糖尿病人群反应胰岛素分泌功能的指标HOMA-β低于西方人群[4]。而且日本的研究发现早相分泌功能减退是糖耐量恶化的主要因素[5],国内研究也表明[6],糖尿病前期人群已存在胰岛B细胞早相分泌功能下降。而进入糖尿病阶段后胰岛功能下降更加明显,UKPDS研究早已发现2型糖尿病患者在刚刚被诊断时胰岛素分泌能力已经下降50%,以后逐渐下降,大约每年下降4%。李光伟等[7]在中国新诊断的2型糖尿病患者的调查发现:FPG≥9.7mmol/L组胰岛素敏感性为正常组的30%,胰岛素分泌功能仅为正常组的5%;在FPG<9mmol/L组,胰岛素敏感性能解释70%的血糖水平变化,而在FPG高于≥9mmol/L组,胰岛素分泌能解释60%的血糖变化。虽然没有直接与西方人群做比较,这组资料显示中国2型糖尿病患者胰岛功能衰竭似乎更严重。而且随糖尿病病程的延长,在糖毒性、脂毒性、慢性炎症状态等多种病理因素作用下B细胞功能呈现进行性下降,B细胞凋亡增加,导致B细胞量减少,最后胰岛素分泌量绝对不足,即进入到所谓在治疗上“胰岛素依赖”的2型糖尿病阶段。
2型糖尿病胰岛A细胞和肠促胰岛素的作用
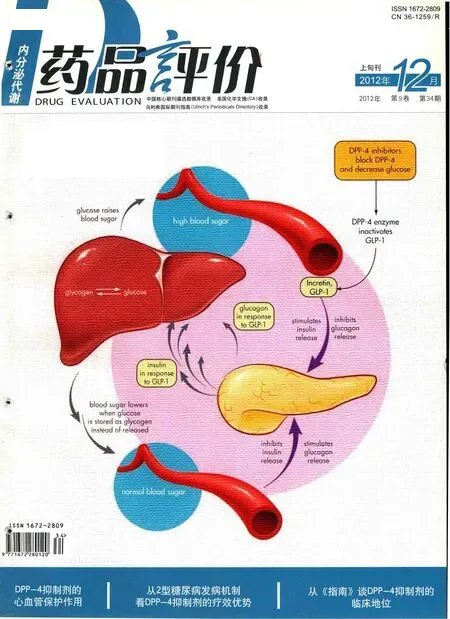
如前所述,B细胞功能的衰竭是2型糖尿病进展的决定性因素,同时胰岛A细胞功能紊乱也是2型糖尿病糖代谢失调的一个重要因素,这一点在以前的治疗中时被忽视的。B细胞分泌胰岛素降低血糖,A细胞分泌胰高糖素升高血糖,两者共同调节血糖平衡。
正常人在血糖升高时胰岛B细胞兴奋,胰岛素分泌增加;同时胰岛A细胞受抑制,胰高糖素分泌减少。但在2型糖尿病患者胰岛细B胞功能减退、胰岛素分泌减少的同时,胰岛A细胞不受抑制,胰高糖素分泌不减少[8],2型糖尿病患者胰岛A细胞/B细胞比例明显升高,绝对空腹胰高糖素水平高于正常受试者,高血糖诱导抑制胰高糖素释放的作用丧失[9]。因此,2型糖尿病患者胰岛素分泌不足和胰高糖素分泌增加共同导致高血糖[10],此即2型糖尿病发生的“双激素”理论。肠促胰岛素(incretin)包括由回肠和结肠的L细胞分泌的胰高糖素样肽-1(GLP-1)和由十二指肠和空肠的K细胞分泌的葡萄糖依赖性促胰岛素分泌多肽(GIP),其中GLP-1的作用最为突出。GLP-1通过与GLP-1受体结合发挥作用。GLP-1刺激B细胞呈葡萄糖依赖性分泌胰岛素和呈葡萄糖依赖性抑制A细胞分泌胰高糖素。血液中的葡萄糖是胰岛素分泌的直接刺激物,但在食物进入肠道尚未完全分解吸收进入血液之前就可通过肠道分泌GLP-1,提前刺激胰岛素的分泌,所以口服葡萄糖和静脉注射葡萄糖在达到同样血糖浓度的前提下,口服葡萄糖促进胰岛素分泌的量更大[11]。GLP-1可以改善A细胞对血糖变化的感知[12]。临床研究也发现糖尿病前期和2型糖尿病患者餐后GLP-1的分泌量是减少的[13]。GLP-1可增强2型糖尿病患者早相及晚相胰岛素分泌[14]。
2型糖尿病治疗的艰巨性以及DPP-4抑制剂的优势
传统治疗糖尿病药物主要包括胰岛素增敏剂(二甲双胍、噻唑烷二酮类药物)、胰岛素促泌剂(磺脲类药物和苯甲酸类药物)和α-糖苷酶抑制剂。此外,对于极度肥胖的2型糖尿病患者还可以采用减重手术治疗。2型糖尿病的预防和早期治疗重点应该着眼于改善胰岛素抵抗。多个大型临床研究显示生活方式干预以及改善胰岛素抵抗的药物可以有效地预防2型糖尿病的发生,而胰岛素促泌剂却达不到这样的效果。在糖尿病阶段除继续改善胰岛素抵抗外,延缓B细胞衰竭、改善B细胞功能、促进B细胞再生是长期良好控制治疗的关键,如早期强化胰岛素治疗、减重手术、噻唑烷二酮类药物的相关研究。因此,在众多的治疗措施中能够长久控制血糖达标的药物或方案才能给患者带来最大受益,笔者认为要达到这一目的有两点是至关重要的:第一是治疗时机的问题,即在2型糖尿病病程的早期开始治疗;第二是治疗的措施应该有助于改善和恢复胰岛细胞功能,而不是单纯刺激胰岛素的释放。多项临床研究表明无论是磺脲类药物或二甲双胍治疗都难以持久控制血糖,随着治疗时间的延长,糖化血红蛋白(HbA1c)逐年升高,多数患者需要联合用药或启动胰岛素治疗,究其原因与胰岛功能衰竭直接相关。如前所述噻唑烷二酮类胰岛素增敏剂因其改善胰岛素抵抗和改善B细胞功能可相对较长时间控制血糖,但噻唑烷二酮类药物特别是罗格列酮对心血管的不良影响以及其他不良反应(水肿、体重增加、骨折和膀胱癌等)而限制了该类药物的使用。此外,磺脲类药物和胰岛素易引起低血糖和体重增加,二甲双胍和α-糖苷酶抑制剂胃肠道反应较明显。因此,我们需要有效、安全、可长期使用和持久控制血糖的药物或治疗方案。肠促胰岛素类药物的问世为糖尿病的治疗带来了新的希望。
由于肠道分泌的GLP-1进入血液后很快被二肽基肽酶-4(DPP-4)降解失活,GLP-1的血浆半衰期的只有2min,直接将人工合成的GLP-1用做药物必须持续皮下或静脉输注,给临床工作带来极大不便。因此,目前开发肠促胰岛素类药物有不受DPP-4分解的GLP-1类似物或DPP-4抑制剂(延长GLP-1血浆半衰期),前者必须皮下注射给药,价格相对昂贵,也限制了其临床应用,而后者(DPP-4抑制剂)为口服用药,应用方便,价格也较前者便宜,而且胃肠道不良反应相对较少、较轻,因而更适合临床应用。
尽管临床应用时间还不是太长,DPP-4抑制剂已经显示出其良好的降糖效果和安全性。如DPP-4抑制剂类的西格列汀可使空腹血糖下降1.7~1.8mmol/L,餐后血糖下降3.1~4.5mmol/L,HbA1c下降0.5%~1.0%,同时可明显减少24h血糖波动。在新诊断的2型糖尿病患者中DPP-4抑制剂西格列汀与二甲双胍的研究显示,西格列汀单药治疗24周可降低HbA1c0.43%,而二甲双胍组下降0.57%,西格列汀单药降低HbA1c非劣效于二甲双胍[15],而在亚洲人群,包括中国、印度和韩国人的初发2型糖尿病中可使HbA1c下降1.0%[16],对于基线HbA1c>9%的老年患者,西格列汀可使HbA1c下降1.6%。有研究显示,对单用二甲双胍血糖控制不佳的2型糖尿病患者,加用沙格列汀2.5mg、5mg、10mg,各组的HbA1c较基线平均下降0.59%、0.69%、0.58%,而对照组上升0.13%,疗效显著优于对照组(P<0.01)。在与伏格列波糖头对头的比较研究中西格列汀的降糖作用优于伏格列波糖。一项涉及768例患者的Ⅲ期临床试验结果显示,沙格列汀联合格列本脲组比格列本脲增量组更有效。持续2年的研究发现如果2型糖尿病患者在发病起始就联合应用西格列汀和二甲双胍则降低HbA1c的幅度比两者之一单用更明显,且更平稳[17]。另一个两年的持续性研究表明二甲双胍联合西格列汀的降糖持续性优于二甲双胍联合磺脲类药物。
在胰岛保护方面的研究证据也很多。动物研究发现西格列汀增加糖尿病小鼠胰岛B细胞数量,增加胰岛的胰岛素含量,增加葡萄糖和氯化钾刺激的胰岛素分泌,而磺脲类药物的格列吡嗪无此作用。临床研究证实,西格列汀不管是单药治疗还是联合二甲双胍治疗都能显著改善2型糖尿病患者胰岛素分泌质量,表现为胰岛素原与胰岛素比值下降,HOMA-β增加,升高I/G比值。荟萃多项研究发现,西格列汀用药组改善B细胞功能的标志物[18]。
DPP-4抑制剂有着良好的安全性。DPP-4抑制剂不增加体重,无明显低血糖和胃肠道不良反应(此点有别于GLP-1受体激动剂)。因此,和其他类型降糖药物相比更适合于长期应用。DPP-4的临床试验未发现其对心血管系统的不良反应,不增加心血管死亡率,而且动物实验研究还显示可以改善心肌组织结构。DPP-4抑制剂不增加癌症发生率。包含67个临床研究的荟萃分析(其中干预时间最长达2年)对DPP-4抑制剂的安全性进行汇总分析显示DPP-4组严重不良事件和因为不良反应而停药的比例接近于安慰剂,各组(西格列汀)总体死亡率相似。DPP-4抑制剂在不与磺脲类药物或胰岛素联合时的低血糖发生率相当于安慰剂组,但在与磺脲类药物或胰岛素联合时的低血糖发生率低血糖的发生率增加。同时未发现DPP-4应用人群感染机会增加[19]。
最新发表的一篇基于26个临床研究(活性药物对照)的系统评价,包括12个DPP-4抑制剂和二甲双胍单药治疗头对头的比较,以及在和二甲双胍联用中DPP-4抑制剂与磺脲类药物比较的9个研究、与吡格列酮比较的4个研究以及与GLP-1受体激动剂比较的的3个研究的比较。DPP-4抑制剂组7136例,其他组6745例。临床研究时间最少12周,最长≥52周。终点时间为HbA1c较基线的下降。主要结论:DPP-4抑制剂单药治疗降HbA1c效果稍差于二甲双胍;和二甲双胍联用时稍差于GLP-1,但二甲双胍和GLP-1因为不良反应而退出者较多;DPP-4抑制剂和二甲双胍联用时等效于胰岛素促泌剂(SU)和噻唑烷二酮类胰岛素增敏剂(吡格列酮)。体重增加和其他不良反应优于磺脲类药物和胰岛素增敏剂,低血糖少于磺脲类药物。鼻咽炎、泌尿系感染和上呼吸道感染没有增加[20]。因此DPP-4抑制剂更适合于不耐受二甲双胍以及单用二甲双胍失效后的联合用药。因此,DPP-4抑制剂更适合于长期使用。
DPP-4抑制剂单药治疗主要用于轻、中度糖尿病,可以和多种降糖药物联合使用,包括二甲双胍、磺脲类药物、噻唑烷二酮类药物以及胰岛素等。DPP-4抑制剂对二甲双胍、格列本脲、辛伐他汀、华法令或口服避孕药等药物的药代动力学不会产生有临床意义的影响。
[1] Yoon KH, Lee JH, Kim JW.Epidemic obesity and type 2 diabetes in Asia[J].Lancet, 2006, 368:1681-1688.
[2] 中华医学会糖尿病学分会.中国2型糖尿病防治指南(2010版)[M].北京:北京大学医学出版社, 2011.
[3] HolmanRR, Paul SK, Bethel MA, et al.10-Year Follow-up of Intensive Glucose Control in Type 2 Diabetes[J].N Engl J Med, 2008, 359:1577-1589.
[4] Torrens JI, Skurnick J, Davidow AL, et al.Ethnic differences in insulin sensitivity and b-cell function in premonopausal or early perimenopausal women without diabetes[J].Diabetes Care, 2004, 27:354-361.
[5] Yoshinaga H, Kosaka K.Heterogeneous relationship of early insulin response and fasting insulin level with development of non-insulin-dependent diabetes mellitus in non-diabetic Japanese subjects with or without obesity[J].Diabetes Res Clin Pract, 1999, 44(2):129-136.
[6] Pang C, Bao YQ, Wang C, et al.Relationship between the level of fasting plasma glucose and beta cell functions in Chinese with or without diabetes[J].Chin Med J, 2008, 121(21):2119-2113.
[7] 李光伟.中国新诊断2型糖尿病患者胰岛素分泌和胰岛素抵抗特点调查[J].中华内分泌代谢杂志, 2008, 24(3):256-260.
[8] Ward WK, Bolgiano DC, McKnight B, et al.Diminished B cell secretory capacity in patients with noninsulin-dependent diabetes mellitus[J].J Clin Invest, 1984, 74(4):1318-1328.
[9] Dunning BE, Foley JE, Ahren B.Alpha cell function in health and disease:influence of glucagon-like peptide-1[J].Diabetologia, 2005, 48:1700-1713.
[10] Muller WA, Faloona GR, Aguilar-Parada E, et al.Abnormal aipha- cell function in diabetes.Response to carbohydrate and protein ingestion[J].N Engl J Med, 1970, 283:109-115.
[11] Nauck MA, Homberger E, Siegel EG, et al.Incretin effects of increasing glucose loads in man calculated from venous insulin and C-peptide responses[J].Clin Endocrinol Metab, 1986, 63(2):492-498.
[12] Dunning BE, Foley JE, Ahren B.Alpha cell function in health and disease:influence of glucagon-like peptide-1[J].Diabetologia, 2005, 48(9):1700-1713.
[13] Zhang F, Tang X, Cao H, et al.Impaired Secretion of Total Glucagon-like Peptide-1 in People with Impaired Fasting Glucose Combined Impaired Glucose Tolerance[J].Int J Med Sci, 2012, 9(7):574-581.
[14] Vilsboll T, Knop FA, Krarup T, et al.The pathophysiology of diabetes involves a defective amplification of the late-phase insulin response to glucose by glucosedependent insulinotropic polypeptide-regardless of etiology and phenotype[J].J Clin Endocrinol Metab, 2003, 88:4897-4903.
[15] Aschner P, Katzeff HL, Guo H, et al.Sitagliptin Study 049 Group.Efficacy and safety of monotherapy of sitagliptin compared wit metformin in patients with type 2 diabetes[J].Diabetes Obes Metab, 2010, 12:252-261.
[16] Mohan V, Yang W, Son HY, et al.Efficacy and safety of sitagliptin in the treatment of patients with type 2 diabetes in China, India, and Korea[J].Diabetes Res Clin Pract, 2009, 83:106-116.
[17] Williams-Herman D, Johnson J, Teng R, et al.Efficacy and safety of Sitagliptin and metformin as initial combination therapy and as monotherapy over 2 years in patients with type 2 diabetes[J].Diabetes Obes Metab, 2010, 12:442-451.
[18] Riche DM, East HE, Riche KD.Impact of sitagliptin on markers of beta-cell function:a meta-analysis[J].Am J Med Sci, 2009, 337(5):321-328.
[19] GooBen K, Graber S.Longer term safety of dipeptidyl peptidase-4 inhibitors in patients with type 2 diabetes mellitus:systematic review and meta-analysis[J].Diabetes Obes Metab, 2012, 14:1061-1072.
[20] Karagiannis T, Paschos P, Paletas K, et al.Dipeptidyl peptidase-4 inhibitors for treatment of type 2 diabetes mellitus in the clinical setting:systematic review and meta-analysis[J].Bri med J, 2012, 344:e1369.