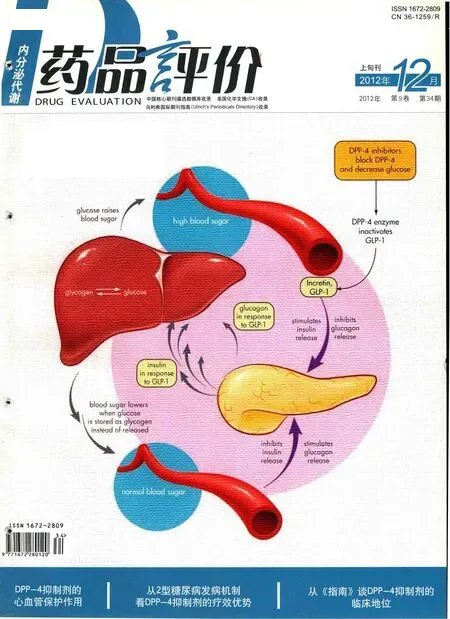
DPP-4抑制剂的降糖作用机制
2012-12-08中山大学附属第一医院内分泌科何筱莹李延兵
中山大学附属第一医院内分泌科 何筱莹 李延兵
上个世纪三十年代,法国人La Barre首次提出了“肠促胰素”这一概念。近年来的研究加深了人们对肠促胰素的认识,并且催生了一种新型的口服降糖药物——二肽基肽酶-4 (DPP-4)抑制剂,它可以提高血液中内源性GLP-1和GIP的浓度,并最终改善血糖控制。目前已有数种DPP-4抑制剂在部分国家上市销售。这些药物的化学结构和药效/代动力学或许各有差异,但它们都能有效地降低血糖(HbA1c降低0.5%~1%)并具有良好的耐受性。本文将着重从A细胞和B细胞的双向调节方面阐述此类药物的作用机制。
肠促胰素效应与糖尿病
“肠促胰素效应”指的是口服葡萄糖与静脉输注等量的葡萄糖相比,尽管后者可达到比前者更高的血糖水平,但前者能引起更强的胰岛素分泌反应。人体在进食后,肠道受到饮食中脂肪和碳水化合物的刺激,以营养素依赖性的方式释放GLP-1和GIP等数种多肽,它们通过与胰岛B细胞表面的受体结合,增强胰岛素分泌囊泡的胞吐作用。GLP-1由位于小肠远端(回肠)和结肠的L细胞分泌,而GIP则由位于十二指肠的K细胞分泌[1]。正常人体在空腹状态下血浆中这两种激素的水平都很低,进餐后的数分钟内它们的血浆水平会迅速升高,并发挥葡萄糖依赖性的促胰岛素分泌作用,从而降低餐后血糖。除了促胰岛素分泌作用之外,GLP-1还可以抑制胰岛A细胞释放胰高糖素,从而减少肝糖输出。与促胰岛素释放作用相似,GLP-1对胰高糖素的抑制作用也依赖于血浆中的葡萄糖水平,在低于正常空腹血糖水平的状态下,GLP-1的抑制作用消失,从而降低了低血糖的发生风险。此外,GLP-1还可以通过胰腺内外的多个途径和机制共同参与血糖稳态调节:①诱导前胰岛素基因的转录,促进胰岛素的生物合成和分泌。②刺激B细胞增殖和再生、抑制其凋亡,维持B细胞的数量和功能。③抑制胃酸分泌、延缓胃排空、增强中枢饱腹感,从而抑制食欲、减轻体重。④增加外周肌肉组织对葡萄糖的摄取和利用。⑤增加葡萄糖转运蛋白2(GLUT-2)表达,提高B细胞对葡萄糖的反应。⑥促进胰岛D细胞分泌生长抑素,生长抑素又作为旁分泌激素参与抑制胰高糖素的分泌。与GLP-1不同的是,GIP没有抑制胰高糖素释放和延缓胃排空的作用;但它可以刺激脂类的合成,并延缓胰岛素的清除[2]。
在2型糖尿病患者中,糖刺激后的GLP-1分泌显著减少,但它的肠促胰岛素作用仍然得到比较好的保留[3]。与之相反,GIP在2型糖尿病患者中的分泌量虽然基本正常或升高,但其促胰岛素分泌作用却明显受损或减弱[4]。因此,2型糖尿病患者中肠促胰素效应的减弱主要由GLP-1的分泌受损和GIP的活性丧失有关。究竟是肠促胰岛素的分泌和作用缺陷导致了2型糖尿病的发生发展,还是糖尿病导致了这些缺陷,目前尚无定论。但2型糖尿病疾病进展的最终结果表现为胰岛功能的进行性衰退,包括胰岛素分泌的进行性下降和胰高糖素的不适当分泌增加,从而造成胰岛素和胰高糖素比例的失调。既往在大量动物和人体中开展的研究已证实,给予2型糖尿病患者输注GLP-1达到血浆药物治疗浓度后,可增加葡萄糖刺激的胰岛素释放、减少胰高糖素分泌、并延缓胃排空,使餐后和空腹血糖恢复正常。肠促胰岛素可以通过对A细胞和B细胞进行双向调节来改善血糖控制,由此我们可以认为,肠促胰岛素是2型糖尿病的合理治疗靶点[5]。
肠促胰素虽然在血糖调节中发挥着如此重要的作用,但体内广泛存在的DPP-4酶会令其迅速的失活(GLP-1半衰期为1~2min,GIP为7min)[1]。DPP-4酶抑制剂通过减少GLP-1的降解,延长其活性,使之发挥其刺激胰岛素释放、抑制胰高糖素分泌的作用,从达到控制血糖水平的目的。
A细胞在血糖调节中的意义及DPP-4对A细胞的调节作用
A细胞分泌胰高糖素的功能受许多神经内分泌因素的调节,其中包括血糖水平、血浆胰岛素水平、以及肠促胰岛素水平。胰高糖素作用于肝细胞会促进糖原分解和糖异生,并抑制糖酵解和糖原合成[6]。调控这一过程的主要因素是胰高糖素∶胰岛素比值,而不是单纯的胰高糖素水平。Taylor等[7]人开展的研究表明,健康人在进食混合餐后会出现血浆胰高糖素∶胰岛素比值的降低,这一比值的降低与餐后30min肝糖输出的抑制以及肝糖原合成的上调相关联,而这些数值都在进餐后的数小时内回复到基线水平。早期的研究给健康非肥胖受试者注射生长抑素和胰岛素以造成选择性的胰高糖素缺乏,结果提示肝糖输出的程度主要取决于胰高糖素的水平。在2型糖尿病患者中,生理机制对内源性葡萄糖生成的抑制作用被削弱。Kelley等[8]人比较了混合餐对2型糖尿病患者及健康受试者的血糖影响,结果显示2型糖尿病患者的餐后血糖显著高于健康受试者,而血糖升高则主要由内源性葡萄糖生成的增多所导致。内源性葡萄糖生成抑制作用的减弱主要与A细胞对葡萄糖敏感性的降低有关。Ward等[9]人在2型糖尿病患者中检测了不同血糖水平条件下精氨酸刺激后的急性胰高糖素释放反应,结果显示在各个血糖水平,2型糖尿病患者的胰高糖素分泌量都显著高于对照组,而且胰高糖素分泌量减半时所对应的血糖水平也显著高于对照组,这提示2型糖尿病患者的A细胞对葡萄糖的反应性降低。此外,对人胰岛细胞的病理学观察也显示,2型糖尿病患者胰岛中的A细胞含量不成比例的增多,由此可以推测,A细胞数量增多也是导致2型糖尿病患者胰高糖素不适当分泌增多的一个机制[10]。
如上所述,GLP-1可以有效抑制A细胞分泌胰高糖素,而DPP-4酶抑制剂可以抑制体内DPP-4酶对GLP-1的降解作用,从而提高血液中GLP-1的浓度。Takeda等[11]人开展的动物实验显示,注射链脲佐菌素的小鼠在发生糖尿病后可观察到A细胞的增生,但在接受DPP-4抑制剂治疗的小鼠中则没有出现这一情况。Ahren等[12]人的研究显示,在接受维格列汀治疗4周的2型糖尿病患者中,血循环中GLP-1的浓度显著升高,而标准餐后的血浆胰高糖素水平和血糖水平显著下降。Farngren等[13]人开展的一项研究提示,DPP-4抑制剂同样可以改善1型糖尿病患者的A细胞功能。1型糖尿病患者在接受维格列汀治疗4周后,餐后血胰高糖素水平(餐后120min胰高糖素曲线下面积)显著低于接受安慰剂治疗的人群(2.4±0.2nmol·L-1·min-1vs 2.6±0.2nmol·L-1·min-1,P=0.022)。
B细胞在血糖调节中的意义及DPP-4对B细胞的保护作用
在生理的状态下,B细胞是以一种葡萄糖依赖性的方式分泌胰岛素,当血糖超出生理范围时,B细胞释放胰岛素将血糖维持在正常水平。B细胞功能缺陷是2型糖尿病发病的必要条件。B细胞功能受损在2型糖尿病发病早期、出现空腹血糖异常以前就已存在,表现为胰岛素分泌第一时相受损、第二时相分泌代偿性增加。而根据UKPDS研究的结果,在患者诊断2型糖尿病时,已有超过50%的B细胞功能丧失,并且随着疾病的进展,B细胞的功能会出现不断的恶化。通过尸检对胰岛直接进行观察的结果显示,2型糖尿病供者的胰岛大小以及数量、B细胞数量、B细胞和A细胞比值都显著少于非2型糖尿病供者。另外,Deng等[14]人所开展的一项尸检研究也提示,胰岛数量的减少与2型糖尿病的病程相关,病程越长的供者胰腺中胰岛的数量越少。这可以部分的解释2型糖尿病病程中胰岛素分泌减少的原因,但值得一提的是,早期通过正确的治疗干预,B细胞的衰亡是部分可逆的。随着胰岛B细胞衰亡的不断加剧,残余有功能的B细胞会代偿性的分泌更多的胰岛素,但这种代偿机制在2型糖尿病进展的过程中也会逐渐丧失。
GLP-1可以通过增加胰岛素mRNA的稳定型、上调胰岛素的基因转录和生物合成来补充B细胞的胰岛素储存量、防止B细胞耗竭。动物研究显示,与安慰剂相比,DPP-4抑制剂维格列汀可以通过增强B细胞复制和减少凋亡来增加新生小鼠的胰岛B细胞数量(0.06±0.01mg vs 0.11±0.02mg,P<0.05)[15]。西格列汀和维格列汀是最早应用于临床的两种DPP-4抑制剂,多项临床研究显示,这两种药物都可有效改善2型糖尿病患者的血糖水平,HbA1c平均可下降0.5%~1.0%[16]。西格列汀和维格列汀都被认为可以对B细胞功能起到保护作用。一项在441例格列美脲单药治疗或格列美脲联合二甲双胍治疗血糖控制不佳的2型糖尿病患者中开展的随机、安慰剂对照研究显示,西格列汀治疗后的空腹胰岛素水平(1.8uIU/ml,P<0.001)和HOMA-B(11.3%,P=0.020)显著升高,但空腹胰岛素原水平和胰岛素原∶胰岛素比值无明显变化[17]。另一项随机、双盲、安慰剂对照研究显示,在接受为期52周的维格列汀和安慰剂治疗后,试验组的急性C肽反应指数较基线升高5.0±1.8nmol·L-1·min-1,而安慰剂组则下降0.8±1.8nmol·L-1·min-1(P=0.030)[18]。前期这些令人振奋的研究结果令学者们希望进一步探究,将DPP-4抑制剂用于糖尿病前期的患者是否可以逆转糖耐量受损的状况和预防2型糖尿病的发生。目前已有一系列相关的研究正在开展。
总 结
总而言之,2型糖尿病是A细胞和B细胞双向调节障碍所导致的疾病。既往学者们对于B细胞分泌胰岛素作用缺陷在2型糖尿病发生发展中所起的作用已得到很好的认识,但A细胞不适当分泌胰高糖素所起的作用却远远被低估。胰高糖素在维持血糖稳态中起到非常重要的作用,正常的A细胞功能有助于避免低血糖和保持餐后血糖波动在正常的生理范围之内。2型糖尿病患者A细胞功能缺陷导致A细胞对血糖敏感性降低,表现为绝对或相对的高胰高糖素血症,从而导致肝糖输出不适当增加。以肠促胰岛素为基础的DPP-4抑制剂可以针对A细胞和B细胞进行双向调节,一方面调节A细胞以减少高血糖状态下的胰高糖素不适当分泌;另一方面保护B细胞增加胰岛素的分泌,从而针对2型糖尿病的发病机制发挥更全面的降糖作用。
[1] Drucker DJ.The role of gut hormones in glucose homeostasis[J].J Clin Invest, 2007, 117(1):24-32.
[2] Bastien-Dionne PO, Valenti L, Kon N, et al.Glucagon-like peptide 1 inhibits the sirtuin deacetylase SirT1 to stimulate pancreatic B-cell mass expansion[J].Diabetes, 2011, 60(12):3217-3222.
[3] Vilsboll T, Agerso H, Krarup T, et al.Similar elimination rates of glucagon-like peptide-1 in obese type 2 diabetic patients and healthy subjects[J].J Clin Endocrinol Metab, 2003, 88(1):220-224.
[4] Knop FK, Vilsboll T, Hojberg PV, et al.Reduced incretin effect in type 2 diabetes:cause or consequence of the diabetic state?[J].Diabetes, 2007, 56(8):1951-1959.
[5] Del Prato S, Marchetti P.Beta- and alpha-cell dysfunction in type 2 diabetes[J].Horm Metab Res, 2004, 36(11-12):775-781.
[6] Jiang G, Zhang BB.Glucagon and regulation of glucose metabolism[J].Am J Physiol Endocrinol Metab, 2003, 284(4):E671-678.
[7] Taylor R, Magnusson I, Rothman DL, et al.Direct assessment of liver glycogen storage by 13C nuclear magnetic resonance spectroscopy and regulation of glucose homeostasis after a mixed meal in normal subjects[J].J Clin Invest, 1996, 97(1):126-132.
[8] Kelley D, Mokan M, Veneman T.Impaired postprandial glucose utilization in noninsulin-dependent diabetes mellitus[J].Metabolism, 1994, 43(12):1549-1557.
[9] Ward WK, Bolgiano DC, McKnight B, et al.Diminished B cell secretory capacity in patients with noninsulin-dependent diabetes mellitus[J].J Clin Invest, 1984, 74(4):1318-1328.
[10] Deng S, Vatamaniuk M, Huang X, et al.Structural and functional abnormalities in the islets isolated from type 2 diabetic subjects[J].Diabetes, 2004, 53(3):624-632.
[11] Takeda Y, Fujita Y, Honjo J, et al.Reduction of both beta cell death and alpha cell proliferation by dipeptidyl peptidase-4 inhibition in a streptozotocin-induced model of diabetes in mice[J].Diabetologia, 2012, 55(2):404-412.
[12] Ahren B, Landin-Olsson M, Jansson PA, et al.Inhibition of dipeptidyl peptidase-4 reduces glycemia, sustains insulin levels, and reduces glucagon levels in type 2 diabetes[J].J Clin Endocrinol Metab, 2004, 89(5):2078-2084.
[13] Farngren J, Persson M, Schweizer A, et al.Vildagliptin Reduces Glucagon during Hyperglycemia and Sustains Glucagon Counterregulation during Hypoglycemia in Type 1 Diabetes[J].J Clin Endocrinol Metab, 2012, 97(10):3799-3806.
[14] Yoon KH, Ko SH, Cho JH, et al.Selective beta-cell loss and alpha-cell expansion in patients with type 2 diabetes mellitus in Korea[J].J Clin Endocrinol Metab, 2003, 88(5):2300-2308.
[15] Mu J, Petrov A, Eiermann GJ, et al.Inhibition of DPP-4 with sitagliptin improves glycemic control and restores islet cell mass and function in a rodent model of type 2 diabetes[J].Eur J Pharmacol, 2009, 623(1-3):148-154.
[16] Neumiller JJ, Wood L, Campbell RK.Dipeptidyl peptidase-4 inhibitors for the treatment of type 2 diabetes mellitus[J].Pharmacotherapy, 2010, 30(5):463-484.
[17] Hermansen K, Kipnes M, Luo E, et al.Efficacy and safety of the dipeptidyl peptidase-4 inhibitor, sitagliptin, in patients with type 2 diabetes mellitus inadequately controlled on glimepiride alone or on glimepiride and metformin[J].Diabetes Obes Metab, 2007, 9(5):733-745.
[18] Mari A, Sallas WM, He YL, et al.Vildagliptin, a dipeptidyl peptidase-IV inhibitor, improves model-assessed beta-cell function in patients with type 2 diabetes[J].J Clin Endocrinol Metab, 2005, 90(8):4888-4894.