碱性成纤维细胞生长因子对骨基质明胶包埋血管束的促血管化作用
2012-12-07王瑞芳秦书俭程应斌任占川
王瑞芳 秦书俭 程应斌 任占川
(山西医科大学汾阳学院基础部解剖教研室 山西汾阳 032200;①辽宁医学院;②山西省孝义市人民医院麻醉科)
骨折愈合是受多种因素影响的复杂过程,良好的血供对骨折的愈合是非常必要的。缺乏良好的血供将导致骨折延迟愈合和不愈合,因此,解决成骨区血管化的问题已经成为当前研究的热点和难点。本实验旨在探讨碱性成纤维细胞生长因子(bFGF)对骨基质明胶(BMG)包埋血管束的促血管化作用,为解决组织工程骨的血管化问题奠定基础。
1 材料与方法
1.1 实验动物 健康5月龄日本大耳白40只,体质量1.5~2.0kg,雌雄不限。
1.2 BMG的制备 将4只日本大耳白兔10%水合氯醛腹腔麻醉过量致死后取四肢骨、髂骨,大量蒸馏水清洗后,参照Urist[1]的方法将四肢骨的骺端和髂骨制备成6mm×4mm×3mm的BMG。
1.3 实验动物分组及BMG的植入方法 将36只日本大耳白兔随机分为A、B、C3大组,每大组又分为4、8、12周3个小组。A组:将隐动静脉游离1cm后顺行植入用2μg/mL bFGF处理过的BMG的凹槽内;B组:将隐动静脉游离1cm后顺行植入BMG的凹槽内,BMG不做任何预处理;C组则直接将未处理过的BMG植入,不必分离隐动静脉。最后将移植区逐层缝合。术后5d每天用4万U庆大霉素肌内注射预防感染。
1.4 墨汁灌注及取材 分别于手术后4、8、12周取各组动物,10%水合氯醛腹腔麻醉后,游离腹主动脉、下腔静脉,在腹主动脉离心插管。在下腔静脉做一切口,放血同时往动脉内注入大量肝素生理盐水,直至静脉远端流出无色液体。然后从腹主动脉注入配好的复合墨汁(墨汁、甲醛及生理盐水体积比为3:1:6),远端皮肤、趾甲均已变黑时结扎下腔静脉两端开口,继续灌入少量复合墨汁,结扎动脉保持血管内压力。低温放置24h后取出植入物置入4%多聚甲醛溶液中固定24h。
1.5 透明标本的制作及观察 取固定好的植入物,A、B、C3个组每个时间点各取两块,脱钙、去酸、漂白、脱水后二甲苯半透明和冬青油透明保存。用肉眼观察移植物血管形成情况并摄像。
1.6 HE和Masson染色组织学观察及定量分析 将剩余的固定好的植入物石蜡包埋、切片,厚度为5μm,分别进行HE染色和Masson染色,倒置显微镜下观察血管化及成骨情况,摄像。根据体视学德莱塞原理,参照空间内某特征物的面积分数是其体积分数的估计,以Masson染色组织片中血管的面积比来代表血管化水平,在每个蜡块标本的上、中、下部分分别作连续横向切片5片,置于显微镜下,以CIAS-1000细胞图像分析系统测算其新骨面积比及血管面积比。在放大100倍的条件下,每张片子选取四角及中心5个区域最后得一平均值,代表该组织块的血管面积比。
1.7 统计学处理 采用SPSS 13.0统计软件包处理所测得的数据,作多个样本均数的两两比较,α=0.05作为检验水准。
2 结果
2.1 一般情况 所有实验动物术后4~6h苏醒。术后切口无感染,下肢无坏疽,伤口Ⅰ期愈合,均存活至完成试验。
2.2 透明标本大体观察 A、B、C 3组从第4周开始均有少量新生血管从移植物边缘长入支架材料孔隙内,以后逐渐增多。A组移植物中央第4周时有小血管以芽生的方式从血管束中长出(图1),第8周时已经逐渐向外周长入,并与边缘长入的血管形成少量吻合(图2),第12周时从血管束中芽生的血管和从边缘长入的血管已完全吻合。B组移植物中央第4周时有小血管芽生,但较A组4周时为少,第8周时增多,第12周时从血管束芽生的血管与边缘长入的血管有少量吻合。C组移植物中央血管形成一直不太明显。
2.3 组织学观察 术后4周,3组移植物边缘均有纤维结缔组织和小血管形成,只有A组移植物中央有少量的血管。术后8周,3组移植物边缘长入的纤维结缔组织和小血管增多,血管排列紊乱,A组移植物中央血管量明显增加。术后12周,A组位于其中的新生血管排列已经比较有序(图3),B组的新生血管逐渐趋向于有序排列,C组新生血管排列还比较杂乱,主要集中于材料边缘,中央较少(图4)。

图1 术后4周,A组透明标本
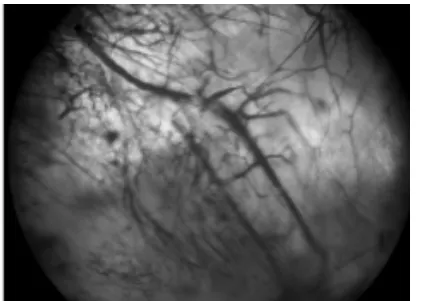
图2 术后8周,A组透明标本

图3 术后12周,A组 HE×200

图4 术后12周,C组Masson×200
2.4 血管面积定量分析 移植物血管面积图像分析结果见表1。从表中可以看出:4周时,A、B、C组之间互相差异都有显著性(P<0.05);8周时,A、B、C组之间互相差异都有显著性(P<0.05);12周时,A组与B、C组差异有显著性(P<0.05)。而且各组中随着时间的延长,移植物血管面积逐渐增加。
表1 移植物血管面积比比较( s,%)

表1 移植物血管面积比比较( s,%)
注:与A组比较,*P <0.05;与B组比较,△P <0.05;与C组比较,#P <0.05
组别 4周 8周 12周A组 2.16±0.02△# 2.43±0.15△# 4.65±0.14△#B组 0.86±0.06*# 1.12±0.13*# 2.46±0.11*C组 0.16±0.02*△ 0.51±0.09*△ 1.30±0.12*
3 讨论
长段骨干缺损修复难度大,主要与其特定解剖部位血供薄弱有关系。在骨修复中,微血管的长入,即血管化,能够将成骨细胞前体细胞、相关因子、营养物质及其它参与骨修复的细胞携带到局部微环境中,并带走局部新陈代谢产生的废物,以及坏死和分解产物,从整体上维持有利于这一生理过程的代谢微环境[2]。
本实验透明标本观察可以看出,A组、B组在术后第4周时可见小血管以芽生的方式从血管束中长出,以后逐渐增多并开始向外周长入,术后第12周时与从材料边缘长入的血管形成吻合。相反C组材料中央的血管形成一直到12周时都不太明显。说明血管束植入的办法可以促进血管化,血管束植入材料内部以后缩短了再血管化的距离,比较符合生理上骨的血供特点。这与国内外学者的研究结果是一致的:Philippe[3]将中空的复合骨髓基质细胞的珊瑚陶瓷材料置于大鼠大腿肌袋中,分离股动静脉将其植入材料的管道内,发现血管束的植入明显促进了材料细胞复合物的血管化及成骨能力。
要实现组织工程骨的血管化,必须要有促血管生成因子的存在[4]。促血管生成因子很多,Norrby[5〛描述了 38 种之多,主要有 VEGF、bFGF、Ang、PDGF、TGF、HGF、EGF 等。目前在动物模型实验中广泛使用的仍然是VEGF和bFGF。本实验在植入血管束的基础上,观察到加bFGF的A组在术后第4周就可以看到小血管以芽生的方式从植入的血管束中长出,第8周时就已经开始与边缘长入的血管形成吻合,第12周时已经完全吻合,实现完全血管化。组织学观察和定量分析可以看出B组中央的血管在术后第4、8、12周一直少于A组,到术后第12周时A组的新生血管已经形成有序排列,而B组的新生血管刚开始趋向于有序排列。可见bFGF对BMG包埋血管束有促血管化的正协同作用。成纤维细胞生长因子是一类对中胚层及神经胚层来源的细胞具有强烈促增殖和分化作用的有多种生物学活性的多肽类细胞生长调节因子[6]。自1974年被美国著名生化学家Gospodarowicz分离、提纯并命名以来,发现其不仅对成纤维细胞,而且对血管内皮细胞、平滑肌细胞、软骨细胞以及神经系统的星状胶质细胞等都具有促增殖、分裂的生物学效应。近年来的研究表明[7,8]成纤维细胞生长因子家族中,等电点为9.6,分子量为25kD,由146个氨基酸组成的bFGF广泛分布于人体的组织器官中,具有很强的生物学活性,因而在组织、细胞的增殖、分化中起着极其重要的作用。
虽然关于促血管生长因子的基础研究报道已经很多,但真正应用于临床,尚有许多问题有待解决,如:①确切的使用剂量,就bFGF来说,不同的论文报告的bFGF的剂量有时竟相差100倍左右,作用于人体上,何为最低有效剂量,何为最佳有效剂量,还需要作更深入地研究;②简便、有效的给药方式,多数人主张连续多次给药,以保持组织中有效的药物浓度,更明智的方法是将bFGF置入一种缓释装置中再移植入局部组织中,使其长时间缓慢释放药力,发挥作用;③是应用一种促血管生长因子,还是多种因子联合应用作用更佳。目前对组织工程骨血管化的方法和机理还不太明确,还要继续深入广泛的研究。
[1]Urist MR.Bone:formation by autoinduction[J].Science,1965,150(698):893
[2]Bruder SP,Fos BS.Tissue engineering of bone.Cell based strategies[J].Clin Orthop Relat Res,1999,367:68
[3]Philippe P,Villars F,Mathoulin-Pelissier S.Influences of vascularization and osteogenic cell on heterotopic bone formation within a madreporic ceramic in rats[J].Plast Reconstr Surg,2003,111(6):1932
[4]王 珍,罗静聪,杨志明.组织工程化血管生长因子的研究[J].中国临床康复,2006,10(1):130
[5]Norrby K.Angiogenesis:new aspects relating to its initiation and control[J].Nat Med,1995,1:1024
[6]Folkman J,Shing Y.Angiogenesis[J].J Biol Chem,1992,267(16):10 931
[7]Wenger A,Stahl A,Weber H,et al.Modulation of in vitro angiogenesis in a three-dimensional spheroidal coculture model for bone tissue engineering[J].Tissue Eng,2004,10:1536
[8]Slavin J.Fibroblast growth factors:at the heart of angiogenesis[J].Cell Biol Inter,1995,19(5):431
