急性缺血再灌注损伤对猪心冠状动脉功能的影响
2012-12-07赵阳超乔晨晖StigSteen
赵阳超,乔晨晖#,马 宁,Stig Steen
1)郑州大学第一附属医院心血管外科郑州 450052 2)瑞典隆德大学医院心胸外科生命科学实验室隆德 22594 #通讯作者,男,1961年9月生,教授,研究方向:心脏移植,E-mail:qchenhui@hotmail.com
急性缺血再灌注损伤对猪心冠状动脉功能的影响
赵阳超1),乔晨晖1)#,马 宁1),Stig Steen2)
1)郑州大学第一附属医院心血管外科郑州 450052 2)瑞典隆德大学医院心胸外科生命科学实验室隆德 22594 #通讯作者,男,1961年9月生,教授,研究方向:心脏移植,E-mail:qchenhui@hotmail.com
冠状动脉;内皮细胞;平滑肌;内皮依赖性舒张;缺血再灌注损伤;猪
目的:探讨急性缺血再灌注损伤对猪心冠状动脉功能的影响。方法:健康瑞典家猪24头,随机分为3组:对照组、缺血组、缺血再灌注组,每组8头。对照组开胸后观察1 h,直接切取心脏;缺血组阻断左冠状动脉前降支中下1/3交界处1 h后切取心脏;缺血再灌注组阻断左冠状动脉前降支中下1/3交界处30 min然后再灌注30 min后切取心脏。3组均进行器官浴槽实验,评价冠状动脉平滑肌和内皮细胞的功能。结果:对照组、缺血组、缺血再灌注组的平滑肌最大收缩值分别为16.94(10.22~24.24)、13.03(8.92~16.94)和8.76(5.97~14.91)mN,最大舒张值均为100%,差异均无统计学意义(P>0.05);最大内皮依赖性舒张百分数(EDRmax)分别为(97.66± 1.86)%、(89.52±0.96)%和(85.21±2.60)%,舒张至50%最大收缩时P物质浓度的负对数(pEC50)分别为(9.51±0.80)、(8.19±0.35)和(7.64±0.24),3组比较差异均有统计学意义(F=86.010、26.780,P均<0.001);与对照组相比,缺血组和缺血再灌注组EDRmax和pEC50均降低(P<0.05),缺血再灌注组降低更明显(P<0.05)。结论:急性缺血再灌注明显损伤猪心冠状动脉内皮细胞的功能。
尽早恢复冠脉血流是目前治疗缺血性心脏病的有效手段,如溶栓术、冠状动脉搭桥术、经皮冠状动脉内球囊扩张和支架植入术等[1],但是众多研究[2-3]结果表明再灌注是一把双刃剑,会引起心肌更严重的损伤。近年来对缺血再灌注损伤的研究主要集中在心肌组织,而对冠状动脉尤其是内皮细胞的缺血再灌注损伤研究较少,因此研究缺血再灌注损伤时冠脉血管尤其是内皮细胞的功能状态,对于尽可能减少再灌注损伤具有重要的指导意义。基于此,该实验以猪心冠状动脉左前降支(LAD)中下1/3血管为对象,采用器官浴槽实验,评价缺血再灌注损伤对血管的内皮细胞依赖性舒张功能的影响。
1 材料与方法
1.1 实验动物 健康瑞典家猪24头,由瑞典隆德大学医院心胸外科生命科学实验室提供,雌雄不拘,体质量(35±2)kg。课题经瑞典隆德大学实验动物伦理委员会批准。
1.2 主要药品和仪器 麻醉药品(氯胺酮、甲苯塞嗪、硫喷妥钠、阿托品、泮库溴铵);Krebs溶液,含NaCl 119 mmol/L,KCl 4.6 mmol/L,MgCl21.2 mmol/L,CaCl21.5 mmol/L,NaHCO315 mmol/L,NaH2PO41.2 mmol/L,葡萄糖11 mmol/L,为新鲜配制;血栓素A2类似物U-46619;P物质;罂粟碱。Stemi 1000型手术显微镜;7E型多导记录仪及FT03D型张力传感器;肌动描记器;呼吸机(Siemens Servo ventilator300A);心电监测仪 (Medtronic LIFEPAK 12);血压监测仪(Spacelabs Medical)。以上药品和仪器均由瑞典隆德大学医院心胸外科生命科学实验室提供。
1.3 实验分组 将24头猪按随机数字表法分为3组,对照组、缺血组及缺血再灌注组,每组8头。麻醉后给予气管插管,呼吸机辅助呼吸。备皮消毒,正中开胸,充分暴露心脏。对照组开胸后观察1 h,直接切取心脏。余2组游离LAD中下1/3交界处,缺血组直接阻断1 h,然后切取心脏;缺血再灌注组在阻断位点处放置橡皮套管,收紧橡皮套管30 min后,再开放30 min,然后切取心脏。
1.4 心脏切取和冠状动脉标本的制备 取心脏时均先全身肝素化(400 U/kg),开胸,结扎下腔静脉,阻断升主动脉后立即在根部灌注4℃心脏停搏液,快速剪开上腔静脉、左心耳,避免心脏过度充盈,待心脏均匀降温、停跳满意后,取出心脏,置于4℃心脏停搏液中。遵循无创剥离的原则,在手术显微镜下,取出约1 cm长的LAD中下1/3交界处远端血管(外径1.0~1.5 mm)。然后将其截成约1 mm长的完整血管环,一般3段即可。标本制备时间小于20 min。
1.5 冠状动脉功能测定
1.5.1 测定环境 器官浴槽内持续充以体积分数95%O2和体积分数5%CO2的混合气,使Krebs溶液达到氧合、生理pH值(约7.40),每隔15 min更换溶液1次。器官浴槽容量为5 mL,恒温37℃的蒸馏水可以通过环绕浴槽的空腔持续循环,从而保证浴槽恒温。每次实验前,充入Krebs溶液温浴至少30 min。温浴后,在手术显微镜下,将血管环无创悬挂于器官浴槽内两个平行的L形金属挂钩上,一端挂钩连接螺旋移动器,以此牵拉、调节冠状动脉环张力;另一端挂钩连接张力传感器,并与Grass 7E型多导记录仪连接,用于持续测定冠状动脉环的等长张力。
1.5.2 冠状动脉环功能测定 调零后反复牵拉血管,调节张力平衡至基础张力。此时测量2个金属挂钩之间的距离,作为平衡时冠状动脉环的内径。再次调零后用5.7×10-7mol/L的U-46619共10 μL诱导血管环预收缩,达到最大张力后反复更换Krebs溶液直至恢复基础张力,再次加入相同剂量、浓度的U-46619诱导血管环第2次收缩达到最大张力,稳定时的张力值即为预收缩值,以此作为最大收缩值(Cmax)。当血管环收缩达到预收缩值之后,依次向浴槽内加入50 μL浓度递增的P物质(10-14~10-6mol/L),诱导内皮依赖性舒张(endothelium dependent relaxation,EDR)。计算诱导的最大EDR占最大收缩的百分数,即最大舒张百分数(EDRmax);同时计算EDR为最大收缩的50%时P物质浓度的负对数(pEC50)。最后加入50 μL 10-4mmol/L的罂粟碱,测试3组血管环能否达到最大舒张(Rmax)。1.6 统计学处理 采用SPSS 17.0进行数据处理。3组EDRmax、pEC50、血管内径的比较均应用单因素方差分析及LSD-t检验;Cmax指标不符合正态分布,故采用M(P25~P75)报告结果,并采用秩和检验进行3组间比较;检验水准α=0.05。
2 结果
2.1 3组冠状动脉环内径的比较 在基础张力下,对照组、缺血组及缺血再灌注组的冠状动脉环内径分别为(1.25±0.18)、(1.19±0.21)和(1.31± 0.21)mm,3组间差异无统计学意义(F=0.629,P=0.543)。
2.2 3组U-46619诱导的血管平滑肌Cmax的比较对照组、缺血组、缺血再灌注组U-46619诱导的血管平滑肌的Cmax分别为16.94(10.22~24.24)、13.03 (8.92~16.94)和8.76(5.97~14.91)mN,3组间比较,差异无统计学意义(χ2=3.935,P=0.140); Rmax均为100%。
2.3 3组内皮细胞EDRmax、pEC50的比较 结果见表1。
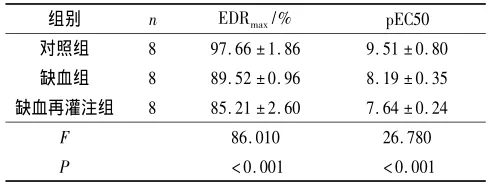
表13 组内皮细胞EDRmax、pEC50的比较
3 讨论
近年来,对缺血再灌注损伤的研究主要集中在心肌组织[4-5],而对冠状动脉尤其是内皮细胞的缺血再灌注损伤研究较少。冠状动脉尤其是内皮细胞功能在心肌缺血性损伤中的重要性越来越引起重视,其功能可通过器官浴槽实验测定的内皮依赖性舒张来评价[5]。在器官浴槽实验中,罂粟碱通过作用于冠状动脉血管平滑肌,抑制磷酸二酯酶,增加血管平滑肌细胞内cGMP生成,减少钙离子内流,引起冠状动脉平滑肌舒张,是一种非内皮细胞依赖性血管舒张剂。U-46619是一种稳定的内皮非依赖性血管收缩剂。P物质通过与内皮上的相关受体结合,刺激内皮释放内皮源性舒张因子(endothelium derived relaxing factor,EDRF),作用于平滑肌,从而发挥血管舒张作用[6]。
该研究结果表明,在冠脉缺血恢复血流后,冠状动脉内皮细胞的依赖性舒张功能比缺血组下降更明显,其原因可能有以下几点。①血管紧张素Ⅱ:再灌注时,血管紧张素Ⅱ生成增加,促进交感神经释放儿茶酚胺、收缩血管、刺激醛固酮分泌、促进内皮细胞水肿等[7]。②氧自由基:氧自由基对细胞膜的损伤主要表现在其可与膜内多价不饱和脂肪酸作用,使之发生氧化,造成多种损害,破坏膜的正常结构,间接抑制膜蛋白功能,减少ATP生成,抑制蛋白质功能,破坏核酸及染色体[8]。③钙超载:再灌注后,胞质内钙离子浓度明显增加,钙离子与线粒体内含磷酸根的化合物结合,形成不溶性磷酸钙,干扰线粒体的氧化磷酸化,使ATP生成减少[9]。④白细胞:再灌注后,大量白细胞聚集在缺血区的微血管内,导致微血管机械性堵塞[10]。⑤无复流现象:是指缺血再灌注时,部分或者全部缺血组织不出现血液灌流的现象。原因可能是微血管障碍及中性粒细胞栓塞,血小板或者血栓堵塞微血管,膨胀的心肌细胞挤压微血管[11]。⑥能量代谢障碍:再灌注时,因合成ATP的底物被冲出内皮细胞,或者因无复流现象,ATP无法进入内皮细胞,以致高能化合物合成障碍;再灌注时,尽管供给内皮细胞富含氧血,但因在内皮细胞缺血或者再灌注时,线粒体受损,出现用氧障碍;再灌注时,细胞膜Na+-H+交换、Na+-Ca2+交换相继被激活,而这些过程具有能量依赖性,使ATP消耗增加[12]。
另外,作者还观察到,3组之间平滑肌舒缩功能差异无统计学意义,表明平滑肌细胞的抗损伤能力优于内皮细胞。
总之,该研究结果表明,短暂的冠脉缺血再灌注会导致冠状动脉内皮细胞功能的急性损伤,因而,非常有必要进一步研究其发生机制、演变过程及内皮细胞的修复机制等,进而对预防或减少冠状动脉内皮细胞的缺血再灌注损伤提供有效的解决方案。
[1] Azambuja AP,Portillo-Sanchez V,Rodrigues MV,et al.Retinoic acid and VEGF delay smooth muscle relative to endothelial differentiation to coordinate inner and outer coronary vessel wall morphogenesis[J].Circ Res,2010,107(2):204
[2]Brinks H,Boucher M,Gao E,et al.Level of G protein-coupled receptor kinase-2 determines myocardial ischemia/ reperfusion injury via pro-and anti-apoptotic mechanisms[J].Circ Res,2010,107(9):1140
[3]Chu LM,Osipov RM,Robich MP,et al.Effect of thrombin fragment(TP508)on myocardial ischemia reperfusion injury in a model of type 1 diabetes mellitus[J].Circulation,2010,122(11 suppl):S162
[4]张艳芳,李秀敏,杨瑞.p53 mRNA和Caspase-3 mRNA在幼年大鼠心肌缺血再灌注损伤中的动态表达及药物干预作用[J].实用儿科临床杂志,2009,24(13):1006
[5]马宁,张伟华,周志明,等.间断与持续低温灌注对离体猪心冠状动脉功能的影响[J].郑州大学学报:医学版,2009,44(6):1224
[6]Ciccarelli M,Chuprun J,Rengo G,et al.G protein-coupled receptor kinase 2 activity impairs cardiac glucose uptake and promotes insulin resistance after myocardial ischemia[J].Circulation,2011,123(18):1953
[7]Demers P,Elkouri S,Sirois MG,et al.Coronary artery endothelial dysfunction after ischemia-reperfusion and acute untreated rejection in a canine heterotopic heart transplantation model[J].Transplantation,2001,71(1):26
[8]Zhai P,Sciarretta S,Galeotti J,et al.Differential roles of GSK-3β during myocardial ischemia and ischemia/reperfusion[J].Circ Res,2011,109(5):502
[9]Kapoor A,Collino M,Castiglia S,et al.Activation of peroxisome proliferator-activated receptor-beta/delta attenuates myocardial ischemia/reperfusion injury in the rat[J].Shock,2010,34(2):117
[10]Kempf T,Eden M,Strelau J,et al.The transforming growth factor-beta superfamily member growth-differentiation factor-15 protects the heart from ischemia/reperfusion injury[J].Circ Res,2006,98(3):351
[11]Kondo K,Shibata R,Unno K,et al.Impact of a single intracoronary administration of adiponectin on myocardial ischemia/reperfusion injury in a pig model[J].Circ Cardiovasc Interv,2010,3(2):166
[12]Korkmaz S,Radovits T,Barnucz E,et al.Pharmacological activation of soluble guanylate cyclase protects the heart against ischemic injury[J].Circulation,2009,120(8):677
Effects of acute ischemia-reperfusion injury on coronary artery function of porcine heart
ZHAO Yangchao1),QIAO Chenhui1),MA Ning1),Stig Steen2)1)Department of Cardiovascular Surgery,the First Affiliated Hospital,Zhengzhou University,Zhengzhou 450052 2)The Life and Science Laboratory of Cardiothoracic Surgery,Lund University Hospital,Lund SE-22594
coronary artery;endothelial cell;smooth muscle;endothelium dependent relaxation;ischemia-reperfusion injury;porcine
Aim:To investigate the effects of acute ischemia-reperfusion injury on coronary artery function in porcine hearts.Methods:Twenty four Swedish domestic pigs were randomly divided into three groups:control group,ischemia group,ischemia-reperfusion group,eight in each group.The hearts in control group were observed for 1 h after thoracotomy and then were removed directly.The hearts in ischemia group were removed after 1 h occlusion of left anterior descending distal coronary artery(LAD).The hearts in ischemia-reperfusion group were removed after 30 min of occlusion and 30 min of reperfusion of LAD.Then the functions of smooth muscle and endothelial cells of LAD were evaluated in organ baths.Results:The maximal contraction(Cmax)of smooth muscle in control,ischemia,and ischemia-reperfusion group were 16.94(10.22~24.24),13.03(8.92~16.94)and 8.76(5.97~14.91)mN,respectively,and the maximal relaxation percentage(Rmax)of smooth muscle were all 100%.There were no significant differences in Cmaxand Rmaxamong the 3 groups(P>0.05).The maximal endothelium dependent relaxation(EDRmax)were(97.66±1.86)%,(89.52±0.96)%and(85.21±2.60)%,and the negative logarithm of the concentration of P substance(pEC50)were(9.51±0.80),(8.19±0.35),and(7.64±0.24).There were significant differences in EDRmaxand pEC50 among the 3 groups(F=86.010,26.780,P<0.001).Compared with those of the control group and ischemia group,both EDRmaxand pEC50 in ischemia-reperfusion group were lower(P<0.05).Conclusion:Acute ischemia-reperfusion can injure the function of endothelial cells of porcine heart.
R654.2
10.3969/j.issn.1671-6825.2012.06.022
(2012-02-15收稿 责任编辑王 曼)
