不同类型肺曲菌病的CT特点分析
2012-12-07任振义马若冰
金 儿 任振义 李 靖 马若冰
肺曲菌病是少见的肺部真菌感染性疾病。由于患者的基础疾病和免疫状态不同,曲霉菌感染肺部后会产生不同的临床症状、影像学表现和病理改变。肺曲菌病通常分为3种类型,肺曲霉球病(PA)、变态反应性支气管肺曲霉菌病(ABPA)和侵袭性肺曲霉菌病(IPA),近年来国内外对罕见的支气管阻塞性曲霉菌病(OATB)也有报道[1]。肺曲霉菌病的临床表现缺乏特异性,但其影像学表现各有特点。为提高对该病的认识,本研究对1999年1月~2010年9月在笔者医院就诊的肺曲霉菌病患者28例进行回顾性分析,现报告如下。
资料与方法
1.一般资料:对1999年1月~2010年9月在笔者医院诊断的肺曲霉菌病患者40例进行回顾性分析。PA20例,男性12例,女性8例,年龄37~70岁,平均年龄52.4岁,16例合并陈旧性肺结核,4例合并支气管扩张,均有咳嗽咳痰,其中14例有咯血,6例有低热,3例气促。ABPA5例,男性3例,女性2例,年龄50~63岁,平均年龄58.2岁,无基础疾病,均有咳嗽、咳痰、喘息,3例伴有胸闷。IPA 12例,男性18例,女性4例,年龄40~81岁,平均年龄46.9岁,8例有血液系统肿瘤,均有多次化疗史;另外4例患者中陈旧性肺结核3例,支气管扩张1例。均有咳嗽咳痰气促,17例持续高热,10例咯血,胸痛5例,明显消瘦3例。OATB 3例,男性2例,女性1例,年龄63~72岁,平均年龄62.5岁。1例兼有糖尿病史和肿瘤病史,其他2例有高血压病史。均有咳嗽咳痰、咯血、气促,2例低热。
2.诊断依据:20例PA患者中12例手术后病理明确,8例患者除典型的胸部CT表现外,2次以上痰培养为曲霉菌。确诊ABPA5例,依据2008年美国感染学会制定的曲霉菌诊治指南[2]。12例IPA患者4例确诊,3例均由手术后病理明确,1例经皮肺穿刺后病理明确。6例血液系统肿瘤患者均有临床表现,典型的胸部CT表现,支气管肺泡灌洗液培养曲菌5例,痰培养曲菌1次以上3例,均为临床诊断患者,2例为拟诊患者,有临床表现和胸部CT表现,无病原学依据。3例OATB 1例手术后病理明确,2例纤维支气管镜活检后病理明确。
3.影像检查方法:用GE high speed单层CT机或GE light speed 16层CT机,120kV,250mA。40例均行胸部CT扫描,其中19例患者先行胸部CT平扫,平扫后用高压注射器注入优维显80~100ml进行增强扫描。影像资料由3位高年放射科医师共同阅读确定诊断,病理诊断结果由病理科医师报告。
结 果
1.PA的CT表现:病变位于右肺上叶11例,右肺下叶4例,左肺上叶4例,右肺中上叶1例。20例患者CT均表现为肺部空洞内有圆形或椭圆形结节状影(曲菌球);周围可见新月形低密度透亮区15例(图1),环形低密度透亮区5例。曲菌球呈密度均匀改变的11例,不均匀改变的9例;曲菌球边缘清楚的12例,边缘有毛刺的8例。其中最大的曲菌球径约5.5cm × 6.6cm × 5.9cm,最小者球径约 3.8cm ×1.8cm×2.4cm。4例患者行增强CT,3例空洞壁不规则强化,曲菌球未见强化。6例患者经变换体位扫描,3例见曲菌球随体位改变而移动(滚珠征)。伴有胸膜增厚14例,周围性支气管扩张7例,两上肺纤维化4例,钙化3例。

图1 右肺曲菌球
2.ABPA的CT表现:病灶发生在两肺上叶4例,右中叶2例,右下叶2例。4例患者发现囊状或静脉曲张样支气管扩张和支气管黏液栓形成,其中2例合并密度增高的牙膏样、树枝样或指套样阴影(图2)。2例患者支气管纹理增多增粗。5例患者未见肺不张、胸膜增厚的表现。3例患者行增强CT,病灶未见明显强化。

图2 变态反应性支气管肺曲霉菌病
3.IPA的CT表现:8例患者表现为两肺多发类圆形小结节周围包绕晕征,密度低于结节中心而高于肺实质密度(图3),结节伴有小片楔型实变4例,6例患者行增强CT,病灶强化不明显;2例表现为近胸膜下团块影,密度不均,有轻微分叶,边缘较光整,增强后病灶边缘有不规则强化,其中1例团块影中心出现低密度影内有较多小空洞和空气半月征(图4),1例团块边缘略有“晕征”;1例见右肺大片云絮状密度增高影,密度不均匀,两肺多发微小结节,胸膜增厚,增强后病灶无明显强化(图5);只表现为右下肺片状渗出影1例;伴胸腔积液5例,双下肺或局部肺纹理增粗4例,纤维索条影3例,肺气肿1例,肺大泡1例。

图3 侵袭性肺曲霉菌病
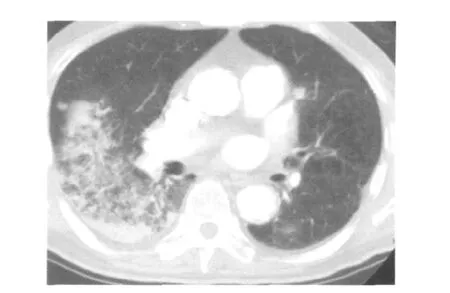
图4 侵袭性肺曲霉菌病
4.OATB的CT表现:1例右上肺见直径3cm左右的团块影,密度不均,边界不清,不均匀强化(图6),纤支镜下见左上叶支气管开口新生物;1例表现为右肺中叶类圆形肿块,直径约4cm,边界不清,纤维支气管镜下见右中叶支气管开口新生物。1例见右主支气管内高密度结节影(图7),右肺中下叶支气管堵塞,中下叶纵隔旁见团块状软组织肿块影,呈分叶状,右侧胸腔见少量包裹性积液,纤维支气管镜下见右主支气管开口新生物(图8)。

讨 论
近年来肺曲霉菌病发病呈上升趋势,病死率极高,早期诊断相当重要。不同类型的肺曲霉菌病诊断标准不同,胸部CT表现各有特征,是诊断肺曲霉菌的重要手段。

图8 阻塞性支气管曲霉菌病纤维支气管镜下表现
PA发病率估计在0.01% ~0.02%,免疫功能基本正常,男性多于女性,多继发于肺部慢性空腔性疾病,肺结核空洞是曲菌球形成的最常见原因,本组患者男性占60%,基础疾病肺结核占80%。由于肺结核好发于上叶,曲菌球病灶相应多见于上叶,因其在寄生空洞或扩张的支气管内,体积受到限制,一般直径3~6cm,本组患者大部分在右上叶,其中1例跨叶生长,少见。其CT特征是在空洞内存曲菌球,球密度较均匀致密,曲菌球由不断繁殖的曲菌菌丝体,炎症细胞,纤维蛋白,黏膜上皮,组织碎片组成。菌丝体的不定向繁殖导致曲菌球边缘常见分叶和毛刺。“空气新月症”和“空气环症”使曲菌球容易辨认,本组患者空气新月征占75%,空气环征占25%。若曲菌球填充整个空洞,空气征不存在,易于肿瘤相混淆。部分曲菌球随着病人体位的改变体位曲菌球的位置可发生改变[3]。曲菌球需与镰孢菌、接合菌形成的真菌球相鉴别,主要通过鉴别病原菌明确。基础疾病和胸部CT的特征性表现对PA的诊断起了至关重要的作用。
ABPA是由曲霉菌定植在支气管导致变态反应性疾病,包括Ⅰ型、Ⅲ型和Ⅳ型变态反应,占支气管哮喘的1%。临床分为5期,急性期、缓解期、复发加重期、激素依赖期、纤维化期。其特征性的CT表现是以上叶为主的支气管囊状或静脉曲张样扩张,支气管管壁增厚和双轨征,印戒征,由于分泌物痰栓堵塞支气管可表现为条带状、分支状或牙膏状、指套样阴影,多在急性期、复发加重期和激素依赖期明显[4]。病理上可见支气管黏液嵌塞,管腔和管壁嗜酸粒细胞炎性细胞浸润,可见夏科-雷登晶体及以支气管为中心的坏死性肉芽肿。本组患者4例出现特异性的CT表现,2例出现急性期,2例出现复发加重期。若疾病得不到控制,会发展到纤维化期,本组患者未发现纤维化期。ABPA的支气管扩张需与普通支气管扩张相鉴别,普通支气管扩张多见于下叶,以外周支气管扩张较多见,而ABPA多累及上叶,且以中心性支气管扩张为著。普通支气管扩张的黏液嵌塞多为低密度,而ABPA的密度较高。本组患者1例在急性期确诊,CT表现仅为支气管纹理增多增粗。
IPA多见于血液系统疾病、骨髓移植和艾滋病患者,病死率极高,早期诊断非常重要。肺曲菌病的诊断可分确诊、临床诊断及拟诊3个级别,本组患者6例恶性血液系统患者为临床诊断病例,2例为拟诊患者,而其他4例免疫功能正常的患者均通过病理确诊。胸部CT是诊断IPA的重要手段,主要表现为楔形实变、多发结节影及小斑片状影,30% ~60%的患者伴有“晕征”,提示早期IPA,有较高的特异性,其病理是曲霉菌侵袭血管导致的局部出血,是患者引起咳血的原因。一般起病后14天晕症消失[1]。空气新月症是IPA的另一重要的CT表现,主要在IPA的后期出现,但其特异性低于晕症[5~7]。空气新月症需与肺曲菌球病相鉴别,后者一般无免疫抑制。Horger等[6]发现团块或结节中心的低密度影对IPA的诊断具有相当高的特异性,迟于晕症,但比空气新月症出现早。本组患者发现中心低密度影1例,病理确诊。Greene等[8]分析了235例IPA病人的胸部CT表现,发现在94%的病人中有多发小结节,61%的病人存在晕症,团块影占30%,楔型实变影占27%,空气新月症占10%。本组患者多发小结节伴晕症占66.7%,4例伴有小片楔型实变占33.3%,团块影占16.6%,中心低密度影占8.3%,空气新月症占8.3%。侵袭性肺曲霉菌病诊断非常困难,尤其在血液系统肿瘤患者中,痰培养阳性率极低,胸部CT的表现是临床诊断的重要依据。
OATB为少见疾病,目前分类尚不明确,大部分作者也有认为是IPA的亚类,也有认为是ABPA的亚类。其病理改变表现为:曲菌侵袭气管、支气管黏膜引起渗出性病变、纤维化,坏死物质增生沉积形成假膜,导致管腔狭窄,严重时致管腔完全阻塞[8]。胸部CT的特征性表现为支气管管腔内新生物突出,导致局部管腔狭窄或完全堵塞,可伴有黏液嵌塞和肺不张[9]。也可表现为气管壁增厚或团块影等表现。胸部CT表现在诊断中起一定作用,纤维支气管镜下活检后组织病理检查是确诊该病的最直接有效的方法[10]。本组患者中1例CT发现多处支气管新生物,2例表现为团块影,1例团块影的不均匀强化考虑为曲霉菌侵袭肺血管导致出血。3例患者均在纤维支气管镜下发现新生物,均误诊为肺癌,后经组织病理检查明确。
总而言之,不同类型的肺曲霉菌病具有不同的临床症状、CT影像特点和病理特点,了解这些特点不仅对临床诊断和分型有指导作用,而且对该病的发展和治疗评估都有重要意义。
1 Danner BC,Didilis V,Drge H,et al.Surgical treatment of pulmonary aspergillosis/mycosis in immunocompromised patients[J].Interact Cardiovasc Thorac Surg,2008,7(5):771-776
2 Walsh TJ,Anaissie EJ,Denning DW,et al.Treatment of aspergillosis:clinical practice guidelines of the Infectious Diseases Society of A-merica[J].Clin Infect Dis,2008,47(3):327 - 360
3 Bandoh S,Fujita J,Fukunaga Y,et al.Cavitary lung cancer with an aspergilloma- like shadow[J].Lung Cancer,1999,26(3):195 -198
4 Agarwal R,Aggarwal AN,Gupta D.High-attenuation mucus in allergic bronchopulmonary aspergillosis:another cause of diffuse highattenuation pulmonary abnormality[J].AJR Am JRoentgenol,2006,186(3):904
5 Caillot D,Couaillier JF,Bernard A,et al.Increasing volume and changing characteristics of invasive pulmonary aspergillosis on sequential thoraciccomputed tomography scans in patients with neutropenia[J].JClin Oncol,2001,19:253 -259
6 Horger M,Einsele H,Schumacher U,et al.Invasive pulmonary aspergillosis:frequency and meaning of the“hypodense sign”on unenhanced CT[J].Br JRadiol,2005,78(932):697 -703
7 李强.阻塞性气管、支气管曲菌病[J].中华内科杂志,2006,45(8):686-688
8 Greene RE,Schlamm HT,Oestmann JW,et al.Imaging findings in acute invasive pulmonary aspergillosis:clinical significance of the halo sign[J].Clin Infect Dis,2007,44(3):373 -379
9 Franquet T,Muller NL,Gimenez A,et a1.Spectrum of pulmonary aspegillosis:histologic,clinical,and radiologic findings[J].Radiographics,2001,21(4):825-837
10 Wu N,Huang Y,Li Q,et al.Isolated invasive Aspergillus tracheobronchitis:a clinical study of 19 cases[J].Clin Microbiol Infect,2010,16(6):689-695
